自噬抑制剂3-甲基腺嘌呤对顺铂诱导肺癌A549细胞凋亡的影响
刘飞飞 杨安帮 温丰标 刘东雷 杨 洋 吴 恺 赵 松
(郑州大学第一附属医院胸外科,河南 郑州 450052)
化疗和放疗在肿瘤细胞内可以诱导细胞发生自噬〔1〕。顺铂(DDP)是肺癌化疗常用的药物之一,通过干扰DNA复制诱导细胞凋亡,还能促进细胞自噬性死亡,但癌细胞容易对其产生耐药性,因此,如何提高DDP诱导癌细胞凋亡能力,增加癌细胞对其敏感性是困扰临床急需解决的问题。相关研究认为自噬是化疗药物作用机制之一,可能在耐药性中发挥一定作用〔2〕。本研究通过DDP诱导肺癌A549细胞凋亡,再联合自噬抑制剂三甲基腺嘌呤(3-MA),探讨抑制自噬对DDP诱导肺癌A549细胞凋亡的影响。
1 材料与方法
1.1 细胞与试剂 肺癌A549细胞由河南省高等学校临床医学重点学科开放实验室提供;3-MA、Hoechst33342荧光染料、二甲基亚砜(DMSO)、单丹黄酰尸胺(MDC)、四甲基偶氮唑盐(MTT)购于Sigma公司。DDP购于山东齐鲁制药有限公司。胎牛血清购于杭州四季青生物工程材料有限公司。无血清细胞冻存培养基(RPMI1640)、不含乙二胺四乙酸(EDTA)胰蛋白酶、4%多聚甲醛购于北京索莱宝科技有限公司。Annexin6异氰酸荧光素/碘化丙啶(V-FITC/PI)细胞凋亡检测试剂盒购于南京凯基生物科技发展有限公司。
1.2 方法
1.2.1 细胞培养及分组 用含10%胎牛血清、100 U/ml青霉素和100 U/ml链霉素的RPMI1640培养基在37℃、5%CO2、湿度饱和的培养箱中培养细胞,每3 d更换一次培养液,用胰酶混合液(含0.02%EDTA和0.25%胰酶)消化细胞进行传代或实验操作。实验分为不加药物干预的对照组、3-MA组、DDP组、3-MA和DDP联合作用组(同时加入DDP和3-MA)。
1.2.2 MTT法检测药物最适浓度和作用时间 取对数生长期细胞进行消化制成细胞悬液,以1×105个/ml浓度接种于96孔板,每孔150 μl,培养24 h,弃培养液,分别加入一系列浓度梯度的DDP及3-MA,每孔加入150 μl,每个浓度设置5个复孔,对照组加入等体积培养液,置于37℃、5%CO2、湿度饱和的培养箱中分别培养24、48、72 h。然后每孔加入浓度为5 g/L的四唑盐(MTT)20 μl,继续培养4 h,弃培养液,然后每孔加入150 μl DMSO,振动10 min,通过酶标仪测490 nm波长的吸光度值,细胞抑制率=〔1-实验组A490 nm/对照组A490 nm〕×100%,每次实验重复3次。
1.2.3 MTT法检测细胞增殖率 按上述方法于96孔板接种细胞培养24 h,按实验分组分别加入终浓度为10 mmol/L的3-MA和5 mg/L的DDP,分别设不加细胞的空白对照组、不加药物的对照组,对照组加入等体积的培养液,每组设5个复孔,置于37℃、5%CO2、湿度饱和的培养箱中培养24 h,然后每孔加入浓度为5 g/L的MTT 20 μl,继续培养4 h,弃培养液,然后每孔加入150 μl DMSO,振动10 min,通过酶标仪测490 nm波长的吸光度值,细胞增殖率=实验组A490 nm/对照组A490 nm×100%,每次实验重复3次。
1.2.4 MDC染色检测细胞自噬变化〔3〕用胰蛋白酶处理处于对数生长期的肺癌A549细胞,以1×105个/ml浓度加入24孔板,待细胞贴壁后,根据实验分组加入相应浓度药物作用24 h,弃培养液,用浓度为 50 μmol/L的 MDC在 37℃ 孵育60 min,PBS洗3次,用4%多聚甲醛4℃固定15 min,PBS洗3次,用倒置荧光显微镜观察自噬空泡的变化情况并摄片,通过流式细胞仪测定不同组细胞荧光强度。
1.2.5 Hoechst33342染色检测细胞形态变化 用胰蛋白酶消化处于对数生长期的细胞,制成1×105个/ml细胞悬液,接种于24孔板中,待细胞贴壁后,分别加入相应浓度药物作用24 h后,弃培养液,PBS冲洗2次,加入Hoechst33342(1 mg/L)避光对细胞染色,37℃孵育20 min,PBS冲洗2次,然后用倒置荧光显微镜观察细胞形态变化,并摄片,计算荧光染色阳性细胞百分比。
1.2.6 流式细胞术检测细胞凋亡率 取对数生长期细胞,经消化制成1×105个/ml细胞悬液,接种于6孔板中,待细胞贴壁后,按实验分组加入相应浓度药物作用24 h,用不含EDTA的胰蛋白酶消化收集细胞,PBS冲洗2次,按照 Annexin VFITC/PI试剂盒说明书,室温避光作用15 min,上流式细胞仪进行检测,每次实验重复3次。
1.3 统计学方法 应用SPSS17.0统计软件进行分析,实验结果用表示,采用单因素方差分析进行多组间比较,P<0.05为差异有统计学意义。
2 结果
2.1 MTT法测定药物最适浓度和作用时间 不同药物浓度作用不同时间对细胞生长抑制率影响不同。通过MTT法发现随着3-MA和DDP浓度和作用时间增加,细胞生长抑制率增加,当3-MA作用24 h时 IC10为10 mmol/L;当 DDP作用24 h时IC50为5 mg/L。因此,实验中选择3-MA和DDP最终浓度分别为10 mmol/L和5 mg/L。
2.2 MA和DDP对肺癌A549细胞增殖的影响 单独应用3-MA对细胞增殖无明显影响。单独应用DDP细胞增殖率明显下降〔(49.7±2.4)%〕。3-MA和DDP组细胞增殖率〔(29.3±2.8)%〕与单独应用DDP相比明显下降(P<0.05)。
2.3 MDC染色检测细胞自噬变化 由于MDC处理细胞后多聚集在自噬空泡中,在细胞核周围可见到蓝绿色或黄绿色点状结构出现。单独应用3-MA作用于细胞未见明显自噬空泡出现,流式细胞仪测细胞荧光强度为〔(97.8±7.1)%〕,与对照组荧光强度〔(81.1±9.1)%〕相比无明显差异。单独应用DDP细胞染色质凝聚,细胞中出现自噬空泡,荧光强度为(213.5±21.3)%,与对照组相比差异显著(P<0.05),说明在DDP作用下细胞发生自噬。3-MA与DDP联合作用组与单独应用DDP组相比,自噬空泡减少,荧光强度明显下降为(112.3±13.8)%,组间比较差异显著(P<0.05)。见图1。
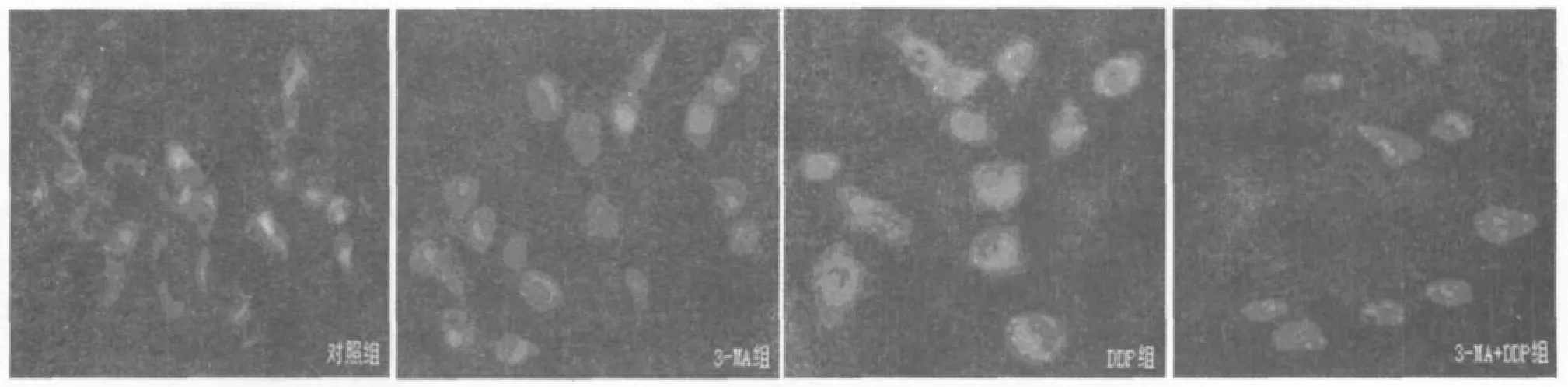
图1 MDC染色检测肺癌A549细胞自噬空泡的变化(×400)
2.4 Hoechst33342染色检测细胞形态变化 单独应用3-MA,细胞形态未见明显变化,Hoechst33342染色阳性细胞百分比为(3.1±0.9)%。单独应用DDP,细胞核裂解,染色质凝聚,表明细胞发生凋亡,阳性细胞百分比为(8.0±0.5)%。3-MA+DDP组细胞凋亡明显增加,阳性细胞百分比为(15.2±1.1)%,与单独应用DDP组相比差异显著(P<0.05)。见图2。
2.5 流式细胞术检测细胞凋亡率 单独应用3-MA组细胞凋亡率为(3.2±0.8)%,与对照组`相比未见明显差异。单独应用DDP组细胞凋亡率增加为(13.5±1.4)%,与对照组相比差异显著(P<0.05)。3-MA+DDP组细胞凋亡率明显增加,为(23.6±2.1)%,与单独应用DDP组相比差异显著(P<0.05),表明3-MA在促进细胞凋亡方面发挥一定作用。
3 讨论
肺癌是当今世界上最常见恶性肿瘤之一〔4〕。研究发现恶性肿瘤的发生发展与自噬调控机制的失调有关。但有关自噬在肿瘤发生、发展过程中所起的具体作用目前尚不完全清楚,研究发现自噬的作用可能与不同肿瘤细胞在不同时间所处的具体环境有关〔5〕。
DDP是一种可用于多种恶性肿瘤(包括肺癌)的广谱化疗药物,可以抑制癌细胞的DNA复制过程,并损伤细胞膜结构,但其肿瘤耐药性一直是临床治疗难以克服的障碍〔6〕。有研究〔7~9〕表明DDP等药物可以引起肿瘤细胞发生自噬,说明自噬可能与肿瘤耐药性存在一定的关系。本研究发现自噬抑制剂3-MA能够显著增强顺铂对肺癌A549细胞的杀伤作用。MDC是分析自噬过程特异性自噬溶酶体标记之一,通过MDC荧光染色可以发现DDP诱导肺癌A549细胞发生自噬,而3-MA和DDP联合作用降低了细胞的自噬水平。流式细胞仪检测细胞凋亡结果发现,3-MA和DDP联合作用与单独应用DDP相比,细胞凋亡率明显增高。综合分析以上结果表明DDP可以诱导肺癌A549细胞发生自噬和凋亡,抑制自噬可以增加细胞凋亡率,说明自噬在DDP诱导的肺癌A549细胞凋亡的过程中可能起到保护作用。此外有研究表明在DDP诱导肺癌A549耐药细胞株中,3-MA可以增加DDP抑制细胞生长和凋亡作用;并且认为上调自噬在DDP诱导A549细胞耐药机制中发挥主要作用〔7〕。而通过吖啶橙染色检测自噬体的形成,在耐药细胞中自噬体形成明显减少,表明自噬能够减少DDP诱导的细胞死亡〔10〕。
本研究发现DDP可以诱导肺癌A549细胞发生自噬。在化疗过程中,通过抑制自噬表达,降低肿瘤细胞对受损细胞器的清除能力,增加肿瘤细胞的凋亡率,增加化疗疗效。
1 Zeng X,Kinsella TJ.Impact of autophagy on chemotherapy and radiotherapy mediated tumor cytotoxicity:to live or not to live〔J〕.Front Oncol,2011;1:30.
2 Rosenfeldt MT,Ryan KM.The role of autophagy in tumour development and cancer therapy〔J〕.Expert Rev Mol Med,2009;11:36.
3 Klionsky DJ,Abeliovich H,Agostinis P,et al.Guidelines for the use and interpretation of assays for monitoring autophagy in higher eukaryotes〔J〕.Autophagy,2008;4(2):151-75.
4 Spiro SG,Tanner NT,Silvestri GA,et al.Lung cancer:progress in diagnosis,staging and therapy〔J〕.Respirology,2010;15(1):44-50.
5 刘东雷,王建军,杨 洋,等.自噬在顺铂诱导的食管癌细胞死亡中的作用〔J〕. 中华实验外科杂志,2010;27(9):1198-9.
6 Köberle B,Tomicic MT,Usanova S,et al.Cisplatin resistance:preclinical findings and clinical implications〔J〕.Biochim Biophys Acta,2010;1806(2):172-82.
7 Ren JH,He WS,Nong L,et al.Acquired cisplatin resistance in human lung adenocarcinoma cells is associated with enhanced autophagy〔J〕.Cancer Biother Radiopharm,2010;25(1):75-80.
8 Harhaji-Trajkovic L,Vilimanovich U,Kravic-Stevovic T,et al.AMPK-mediated autophagy inhibits apoptosis in cisplatin-treated tumour cells〔J〕.J Cell Mol Med,2009;13(9B):3644-54.
9 Claerhout S,Verschooten L,van Kelst S,et al.Concomitant inhibition of AKT and autophagy is required for efficient cisplatin-induced apoptosis of metastatic skin carcinoma〔J〕.Int J Cancer,2010;127(12):2790-803.
10 Sirichanchuen B,Penqsuparp T,Chanvorachote P.Long-term cisplatin exposure impairs autophagy and causes cisplatin resistance in human lung cancer cells〔J〕.Mol Cell Biochem,2012;364(1-2):11-8.

