一株产内切菊粉酶菌株培养条件的响应面优化
苟亚峰,王 丹,孙 丹,张 岩,葛 娟,高剑峰
(石河子大学生命科学学院,新疆石河子832000)
菊芋(Jerusalem artichoke)原产于北美,后经欧洲传入亚洲,在我国广泛种植。菊芋适应性强,特别适合在沙漠、滩涂、盐碱荒地等非农业耕地种植[1],且产量高,价格低廉。菊芋块茎中含糖量高,可达其干重的60%~70%,菊芋中的储存性多糖是以菊粉(inulin)形式存在的,菊粉又名菊糖,由D-果糖残基经β(l-2)糖苷键脱水缩合而成,直链结构,末端连接一个葡萄糖分子。菊粉的分子式表示为GFn[2]。菊粉酶(Inulinase)是能够水解 β-2,1-D-果聚糖果糖苷键的一类水解酶[3]名为 β-2,1-D-果聚糖酶(EC3.2.1)。菊粉酶的来源广泛,自然界中的植物和动物消化道中的许多微生物都可以产生菊粉酶[4-5]。由于微生物生长繁殖快,生活周期短,酶产量高,并且能够水解大量存在于菊芋等植物块茎中的菊粉,用于生产果糖浆、低聚果糖、燃料酒精等[6-8],具有十分重要的生产价值和广阔的利用前景,内切型菊粉酶随机作用于菊糖中间,水解产物主要是低聚果糖[9]。由于低聚糖具有防龋齿[10]、降血脂、抗肿瘤等功能,而且还具备独特的能促进肠道中有益菌群双歧杆菌增殖的生理活性,因此倍受食品科技界的重视[11]。功能性低聚糖的研究和开发被认为是21世纪重要的课题,随着人们生活水平的提高,保健食品的需求量日益增加,这将为功能性低聚糖的研究和开发创造良好的机遇[12],同时又为农副产品等自然资源的综合利用提供了一个很好的发展途径,前景十分广阔[4-5]。本实验从新疆石河子盐碱地菊芋生长的根际土壤中经过初筛、分离纯化和复筛后得到1株具有高产内切菊粉酶活力的菌株(G-60),在单因素实验基础上,采用PB实验设计方法考察8个发酵因素,筛选得出3个关键因素,再利用最陡爬坡实验及 Central Composite Design 响应面设计[13-17]确定主要影响因素的最佳浓度,以提高内切菊粉酶酶活。
1 材料与方法
1.1 材料与仪器
菊粉 西安斯诺特生物技术有限公司;菌株选育培养基:初筛培养基(菊粉40.0g/L,蛋白胨10.0g/L,Na2HPO410.0g/L,NH4Cl 20.0g/L 琼脂 15.0g/L,初始pH7.2)、发酵培养基(菊粉40.0g/L,酵母膏7.0g/L,蛋白胨 10.0g/L,Na2HPO410.0g/L,NH4Cl 20.0g/L)、PDA培养基(马铃薯(去皮,切碎)200.0g/L,葡萄糖20.0g/L,琼脂 20.0g/L,pH 自然[18])、斜面培养基(查氏培养基[19])。以上培养基在配制完成后,均需121℃高压灭菌20min;3,5-二硝基水杨酸等所有试剂及药品均为分析纯。
HANNA pH211型PH计 乌鲁木齐祥生仪器有限公司;721分光光度计 北京市六一仪器厂;SPX-80生化培养箱 上海科恒实业发展有限公司;HY-B1回旋振荡器 江苏省金坛市医疗器械仪器厂。
1.2 产内切菊粉酶菌株的筛选
从新疆石河子盐碱地菊芋生长的根际土壤中分组取土壤置于无菌水中,180r/min摇床振荡分散。取样液 1mL 按 10-1、10-2、10-3、10-4、10-5、10-6稀释后,涂布于初筛选培养基,28℃培养3~5d。挑取单菌落,平板划线方法纯化培养,移入斜面保藏。
将纯化后菌种接种于PDA培养基上培养5~7d,待孢子成熟后刮取适量孢子与无菌水制成孢子悬液。250mL三角瓶中发酵培养基装量50mL,加入上述孢子悬液 1mL,28℃,180r/min 振荡培养 3~5d,然后进行复筛。
1.3 内切菊粉酶活力测定
1.3.1 酶液制备 将复筛得到的菌株按5%(体积分数)接种量接入装量50mL发酵培养基的250mL的三角瓶中,28℃,180r/min摇床培养60h后,12000r/min、4℃离心10min取上清液即为酶液。
1.3.2 内切酶酶活测定方法 采用3,5-二硝基水杨酸法(DNS比色法):取1mL酶液,加入4mL 1.5%的菊粉溶液(pH为5.0,0.1mol/L醋酸缓冲液配制),55℃水浴中保温10min。取反应液0.5mL加入0.5mL DNS混匀,沸水浴反应5min,迅速冷却并稀释至5mL(在完全相同的条件下以灭活的酶液作为对照),在波长540nm处测定其吸光度值,根据葡萄糖标准曲线计算样品中还原糖含量[20-22]。
菊粉酶活力单位定义:在上述条件下,每分钟生成1μmol还原糖所需的酶量为一个酶活单位(U)。
1.4 实验设计
1.4.1 单因素实验设计 分别以菊粉、蛋白胨浓度、初始pH和装液量为单因素进行实验,根据实验结果确定Plackett-Burman实验设计变量范围。
1.4.2 Plackett-Burman实验设计 Plackett-Burman设计法是一种两水平的实验设计方法,适用于从众多考察因素中快速有效地筛选出最重要的几个因素,试图用最少实验次数达到使因素的主效应得到尽可能精确的估计。对于N次实验至多可研究(N-1)个因素,其中(N-4)个实际因素,3个虚拟变量用以误差估计[23]。
选用N=12的Plackett-Burman实验设计,对菊粉浓度、初始pH、蛋白胨浓度、酵母膏浓度、发酵时间、发酵温度、装液量和接种量8个影响内切菊粉酶活力的相关因素进行实验研究。每个因素取两个水平:低水平“-1”和高水平“1”,“1”为“-1”的1.25~1.5倍,一般实验均选取1.5倍,另设三个空白项对应表中的X4、X8和X11,用以考察实验误差。响应值为内切菊粉酶酶活。自变量、编码和水平因素见表1。

表1 Plackett-Burman实验因子水平及编码Table 1 Factors and levels in Plackett-Burman design
1.4.3 最陡爬坡实验 根据PB实验分析结果确定最陡爬坡实验爬坡方向和步长,按一定的梯度增加菊粉和蛋白胨在培养基中的浓度,并按一定的梯度减少装液量,其余5个因素均取初始浓度,检测最终发酵液中内切菊粉酶酶活,从而确定菊粉、蛋白胨浓度和装液量三个因素的最适浓度范围。
1.4.4 Central Composite Design实验设计 Central Composite Design实验设计适用于2~5个因素的优化实验。以PB实验筛选得到的对最终发酵液中内切菊粉酶酶活影响显著的因素作为设计因素,以最陡爬坡实验得出的浓度作为中心点,以内切菊粉酶酶活为响应值,通过响应面分析对产酶条件进行优化。实验因素与水平设计如表2所示。
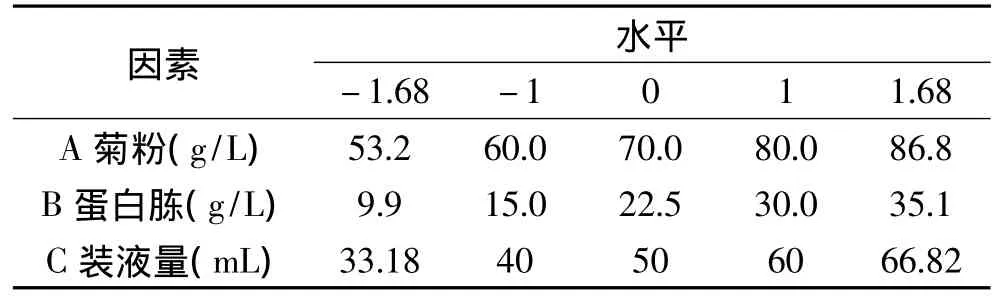
表2 Central Composite Design实验因素水平及编码Table 2 Factors and levels in Central Composite Design
1.5 数据处理
单因素实验数据采用excel2003进行处理;Plackett-Burman实验设计与内切菊粉酶酶活数据分析,采用Design-Expert软件进行方差分析,建立回归方程;采用 Design-Expert软件对 Central Composite Design实验内切菊粉酶酶活数据进行方差分析及多元回归拟合。
2 结果与分析
2.1 单因素实验结果与分析
2.1.1 不同菊粉浓度对内切酶酶活的影响 由图1可知,随着菊粉浓度的增加,内切酶活力先增大后减小,达到55.0g/L时内切酶酶活达到最大。菊粉浓度较小碳源不足影响菌体生长,最终发酵液中内切菊粉酶活力小,随着发酵液中菊粉浓度的增加内切菊粉酶活力逐渐增大,菊粉浓度为55.0g/L时碳源充足,最终发酵液中内切菊粉酶活力达到最大。发酵液中菊粉浓度大于55.0g/L时,碳源过量,发酵液黏度增加溶氧量减小,影响菌体生长,最终发酵液中内切菊粉酶酶活减小。
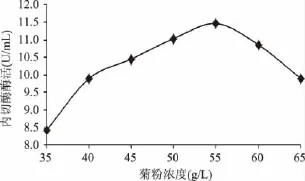
图1 不同菊粉浓度对内切酶酶活的影响Fig.1 Effect of different content of inulin on the endoinulinase activity
2.1.2 不同蛋白胨浓度对内切酶酶活的影响 由图2可知,蛋白胨浓度在13.0g/L时酶活达到最大值。随着蛋白胨浓度的增加内切酶活力先增大后减小,蛋白胨浓度为13.0g/L时内切酶酶活达到最大。蛋白胨浓度较小氮源不足菌体生长缓慢,最终发酵液中内切菊粉酶活力小,随着发酵液中蛋白胨浓度的增加内切菊粉酶活力逐渐增大,蛋白胨浓度为13.0g/L时内切菊粉酶活力达到最大。发酵液中蛋白胨浓度大于13.0g/L时,氮源过量,菌体快速生长发酵液黏度增加溶氧量减小,最终发酵液中内切菊粉酶酶活减小。
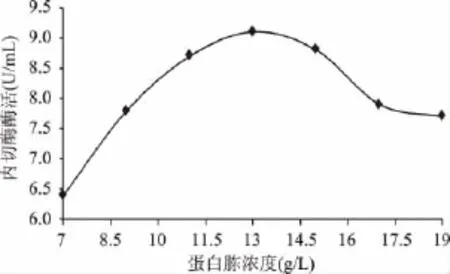
图2 不同蛋白胨浓度对内切酶酶活的影响Fig.2 Effect of different content of peptone on the endoinulinase activity
2.1.3 不同pH对内切酶酶活的影响 由图3可知,初始pH对内切酶酶活影响较显著,pH在5.5~7.5之间酶活无明显变化,小于5或大于7.5时内切酶酶活急剧下降。培养基pH小于5或大于7.5时,菌株不能正常生长菌液浓度极小,最终发酵液中内切菊粉酶酶活降低。
2.1.4 不同装液量对内切酶酶活的影响 由图4可知,装液量与酶活显示负效应关系,随着装液量增大酶活降低,装液量为40~60mL之间酶活无显著变化。装液量减小溶氧充分,有利于菌体生长,随着装液量的增加单位体积发酵液获得溶氧量减小,阻碍菌株生长,发酵液中菊粉内切酶酶活降低。装液量很小时虽然单位体积发酵液菊粉内切酶酶活较高,但总酶液量减少,故选取装液量为40~60mL进行Plackett-Burman实验。

图3 不同pH对内切酶酶活的影响Fig.3 Effect of different pH on the endoinulinase activity
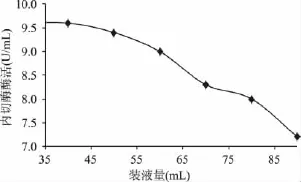
图4 不同装液量对内切酶酶活的影响Fig.4 Effect of different liquid medium volume on the endoinulinase activity
2.1.5 不同接种量对内切酶酶活的影响 由图5可知,接种量为6%时内切酶酶活达到最高,随后接种量增大酶活无显著变化。接种量增大有利于缩短发酵周期,使发酵菌种能够快速进入对数生长期,由图5可知接种量为5%时内切菊粉酶酶活已达到较大值,随着接种量的进一步增大,酶活略有升高,但增大接种量对发酵液浓度和装液量均产生影响,故取接种量为4%~6%进行Plackett-Burman实验。

图5 不同接种量对内切酶酶活的影响Fig.5 Effect of different inoculum concentration on the endoinulinase activity
2.1.6 不同发酵时间对内切酶酶活的影响 由图6可知随着发酵时间的延长酶活逐渐升高,发酵72h后,延长发酵时间酶活无明显变化。发酵72h后,发酵液中营养成分减少,菌体生长进入稳定期,发酵液中菊粉内切酶酶活达到最大值。

表3 Plackett-Burman实验设计结果Table 3 Plackett-Burman design layout and experimental results

图6 不同发酵时间对内切酶酶活的影响Fig.6 Effect of different fermentation time on the endoinulinase activity
以此单因素实验结果为依据选取 Plackett-Burman实验设计变量范围:菊粉浓度高水平“1”为60.0g/L,低水平“-1”为40.0g/L;蛋白胨浓度高水平“1”为15.0g/L,低水平“-1”为 10.0g/L;pH 高水平“1”为7.5,低水平“-1”为5.5;装液量高水平“1”为60mL,低水平“-1”为 40mL;发酵时间高水平“1”为72h,低水平“-1”为48h;酵母膏浓度高低水平分别取 5.0、7.5g/L[18];发酵温度高低水平分别为27、29℃[19];接种量高低水平分别为 4% 、6% 。
2.2 Plackett-Burman实验设计结果与分析
Plackett-Burman实验设计与结果见表3。采用Design-Expert软件对表3中的内切菊粉酶酶活数据进行方差分析,得到了各影响因子的显著性(表 4)。
表4方差分析结果表明,所得回归方程达到显著(p=0.0285<0.05),实验数据的变异性可以用此回归模型来解释。在Plackett-Burman实验设计的水平范围内X6对内切菊粉酶酶活力影响极显著(p=0.0057<0.01),X1和 X9对内切菊粉酶酶活力的影响显著(p<0.05),其他因素在所考察的水平范围内对内切菊粉酶酶活无显著影响。因此,对G-60发酵生产内切菊粉酶最主要的影响因子是菊粉浓度(X1)、蛋白胨浓度(X6)和装液量(X9)。其中,菊粉和蛋白胨的浓度对内切酶酶活产生正效应影响,装液量对内切菊粉酶酶活具有负效应影响。选取此三因素为研究对象,做进一步的优化实验。

表4 Plackett-Burman实验方差分析Table 4 Variance analysis for Plackett-Burman experimental results
2.3 最陡爬坡实验结果与分析
如表5所示,随着菊粉、蛋白胨浓度和装液量的变化,发酵液中的内切菊粉酶酶活先升高后降低,当菊粉浓度、蛋白胨浓度和装液量分别为70.0g/L、22.5g/L和50mL时,所对应的最终发酵液中的内切菊粉酶酶活达到最大值14.48U/mL。选取菊粉浓度为70g/L、装液量50mL和蛋白胨浓度为22.5g/L作为实验中心点,进行Central Composite Design优化实验。
2.4 Central Composite Design实验设计结果与分析
以菊粉、蛋白胨及装液量3个重要因素为自变量,各因素编码水平如表2所示,Central Composite Design实验设计及结果如表6所示。

表5 最陡爬坡实验设计及其结果Table 5 The path of steepest ascent experiment design and response values

表6 Central Composite Design实验设计及其结果Table 6 Central Composite Design design layout and experimental results
采用Design-Expert软件对表6中的内切菊粉酶酶活数据进行方差分析及多元回归拟合,得到了各影响因子的显著性(表7),获得内切菊粉酶酶活力(Y)对自变量菊粉浓度A、蛋白胨浓度B和装液量C的二次多项回归模型方程为:
Y=-365.02951+55.28084A+42.46365B+6.40737C-4.52879A2-10.12536B2-0.054922C2+2.94000AB-0.030250AC-0.35633BC
由表7可知,方程失拟项不显著(p=0.2005>0.05),说明回归方程不失拟。方程模型极显著(p=0.0013<0.01),说明方程能够很好的拟和实验结果。发酵液中菊粉浓度(A)在发酵中对内切菊粉酶酶活影响显著;方程的二次项均极显著;方程的交互项均无显著差异。同时对回归方程进行优化,删除其中t检验不显著项,将二项式方程方程简化为:
Y=-365.02951+55.28084A-4.52879A2-10.12536B2-0.054922C2

表7 Central Composite Design实验方差分析Table 7 Variance analysis for Central Composite Design experimental results
利用Design-Expert软件对回归模型进行响应面分析,得到各响应面立体分析图(图7~图9)。对回归方程进行最值求解,得到模型极值点,即当菊粉、蛋白胨浓度和装液量的值分别为66.5、21.9g/L和49.38mL时,响应值Y达到最大值,即内切菊粉酶酶活达到最高为23.57U/mL。

图7 菊粉和蛋白胨对内切酶酶活交互影响的响应面图Fig.7 Surface of mutual influence for inulin and peptone on the activity of Endoinulinase
根据响应面分析得到摇瓶发酵产内切菊粉酶酶活最高的工艺参数为:菊粉加量66.5g/L、蛋白胨浓度29.1g/L、装液量49.38mL。在此条件下,内切菊粉酶酶活可达到23.57U/mL。为了验证响应面分析的可靠性,结合实际实验条件,选定菊粉65.0g/L、蛋白胨30.0g/L、装液量50mL,其他不显著影响因子不变,进行验证实验,经过3次平行实验,测得最终发酵液中内切菊粉酶酶活力的平均值24.62U/mL,与理论预测值23.57U/mL接近,可见该模型能较好的预测实际内切菊粉酶酶活发酵情况。
3 结论
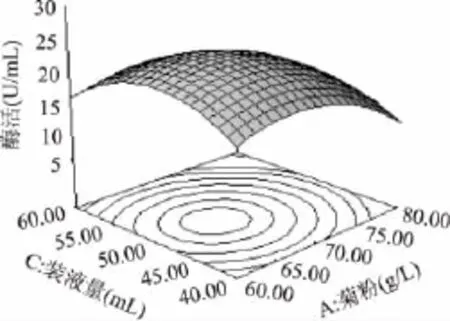
图8 菊粉和装液量对内切酶酶活交互影响的响应面图Fig.8 Surface of mutual influence for inulin and liquid medium volume on the activity of endoinulinase

图9 蛋白胨和装液量对内切酶酶活交互影响的响应面图Fig.9 Surface of mutual influence for peptone and liquid medium volume on the activity of Endoinulinase
在单因素实验基础上,利用Plackett-Burman实验设计,考察影响菌株G-60发酵生产内切菊粉酶酶活的8个相关因素,包括:菊粉浓度、酵母膏浓度、蛋白胨浓度、发酵时间、发酵温度、初始pH、装液量和接种量,实验结果表明菊粉、蛋白胨浓度和装液量对内切菊粉酶酶活力影响显著(p<0.05),其他因素在所考察的水平范围内对内切菊粉酶酶活无显著影响。
在Plackett-Burman实验的基础上,通过最陡爬坡实验,确定Central Composite Design实验设计中心,对菊粉、蛋白胨和装液量3个显著因素进行响应面优化,建立了内切菊粉酶酶活的二次多项式数学模型,分析了模型的有效性与因子间的交互作用,得到了菌株G-60发酵生产内切菊粉酶的优化工艺参数为:菊粉浓度66.5g/L、蛋白胨浓度29.1g/L、装液量49.38mL。在此条件下,菌种产内切菊粉酶活力达24.62U/mL,优化前内切菊粉酶活力15.88U/mL相比提高了1.55倍。结合实际实验条件,选定菊粉65.0g/L、蛋白胨30.0g/L、装液量50mL时酶活达到最大值。
[1]Yuan Wenjie,Zhao Xinqing,BAI Fengwu,et al.Ethanol fermentation with Kluyveromycesmarxianusfrom Jerusalem artichoke grown in salina and irrigated with a mixture of seawater and freshwater[J].J Appl Microbiol,2008(105):2076-2083.
[2]Grinenko G.Physicochemical properties of inulin and of its modified derivatives[D].Kiev:Ukrainian State University of Food Technologies,1993.
[3]王静.Aspergillus ficuum菊粉酶及其酶解菊芋制备低聚果糖的研究[D].无锡:江南大学,2003.
[4]管晓冉,张德纯.功能性低聚糖生产工艺的研究现状[C].重庆市预防医学会2010年论文集,2010:380-384.
[5]袁文杰,任剑刚,赵心清,等.一步法发酵菊芋生产乙醇[J].生物工程学报,2008(11):1931-1936.
[6]胡建锋,邱树毅.菊芋发酵生产酒精的研究进展[J].酿酒科技,2009(8):100-104.
[7]Bekers M,Upite D,Kaminska E,et al.Fermentation of Jerusalem artichoke by Zymomonas and Saccharomyces[J].Nutrition & Food Science,2008,38(2):128-135.
[8]林晨,顾宪红.菊粉酶的研究进展及应用[J].当代畜禽养殖业,2004(1):37-39.
[9]Coitinho J B,Guimarase V M,De Almeida M N,et al.Characterization of an exoinulinase produced by Aspergillus terreus CCT 4083 grown on sugar cane bagasse[J].J Agr Food Chem,2010,(58):8386-8391.
[10]李妍,昌盛,王丽娜,等.菊粉低聚糖的开发现状[J].吉林医药学院学报,2011,32(6),359-361.
[11]彭英云,郑清,张涛.菊粉的功能与利用[J].食品研究与开发,2012,33(10),236-240.
[12]李林宗,李绍江,刘庆,等.高纯度低聚果糖及其在第三代保健食品中的应用[J].中国医药技术与市场,2006,6(3):21-25.
[13]张超,张克峰,侯国山,等.利用响应面法优化ε-聚赖氨酸发酵培养基[J].微生物学通报,2011,38(5):641-646.
[14]苏凤贤,苟亚峰,王玉芳,等.人参果酶法提汁工艺优化[J].食品与发酵工业,2010,36(8):198-203.
[15]朱强,夏艳秋,陈爱芹,等.响应面法优化灵芪菌质多糖固态发酵条件[J].中国生物工程杂志,2011,31(12):99-103.
[16]罗登林,袁海丽,曾小宇,等.响应面法优化Aspergillus niger X-6 发酵生产菊粉酶工艺的研究[J].食品科学,2010,31(23):138-141.
[17]苏凤贤,王晓琴,苟亚峰,等.响应面分析果胶酶提高人参果出汁率的工艺参数[J].食品科学,2010,31(20):83-88.
[18]张泽生,王翠,张荣萍,等.产菊粉酶微生物的筛选及发酵工艺的研究[J].现代食品科技,2010,26(5):498-502.
[19]叶淑红,张福琪,张芩花,等.菊粉酶酶源菌株的筛选及其发酵条件[J].大连轻工业学院学报,2001,20(1):33-36.
[20]Spiro R G.Analysis of sugars found in glycoproteins[J].Methods in Enzymology,1966,8:3-26.
[21]Singh R S,Balwinder S S,Munish P.Optimization of medium and process parameters for the production of inulinase from a newly isolated Kiuyveromyces marxianus YS-1[J].Bioresource Technology,2007,98:2518-2525.
[22]Xu C P,Kim S W,Hwang H J,et al.Application of statistically based experimental designs for the optimization of exopolysaccharide production by Cordyceps militaris NG3[J].Biotechnol Appl Biochem,2002,36(2):127-131.
[23]Montgomery DC.Design and analysis of experiments[M].New York:John Wiley & Sons,1991:45-50.

