结核病患者N-乙酰基转移酶2基因型与异烟肼血药浓度关系的研究
刘诚诚 金海霞 徐建 李华 朱慧 付雷 王彬 陆宇
结核病是由Mtb感染引起的,是全球流行最广的疾病之一。Mtb可通过空气传播,如果不及时治疗,平均每例结核病患者每年即可传染10~15人。结核病是导致死亡人数最多的感染性疾病之一[1]。目前全球约有20亿人感染了Mtb,每年新出现肺结核患者约800~1000万例,每年因肺结核死亡人数约200~300万例,其中95%的结核病患者及98%的结核病死亡患者发生在发展中国家[2]。INH作为抗结核一线药物,具有价廉低毒的特点,应用非常广泛。但INH导致的肝毒性、外周神经炎和全身性红斑狼疮等不良反应与并发症却不容忽视。有证据表明INH的血药浓度与药效、不良反应存在相关性[3]。INH在体内的代谢存在多条通路,其主要是在N-乙酰基转移酶2(N-acetyltransferase 2,NAT2)的作用下乙酰化为乙酰异烟肼(AcINH),后者再进一步由酰胺酶等代谢转化。NAT2属于Ⅱ相解毒酶,目前已经发现26种NAT2等位基因[4],其中存在7个单核苷酸多态性位点的突变,分别是191(G→A)、282(C→T)、341(T→C)、481(C→T)、590(G→A)、857(G→A)、803(G→A)[5]。282位点通常与590或857联合突变,形成等位基因*6A和*7B,341、481、803联合突变形成等位基因*5B[5-7]。在亚洲和高加索人群中,最常见的导致慢性乙酰化表型的突变型等位基因均为NAT25B,6A,7B,这3种突变型等位基因可分别通过检测481,590和857位的基因突变来确定。Delomenie等[8]也指出*5B,*6A,*7B与慢乙酰化相关,野生型等位基因*4与快乙酰化相关。根据以上4种等位基因可将人群代谢类型分为快速乙酰化型(rapid acetylator,RA),即野生纯合型(*4/*4);中间乙酰化型(intermediate acetylator,IA),即杂合子型(*4/*5B,*4/*6A,*4/*7B)和慢乙酰化型(slow acetylator,SA),亦称纯合突变型(含*5B,*6A,*7B任意2个或3个等位基因)。INH直接由酰胺酶催化水解为酰肼(hydrazine,HZ),是INH代谢的另一条通路,HZ是构成INH肝毒性的主要物质。有研究指出,随着NAT2基因突变位点的增加,血浆INH浓度也随着基因型的顺序改变而增加,INH的乙酰化作用减弱,水解作用反而加强,导致HZ聚集,最终引起肝功能受损[9]。
本研究探讨NAT2基因的3种乙酰化基因型与INH血药浓度之间的关系,为进一步证实INH血药浓度与药效、不良反应之间存在的相关性,以及为临床药物合理应用提供依据。
对象和方法
一、研究对象的纳入
选择北京市结核病胸部肿瘤研究所(简称“结研所”)2010年7月至2012年6月经过胸部X线检查、Mtb快速培养、抗结核抗体检测,以及痰涂片阳性等确诊的住院结核病患者121例,所有患者的诊断均依据参考文献[10]确诊;其中男60例,女61例,平均年龄(42.9±19.0)岁。住院患者INH用量均为300mg/d,连续服药7d以上。
二、材料和仪器
1.药品和试剂:INH(浙江南洋药业有限公司提供);乙腈,二甲双胍,0.1%甲酸+0.1%甲酸铵,去离子水(ddH2O);Promega Wizard基因组DNA提取试剂盒(美国Promega公司),异丙醇,70%乙醇;5%TBE缓冲液,琼脂糖;KpnⅠ、TaqⅠ、BamHⅠ酶切试剂[宝生物(大连)有限公司]。
2.仪器和设备:Thermo离心机(Sorvall Legend Micro 21R),电热恒温水浴锅(上海博讯实业有限公司),BIOER(杭州博日科技有限公司)金属浴,XW-80A漩涡混合仪(上海医科大学仪器厂),德国Eppendorf梯度PCR仪,ISO 9001电子天平[赛多利斯科学仪器(北京)有限公司],DYY-6C型电泳仪(北京六一仪器厂),Tanon-4200全自动数码凝胶成像系统(上海天能科技有限公司),液相色谱-串联质谱仪(LC/MS-MS)(美国安捷伦科技公司),Anke-TDL-5000B低速冷冻离心机 (上海安亭科学仪器厂)。
三、实验方案
实验所纳入的结核病住院患者INH用量均为300mg/d,服药2h后取肘静脉血3ml,置于肝素抗凝管中,4℃保存30min,离心前轻轻混匀试管,吸取300μl用来提取DNA,剩余血液3000r/min,离心15min,离心半径18cm,将上清液全部转移至2ml EP管中,同时定量吸取100μl分装于600μl EP管中,-80℃保存,用于INH血浆浓度测定。
1.基因型分析:应用PCR结合限制性片段长度多态性(PCR-RFLP)方法检测121例结核病患者的NAT2基因型分布。引物设计参考文献[9]:NAT2N5(5′-tcagcctcaggtgccttgca-3′),NAT2N4(5′-agcatgaatcactctgcttc-3′)。目的片段长度为710bp,包含*5B(G481T)、*6A(G590A)、*7B(G857A)3个突变位点。基因型酶切片段分析见表1。

表1 NAT2突变型等位基因分析
2.药物浓度测定:采用内标法检测2h后INH血药浓度,将分装好的100μl血清于常温下解冻,加入二倍体积乙腈(含二甲双胍做内标化合物)沉淀血清中游离蛋白和红细胞,13 400×g,离心10min,取上清约200μl置于液相色谱-串联质谱仪(LC/MS-MS)进样器中,以内标法峰面积定量。液相色谱条件:ZORBAX SB-C18(2.1×100mm,1.8μm);流动相:0.1%甲酸+0.1%甲酸铵:乙腈(92∶8);流率:0.3ml/min;柱温:30℃。进样量:2μl。质谱条件:采用多反应监测(MRM)方式检测,气体温度350℃,气流10L/min。浓度在0.1~6μg/ml时INH标准曲线呈良好线性关系。
四、统计学分析
应用SPSS 16.0统计软件,在服从正态分布、方差齐性检验基础上,采用单因素方差分析检测组间差异,以P<0.05为差异有统计学意义。若存在差异,进而采用Tamhane’s T2两两比较法检测每两组间的差异,以P<0.05为差异有统计学意义。
结 果
一、基因型分析结果
表2显示了121例住院患者NAT2基因型分析结果,RA与IA所占比例明显高于SA。
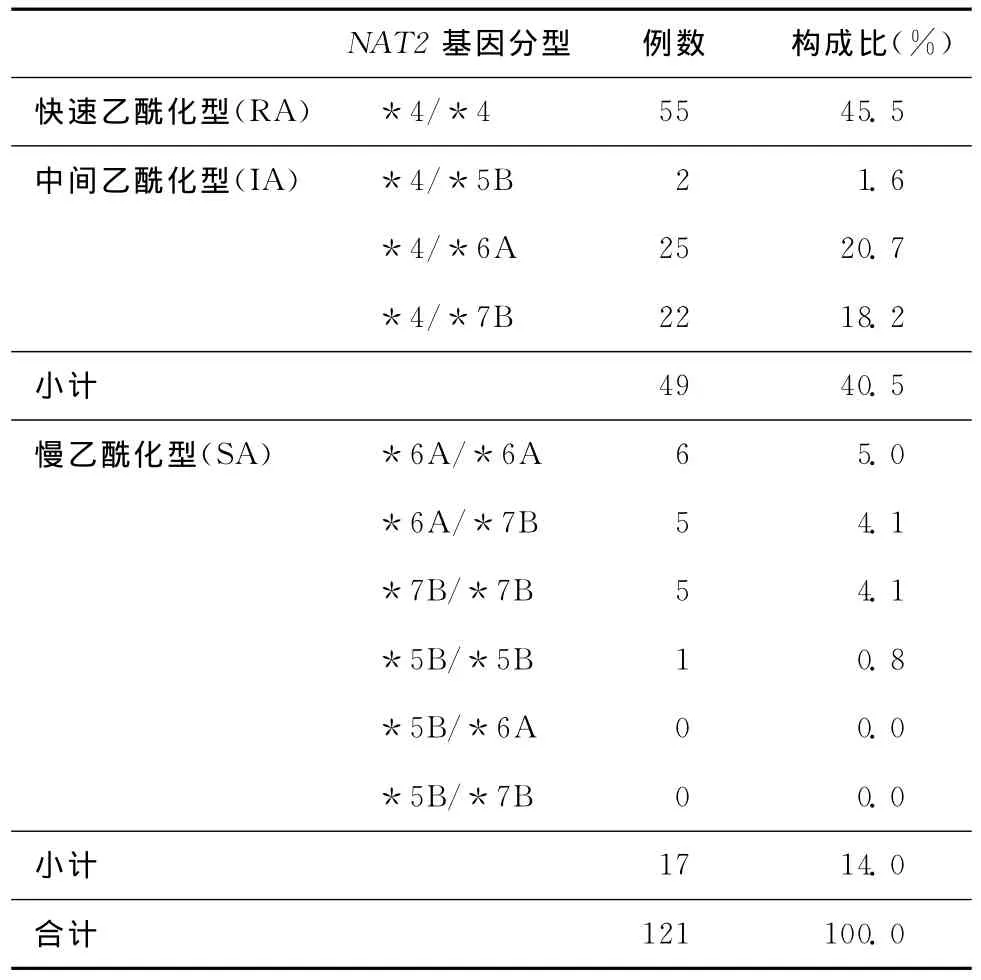
表2 121例结核病患者NAT2基因型分析结果
二、血药浓度结果
表3为121例结核病住院患者服药2h后INH血药浓度结果均值。由此可见SA的INH血药浓度值明显高于RA和IA,IA血药浓度值稍高于RA。单因素方差分析结果显示住院患者3种基因型RA、IA、SA组间血浆INH浓度值比较,差异有显著统计学意义(F=26.978,v=2,P=0.000);进而进行三组血浆INH浓度值的两两比较,RA与IA比较,P=0.001;RA 与SA 比较,P=0.002;IA 与SA比较,P=0.000,差异均有显著统计学意义(表3)。

表3 121例结核病住院患者用药2h后NAT2各种基因分型的血浆INH浓度均值
讨 论
根据Lin等[11]发现通过检测*5B、*6A、*7B这3个突变位点就基本上可以检测出所有亚洲人和白种人群中的SA。这些突变位点引起酶的活性下降和酶的不稳定性增加,从而使个体乙酰化能力受损[12]。NAT2基因多态性使得异烟肼的N-乙酰化作用能力表现出个体化的差异,按乙酰化能力的不同,将NAT2分为RA和SA,其多态性正是由NAT2基因多态性所决定。随着SA机制的研究深入,人们发现*5B、*6A、*7B突变型等位基因是造成NAT2基因多态性的主要原因,可以解释98%以上的SA。有研究证实,中国人*5B、*6A、*7B等位基因的基因频率分别是3.3%、24.6%和10.0%(合计 37.9%),突变纯合子的发生率是15.8%[13]。而*5B、*6A、*7B又是组成IA的主要等位基因,本实验121例结核病患者中IA(*4/*5B,*4/*6A,*4/*7B)构成比占40.5%,接近于37.9%;SA(含*5B,*6A,*7B任意2个或3个等位基因,即突变纯合子)构成比占14.0%,接近于15.8%,进一步验证了*5B、*6A、*7B突变等位基因与NAT2基因多态性的一致性关系。
NAT2基因型多态性是造成INH药代动力学个体差异的重要原因。本研究结果显示121例结核病患者中 45.5% 为 RA,40.5% 为IA,14.0% 为SA。通过分析NAT2各个基因型INH血药浓度,笔者发现RA相对于IA和SA,INH浓度最低,其次是IA,SA的浓度最高,这说明随着NAT2基因突变位点的增加,血浆INH浓度也随着基因型的顺序改变而增加,与此同时INH乙酰化代谢通路逐渐减弱,水解作用通路加强,INH在酰胺酶作用下水解为肝毒性直接相关物质HZ,易导致患者出现肝损害等不良反应,说明NAT2基因型与INH血药浓度在一定意义上具有相关性。因此,可以根据NAT2基因型分析结果用于指导INH的合理用药,为临床个体化治疗提高疗效提供实验依据,尽可能减少INH不良反应的发生。当使用相同剂量INH时,因个体吸收差异、年龄、体质量、性别、病理生理状态的差异,以及其他合并症用药情况等因素,再加上最重要的NAT2基因型多态性表现,导致INH血药浓度产生明显个体差异。对于SA患者采取隔日午后顿服给药方式减少药物的蓄积毒性;同时对于RA肝脏基础较好的患者,结核症状较重的患者可采取每日早晨或睡前顿服给药方式以增加药物疗效。因此,可以根据NAT2基因型检测结果而制订异烟肼的个体化抗结核治疗方案,将大大提高异烟肼的治疗效果,降低不良反应的发生率及发生程度。
[1]World Health Organization.Tuberculosis facts 2009update[EB/OL].(2009-12-09)[2010-03-18].http://www.who.in/tb/publications/2009/factsheet_tb_2009update_dec09.pdf.
[2]任晓波,吴平,李莉,等.结核病的发病趋势及健康教育.家庭护士,2007,5(10):78-79.
[3]Ray J,Gardiner I,Marriott D.Managing antituberculosis drug therapy by therapeutic drug monitoring of rifampicin and isoniazid.Intern Med J,2003,33(5/6):229-234.
[4]Hein DW,Doll MA,Fretland AJ,et al.Molecular genetics and epidemiology of theNAT1andNAT2acetylation polymorphisms.Cancer Epidemiol Biomarkers Prev,2000,9(1):29-42.
[5]Zang Y,Doll MA,Zhao S,et a1.Functional characterization of single-nucleotide polymorphisms and haplotypes of human N-acetyltransferase 2.Carcinogenesis,2007,28(8):1665-1671.
[6]Cascorbi I,Drakoulis N,Brockmöller J,et al.Arylamine N-acetyltransferase(NAT2)mutations and their allelic linkage in unrelated Caucasian individuals:correlation with phenotypic activity.Am J Hum Genet,1995,57(3):58l-592.
[7]Blum M,Demierre A,Grant DM,et al.Molecular mechanism of slow acetylation of drugs and carcinogens in humans.Proc Natl Acad Sci U S A,1991,88(12):5237-5241.
[8]Deloménie C,Sica L,Grant DM,et al.Genotyping of the polymorphic N-acetyltransferase(NAT2*)gene locus in two native African populations.Pharmacogenetics,1996,6(2):177-185.
[9]Fukino K,Sasaki Y,Hirai S,et al.Effect of N-acetyltransferase 2 (NAT2),CYP2E1and Glutathione-S-transferase(GST)genotype on the serum concentrations of isoniazid and metabolites in tuberculosis patients.J Toxicol Sci,2008,33(2):187-195.
[10]中华医学会结核病学分会.肺结核诊断和治疗指南.中华结核和呼吸杂志,2001,24(2):70-74.
[11]Lin HJ,Han CY,Lin BK,et al.Slow acetylator mutations in the human polymorphic N-acetyltransferase gene in 786Asians,blacks, Hispanics,and whites:application to metabolic epidemiology.Am J Hum Genet,1993,52(4):827-834.
[12]Takakubo F,Yamamoto M,Ogawa N,et al.Genetic association between cytochromeP450IA1gene and susceptibility to Parkinson’s disease.J Neural Transm,1996,103 (7):843-849.
[13]陈冰,李金恒,黄晶,等.一步等位基因特异扩增法检测中国人N-乙酰化酶基因型.中国临床药理学杂志,2004,20(1):49-52.

