长白和蓝塘猪印记基因IGF2 和H19 的时空表达研究
吴嫦丽 ,许继国 ,吴同山 ,卫恒习 ,李 莉 ,李紫聪,吴珍芳,张守全
(1 华南农业大学 动物科学学院,广东省农业动物基因组学与分子育种重点实验室,广东 广州 510642;2 广东医学院 基础医学院,广东 湛江 524023;3 东莞市畜牧科学研究所,广东 东莞 523086)
胰岛素样生长因子2(Insulin-like growth factor 2,IGF2)作为胰岛素样生长因子家族成员之一,在胎儿生长发育、肿瘤细胞增殖、肌肉生长和基因组印迹等方面具有重要的调控作用,是影响猪胴体瘦肉率和背膘厚度的重要候选基因之一.猪IGF2 基因具有部分印记效应[1].研究发现,向背膘厚的遗传选择会提高血浆IGF2 浓度.公猪在15~23 周龄之间,IGF2 浓度与背膘厚度呈负相关[2],预示IGF2 可能是调节脂肪沉积的主要因子之一.1986年Florini 等[3]提出IGF2 是以浓度依赖的方式刺激肌纤维的增殖和分化.
H19 基因位于IGF2 基因的下游,共有5 个外显子,外显子碱基序列长度约2.3 kb[4].H19 基因为只转录RNA,不翻译成蛋白质的母方表达、父方缄默的印记基因.H19 是以RNA 的形式发挥生理功能的[4],一般认为H19 参与了IGF2 的表达调节[5-6].
本研究以瘦肉型品种长白猪和脂肪型品种蓝塘猪为试验动物,运用实时荧光定量PCR 技术,测定1日龄和180日龄2 个阶段猪的印记基因(IGF2、H19)转录表达水平,观察其对主要内脏器官如肝脏、胃和肌肉等发育的影响,以及与背膘厚度等主要生长性状的关系,试图了解这2 个基因对猪主要组织器官发育调控及其作用机理,为猪繁殖和生长性状的研究提供有益的探索.
1 材料与方法
1.1 材料
采取1日龄的长白、蓝塘猪(各6 头,每个品种3头公猪3 头母猪)各组织和180日龄的长白、蓝塘猪(各6 头,每个品种3 头公猪3 头母猪,公猪在15日龄时阉割)各组织.
1.2 方法
1.2.1 猪的饲养与选择 本试验选用广东省东莞市板岭原种猪场同期怀孕的6 头蓝塘母猪和6 头长白母猪所产仔猪.饲养试验期从1~180日龄.试验猪按照猪场常规饲养方法饲养管理.测定猪健康、生长发育正常、无外形缺陷和遗传疾患.公猪均在15日龄阉割,母猪不阉割,28 d 断奶.
1.2.2 屠宰测定、样品采集和分组 1日龄、180日龄试验猪每品种各6 头(公母各3 头),宰前绝食12 h,仅供饮水.称体质量后,屠宰,取肝脏、肌肉、胃和脂肪组织样,迅速保存到液氮中.
胴体质量、皮脂肪厚度和背膘厚度等指标的测定参照《GB/T8467—1987 瘦肉型种猪性能测定技术规程》.
试验猪按平均初生体质量、肝质量、胴体质量分别分为质量大、小组,按平均胸围宽度分为宽、窄组,按皮脂肪厚度、背膘厚度分别分为厚、薄组.出生长白猪体质量(1.98±0.13)kg 设为初生体质量大组,体质量(1.40±0.06)kg 设为初生体质量小组,肝质量(57.75±0.32)kg 设为肝质量大组,肝质量(42.33±0.90)kg 设为肝质量小组,胸围宽(29.67±0.33)cm 设为胸围宽组,胸围(25.33±0.88)cm 设为胸围窄组,胴体质量(1 083.33±49.10)g 设为胴体质量大组,胴体质量(833.00±46.67)g 设为胴体质量小组.出生蓝塘猪体质量(0.81±0.02)kg 设为初生体质量大组,体质量(0.70±0.07)kg 设为初生体质量小组.180日龄长白猪皮脂肪(2.80±0.13)cm设为皮脂肪厚组,皮脂肪(2.40±0.08)cm 设为皮脂肪薄组,背膘(19.69±1.18)mm 设为背膘厚组,背膘(16.52±0.33)mm 设为背膘薄组.180日龄蓝塘猪皮脂肪(4.69±0.26)cm 设为皮脂肪厚组,皮脂肪(4.16±0.07)cm 设为皮脂肪薄组,背膘(26.48±0.04)mm 设为背膘厚组,背膘(24.76±0.51)mm设为背膘薄组,胴体质量(37.27±1.79)kg 设为胴体质量大组,胴体质量(32.13±1.01)kg 设为胴体质量小组,胸围(88.00±1.53)cm 设为胸围宽组,胸围(82.67±0.67)cm 设为胸围窄组.
1.2.3 RNA 抽提和反转录 总RNA 的提取采用天根公司试剂盒,依据说明书进行.该试剂盒在抽提过程中已经对其中的DNA 进行处理.以便进行后续试验.
1.2.4 引物的设计与合成 根据猪IGF2、H19 基因的DNA 序列以及β-actin 基因的cDNA 序列(AY 550069),用Primer Premier 5.0 软件设计定量PCR引物.所有目的基因的引物均是跨外显子设计,IGF2跨7、8 外显子,H19 跨2、3 外显子.引物序列信息如表1 所示.引物由生工生物工程(上海)有限公司合成.
1.2.5 实时荧光定量PCR 实时荧光定量PCR 扩增总体系为25 μL,组成为SYBR ®Green I Realtime PCR Master Mix 12 μL,Forword Primer(10 μmol/L)0.4 μL,Reverse Primer(10 μmol/L)0.4 μL,cDNA 模板1 μL,ddH2O 11.2 μL.反应程序为:95℃预变性60 s;95℃变性15 s,60℃退火15 s,72℃延伸15 s,83℃读板45 s,循环40 次.
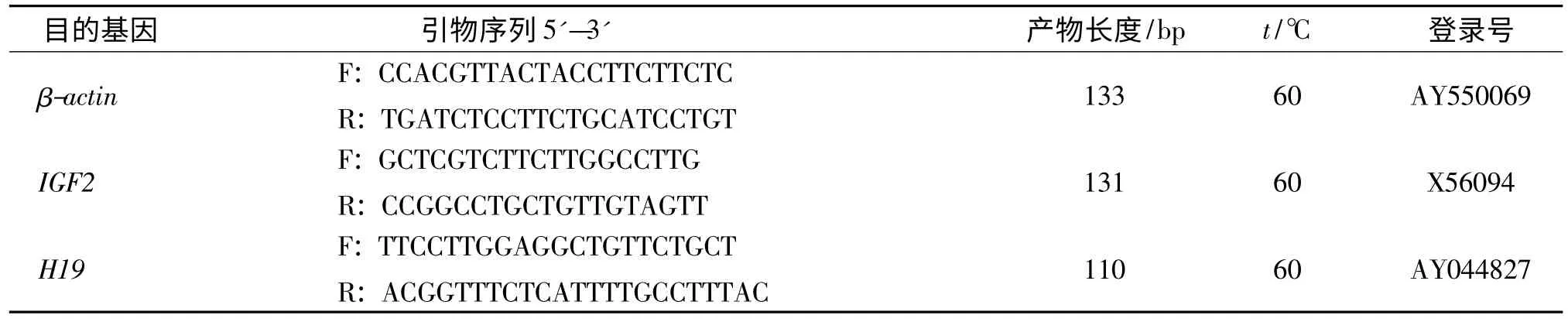
表1 荧光定量RT-PCR 引物序列信息Tab.1 The primers of real-time fluorescence quantitative PCR
1.2.6 数据统计分析 同品种不同日龄间样本数据和同日龄不同品种间样本数据的差异,运用独立样本t 检验分析.试验数据以平均值±标准误表示,用Excel 统计.
采用△△Ct 法来度量IGF2 和H19 基因的表达水平.具体方法是每个样品的Ct 均值减去对应样品的β-actin 基因Ct 均值,然后以同一品种某一组织作为参照,同理得到参照样品△Ct 值,用其他样品组织的△Ct 值减去参照样品组织的△Ct 值得到各组织的△△Ct 值,即△△Ct=其他样品△Ct-参照样品△Ct,最后将每个组织相对参照组织的表达量表示为2-△△Ct.
2 结果与分析
2.1 同一猪种不同性状的基因表达差异分析
用△△Ct 法来度量IGF2 基因在长白仔猪肌肉、肝脏、胃组织中表达差异,见表2.以初生体质量、肝质量、胸围宽以及胴体质量分组,长白仔猪肝脏IGF2基因mRNA 表达量,由表2 可见组间差异显著(P<0.05),质量大的组显著高于质量小的组,宽组显著高于窄组.肌肉和胃组织的IGF2 基因mRNA 表达量,组间差异均不显著(P>0.05).

表2 初生长白仔猪IGF2 基因表达差异分析(2 -△△Ct)1)Tab.2 The mRNA levels of IGF2 of new born Landrace pigs
用△△Ct 法来度量IGF2 基因在蓝塘仔猪肌肉、肝脏、胃组织中表达差异,结果表明初生蓝塘仔猪肝脏mRNA 表达量以初生体质量分组,组间差异显著(P<0.05),体质量大的组显著高于体质量小的组,详见表3.其他分组的各组织间的表达量差异均不显著(P>0.05).
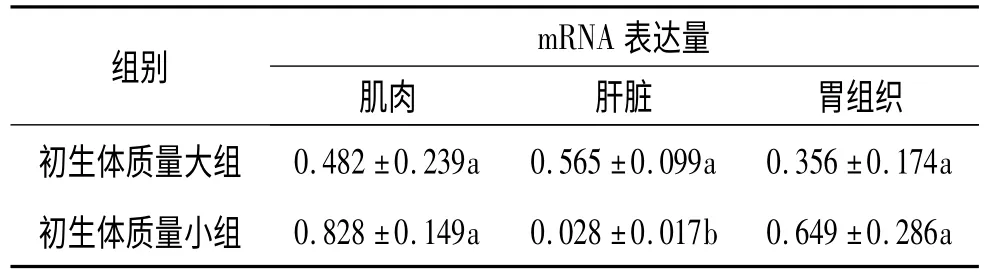
表3 初生蓝塘仔猪IGF2 基因表达差异分析(2 -△△Ct)1)Tab.3 The mRNA levels of IGF2 of new born Lantang pigs
180日龄长白猪,以皮脂厚度、背膘厚度分组,分析组间IGF2 基因在肌肉、肝脏及脂肪的表达差异,结果显示肌肉中IGF2 基因的表达量,皮脂薄组高于皮脂厚组,背膘薄组高于背膘厚组;肝脏的表达量,皮脂厚组高于皮脂薄组;脂肪的表达量,皮脂厚组高于皮脂薄组,背膘薄组高于背膘厚组;差异均不显著(P>0.05).详见表4.

表4 180日龄长白猪IGF2 基因表达差异分析(2 -△△Ct)1)Tab.4 The mRNA levels of IGF2 of 180 days Landrace pigs
180日龄蓝塘猪,以皮脂厚度、背膘厚度、胴体质量和胸围宽度分组,分析组间IGF2 基因在肌肉、肝脏和脂肪的表达差异,结果显示肌肉中IGF2 基因的表达量,胸围宽组显著高于胸围窄组(P<0.05);肝脏中的表达量,皮脂肪厚组显著高于皮脂肪薄组(P<0.05);脂肪中的表达量,背膘厚组和胴体质量大组显著高于背膘薄组和胴体质量小组(P<0.05).见表5.
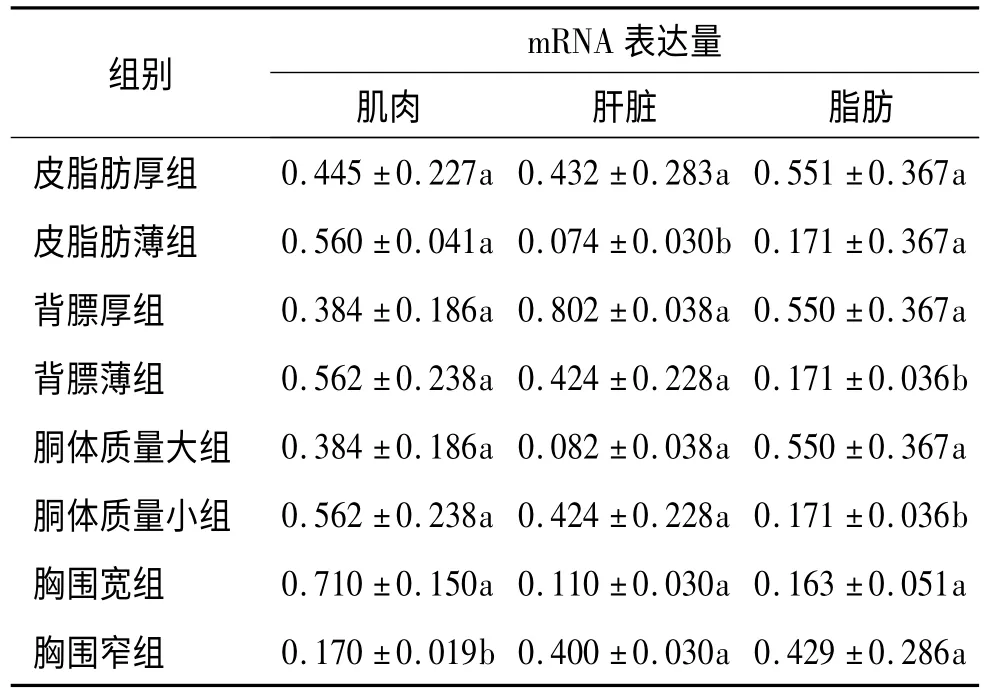
表5 180日龄蓝塘猪IGF2 基因表达差异分析(2 -△△Ct)1)Tab.5 The mRNA levels of IGF2 of 180 days Lantang pigs
2.2 各基因在相同时期不同猪种的表达量差异分析
2.2.1 IGF2 基因 由表6 可见,1日龄的长白、蓝塘猪以猪品种分组,IGF2 基因在肝脏、胃组织和肌肉组织的表达量组间差异不显著(P>0.05).
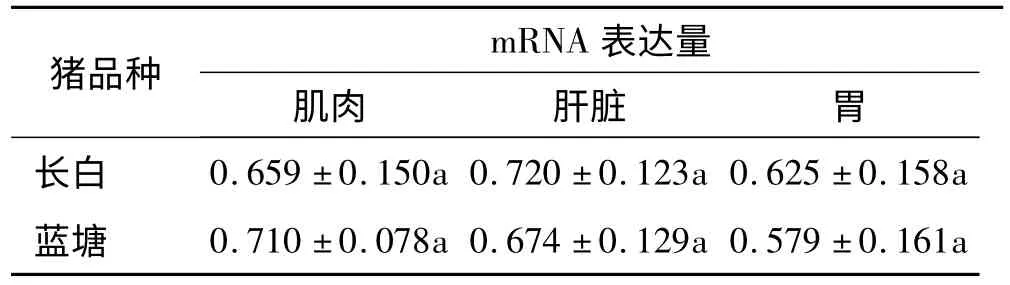
表6 1日龄长白、蓝塘猪的IGF2 基因表达量差异分析(2 -△△Ct)1)Tab.6 The mRNA levels of IGF2 of new born Landrace and Lantang pigs
由表7 可见,180日龄长白、蓝塘猪以猪品种分组,IGF2 基因在胃组织的表达量,长白猪显著高于蓝塘猪(P<0.05).肌肉、肝脏和脂肪组织IGF2 基因表达量组间差异不显著(P>0.05).

表7 180日龄长白、蓝塘猪的IGF2 基因表达量差异分析(2 -△△Ct)1)Tab.7 The mRNA levels of IGF2 of 180 days Landrace and Lantang pigs
2.2.2 H19 基因 由表8 可见,1日龄长白、蓝塘猪以猪品种分组,基因H19 在各组织的表达量差异不显著(P>0.05).

表8 1日龄长白、蓝塘猪的H19 基因表达量差异分析(2 -△△Ct)1)Tab.8 The mRNA levels of H19 of new born Landrace and Lantang pigs
由表9 可见,180日龄长白、蓝塘猪以猪品种分组,H19 基因在各组织的表达量差异不显著(P>0.05).

表9 180日龄长白、蓝塘猪的H19 基因表达量差异分析(2 -△△Ct)1)Tab.9 The mRNA levels of H19 of 180 days Landrace and Lantang pigs
2.3 各基因的组织表达量
用SYBR Green I 实时荧光定量PCR 技术分析不同日龄长白、蓝塘猪各组织中IGF2、H19 基因的表达量,结果见图1、图2.
图1 显示,IGF2 基因在1日龄的长白和蓝塘猪各组织中均有不同程度的表达,其中肝脏、肌肉和胃组织表达量高于其他测定组织;除了长白猪的肾脏组织外,在180日龄的长白和蓝塘猪各组织的IGF2 基因的表达量都比1日龄相应品种猪组织有降低,且肝脏、肌肉和胃组织中的表达量较1日龄时明显降低.
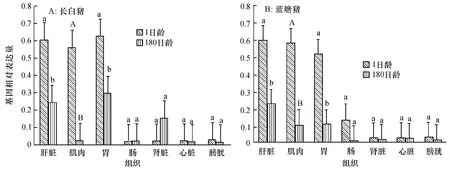
图1 长白、蓝塘猪IGF2 基因的各组织表达量Fig.1 The mRNA expression of IGF2 of Landrace and Lantang pigs
图2 显示H19 基因mRNA 在1日龄的长白猪各组织中均有不同程度的表达;180日龄的长白猪的肠和肾脏组织H19 基因mRNA 表达量较1日龄的降低,其余测定组织的表达均高于1日龄的.蓝塘猪的H19 基因mRNA 表达量除肠组织的为1日龄高于180日龄外,其余测定组织的均为180日龄的表达量高于1日龄的表达量;其中肾脏组织的显著升高.

图2 长白、蓝塘猪H19 基因的各组织表达量Fig.2 The mRNA expression of H19 of Landrace and Lantang pigs
3 讨论
实时荧光定量PCR 技术是在PCR 技术基础上发展起来的一种高度灵敏的核酸定量技术.与传统PCR 相比,实时定量PCR 能够更加快速、灵敏,并有效地对核酸进行定量检测.为排除残留DNA 对定量结果的影响,除了在RNA 抽提的过程中用DNA 酶I对样品进行了处理,本试验所有引物均是跨外显子设计.本试验采用β-actin 作为内参照基因,以此来消除RNA 提取效率、逆转录及扩增效率的差异,从而得到了准确可靠的结果.
IGF2 基因内含子多态性位点的基因型间脂肪沉积和背膘厚差异显著[7-9];IGF2 基因外显子多态性位点的基因型间初生质量和背膘厚差异显著[10];表明IGF2 是影响脂肪沉积性状的候选基因.本试验中,以背膘厚度和皮脂厚度分组,180日龄的长白和蓝塘猪的肌肉组织中IGF2 基因的表达量都呈现一致的趋势,与背膘厚度和皮脂厚度均呈现负相关,和前人结果相一致[2],再次提示IGF2 可能是调节脂肪沉积的因子之一.无论是长白还是蓝塘猪在180日龄后肌肉、肝脏和胃组织中IGF2 基因的mRNA 表达量都显著下降,说明IGF2 在猪早期的肌肉组织、肝脏和胃的生长发育方面起着重要的作用.Stinckens 等[11]研究长大猪出生后4、8、16 和26 周龄时不同肌肉组织的IGF2 基因的mRNA 表达量的发育性变化,结果表明,从4~26 周龄,全部基因型的肌肉组织,其表达量均出现下降趋势.以上研究进一步验证了本研究结果的可靠性.本试验中1日龄和180日龄长白和蓝塘猪的肠、肾脏和心脏等组织的IGF2 基因的mRNA 表达量无显著的差异,这与侯冠彧等[12]研究显示五指山猪8 种组织从30~150日龄IGF2 基因的表达量随着日龄的增加呈逐渐下降的趋势的结果不甚一致,这是否因品种不同导致的,还有待进一步的验证.
H19 基因是与IGF2 呈相互印记的一个基因.H19 基因的母方表达可以通过抑制母源染色体得到转录而降低IGF2 的含量.当H19 基因失活后,雌性胎儿出生时的体质量比正常胎儿高27%[13].试验结果显示180日龄的长白猪各组织中H19 基因的mRNA 表达量与1日龄相比除肠和肾脏组织中的表达量降低外,其他组织的表达量均上升,与Thorvaldsen等[14]研究所说的胎儿中高表达出生后表达受到显著抑制不一致,结果有待进一步验证.180日龄的蓝塘猪各组织中H19 基因的mRNA 表达量与1日龄相比除肠组织的表达量降低外,其他组织的表达量均上升,其中以肾脏组织的上升最为显著.推测其可能参与蓝塘猪的肾脏成年后的生理变化,可能是蓝塘猪与长白猪繁殖性能差异的原因之一.
综上所述,本研究通过比较长白猪和蓝塘猪不同发育时期IGF2、H19 基因的表达变化,证实IGF2、H19 基因对猪脂肪沉积和生长发育有一定的影响,为IGF2 和H19 基因作为分子育种标记基因用于分子辅助育种提供了有益的探索.
[1]LI Chao,BIN Yanfang,CURCHOE C,et al.Genetic imprinting of H19 and IGF2 in Domestic pigs (Sus scrofa)[J].Anim Biotechnol,2008,19(1):22-27.
[2]OWENS P C,GATFORD K L,WALTON P E,et al.The relationship between endogenous insulin-like growth factors and growth of pigs[J].J Anim Sci,1999,77(8):2098-2103.
[3]FLORINI J R,EWTON D Z,FALEN S L,et al.Biphasic concentration dependeney of stimulation of myoblast differentiation by somatomedins[J].Am J Physiol,1986,250(5Pt1):C771-C778.
[4]AYESH S,MATOUK I,SCHNEIDER T,et al.Possible physiological role of H19 RNA[J].Mol Carcinog,2002,35(2):63-74.
[5]HARK A T,SCHOENHERR C.,KATZ D J,et al.CTCF mediates methylation-sensitive enhancer-blocking activity at the H19/Igf2 locus[J].Nature,2000,405(6785):486-489.
[6]BELL A C,FELSENFELD G.Methylation of a CTCF-dependent boundary controls imprinted expression of the Igf2 gene[J].Nature,2000,405(6785):482-485.
[7]刘桂兰,蒋思文,熊远著,等.IGF2 基因PCR-RFLP 多态性与脂肪沉积相关性状的关联分析[J].遗传学报,2003,30(12):1107-1112.
[8]虞德兵,熊锴,张宇霞,等.猪IGF2 Intron3 G3072A 突变及其在背最长肌中差异表达[J].南京农业大学学报,2010,33(6):105-109.
[9]OCZKOWICZ M,TYRA M,WALINOWICZ K,et al.Known mutation (A3072G)in intron 3 of the IGF2 gene is associated with growth and carcass composition in Polish pig breeds[J].J Appl Genet,2009,50(3):257-259.
[10]薛慧良,徐来祥.猪IGF2 基因外显子3 的遗传多态性及遗传效应分析[J].中国生物化学与分子生物学报,2008,24(7):643-648.
[11]STINCKENS A,VAN DEN MAAGDENBERG K,LUYTEN T,et al.The RYR1 g.1843C>T mutation is associated with the effect of the IGF2 intron3-g.3072G>A mutation on muscle hypertrophy[J].Anim Genet,2007,38(1):67-71.
[12]侯冠彧,周汉林,王东劲,等.五指山猪8 种组织IGF2和IGFBP3 基因表达的发育性变化研究[J].家畜生态学报,2010,31(5):8-12.
[13]LEIGHTON P A,INGRAM R S,EGGENSCHWILER J,et al.Disruption of imprinting caused by deletion of the H19 gene region in mice[J].Nature,1995,375(6526):34-39.
[14]THORVALDSEN J L,DURN K L,BARTOLOMEI M S.Deletion of the H19 differentially methylated domain results in loss of imprinted expression of H19 and lgf2[J].Genes Dev,1998,12(23):3693-3702.

