活的非可培养状态金黄色葡萄球菌的诱导和复苏后菌株的生理特征变化
陈颖翘,王 丽,钟青萍
(华南农业大学 食品学院,广东 广州 510642)
1982年Xu 等[1]首次在河口和海洋环境中发现生存但不可培养的霍乱弧菌和大肠杆菌.Colwell等[2-3]提出微生物的“活的非可培养状态”(viable but non-culturable,VBNC)的概念,并于2000年首次撰写了有关VBNC 状态微生物的研究综述与专著.最新的研究认为处于VBNC 状态的细菌并非趋向于死亡,只是为了适应不良环境所做出的一种程序式反应,是一种生存策略[4].不同细菌及同一细菌的不同菌株其进入VBNC 状态的条件及机理各不相同.常见的诱导微生物进入VBNC 状态的因素可分为物理因素(如温度、湿度、氧气浓度、光照度等)、化学因素(营养成分、有害化学物质等)及生物因素.
金黄色葡萄球菌Staphyloccocus aureus 是一种重要的病原菌,可引起许多严重感染.美国疾病预防控制中心报告显示,由金黄色葡萄球菌引起的感染居第2 位,仅次于大肠埃希菌.金黄色葡萄球菌的流行病学一般有如下特点:季节分布多见于春夏季;中毒食品种类多,如奶、肉、蛋、鱼及其制品.鲁梅芳等[5]在4 和-20℃条件下,用添加0.01~0.05 mmol/L的铜离子的方法诱导金黄色葡萄球菌进入VBNC 状态,并发现进入VBNC 状态的细菌呈现不规则球形,但细胞形态完整,没有细胞壁的破裂.有研究表明金黄色葡萄球菌进入VBNC 状态的机制与突变失活的抗氧化基因有关[6].
VBNC 的细菌在一定条件下可以复苏,细菌VBNC 状态的发现和研究对于流行病学、食品安全、水质监测、食品卫生检验等许多方面都具有重要的意义.本研究采用食品防腐剂山梨酸钾等条件诱导金黄色葡萄球菌进入VBNC 状态,对其进行复苏,并考察复苏菌株的生理生化代谢特征及应激抵抗力.本研究为了解食品防腐剂等条件下金黄色葡萄球菌是否进入VBNC 状态,以及复苏菌株的生理特性提供了理论依据,对更新传统的致病菌检测观念和加强食品安全控制亦具有积极的意义.
1 材料与方法
1.1 试验菌株
金黄色葡萄球菌标准菌株(编号26003),购自中国医学细菌保藏管理中心,菌株在4℃条件下保存于含75 g/L NaCl 的营养琼脂斜面上.
1.2 主要试剂与仪器
营养琼脂、肉汤(含75 g/L NaCl)、脑心浸液培养基(BHI)、血琼脂平板均购于广州环凯微生物科技有限公司,纯度均大于97%.API STAPH 试剂条(法国生物梅里埃公司);正立显微镜及显微数码相机系统(德国Leica 公司);扫描电镜(德国TVIPS 公司);5417R 高速冷冻离心机(德国Eppendorf 股份有限公司);生物安全柜(Thermo 公司).
1.3 试验方法
1.3.1 金黄色葡萄球菌VBNC 状态的诱导 将金黄色葡萄球菌接种于BHI 培养基中,37℃摇床培养至对数生长期.在充分考虑温度、山梨酸钾以及富营养(含75 g/L NaCl 的肉汤)和寡营养(质量浓度为75 g/L 的NaCl 溶液)的影响的基础上,结合金黄色葡萄球菌的生理特性,最终确定诱导方案为6 种:1)10 mmol/L 山梨酸钾、富营养、37℃;2)10 mmol/L 山梨酸钾、寡营养、4℃;3)5 mmol/L 山梨酸钾、富营养、-20℃;4)5 mmol/L 山梨酸钾、寡营养、37℃;5)0.5 mmol/L 山梨酸钾、富营养、4℃;6)0.5 mmol/L 山梨酸钾、寡营养、-20℃.分别吸取1 mL 对数生长期的菌液至1.5 mL 的离心管中,4℃条件下,5 000 r/min离心10 min.收集沉淀后,用1 mL 灭菌蒸馏水混悬菌液,分别接种到上述诱导培养基中,摇匀,在不同条件下进行诱导.
1.3.2 细菌计数方法 每隔4 d 取样测定活菌数,10 d 后每隔8 d 取样.采用涂布平板法检测活细菌数的变化,选择合适稀释度的菌悬液100 μL 涂布营养琼脂平板,37℃培养,次日观察计数.当无菌落生长时,加大接种量,连续培养3 d 后,均无菌落生长,即可认为试验样品中的金黄色葡萄球菌进入活的非可培养状态.
1.3.3 VBNC 状态金黄色葡萄球菌的复苏 分别采用肉汤(含75 g/L NaCl)、BHI 液体培养基升温的方法对VBNC 状态的金黄色葡萄球菌进行复苏,具体操作如下:取0.5 mL VBNC 状态的金黄色葡萄球菌菌液,分别加入至5 mL 无菌的肉汤、BHI 液体培养基中,置于37℃恒温培养箱中培育,每隔24 h 取合适稀释度的VBNC 菌液100 μL 涂布营养琼脂平板,于37℃培养,观察是否有金黄色葡萄球菌菌落长出.并绘制VBNC 状态金黄色葡萄球菌复苏生长曲线.
1.3.4 复苏后金黄色葡萄球菌的形态观察 将复苏后的金黄色葡萄球菌划线于血平板上,进行菌落形态观察,并将复苏后的菌体进行革兰氏染色和扫描电镜观察,描述细菌个体形态特征.
1.3.5 复苏后金黄色葡萄球菌的生理生化检测对复苏的金黄色葡萄球菌进行生理生化检测,采用法国生物梅里埃公司的API 系统(API STAPH 试剂条)进行.根据说明书判断反应,参照分析图索引和鉴定软件可以得出鉴定的结果.
1.3.6 复苏后的金黄色葡萄球菌对环境应激的敏感性 将复苏的金黄色葡萄球菌和正常状态的菌体分别在BHI 増菌液中培养至对数生长期,将菌悬液5 000 r/min 离心15 min,收集细胞,用适量体积的PBS(pH 7.2)洗涤,稀释到适当浓度用于环境应激试验,每项试验设计2 个重复,每个稀释度做2 个平行.
紫外线辐射:分别吸取0.1 mL 适当浓度的正常和复苏的菌悬液,涂布血平板,无菌条件下紫外线照射0、30、60、90 s.紫外灯功率15 W,照射距离50 cm,照射结束后置于暗处避光修复10 min,于37℃条件下培养24 h,进行菌落计数并计算存活率[7].
高渗透压处理:正常和复苏的菌体细胞置于PBS 中(含2.5 mol/L NaCl),分别在室温下放置0、30、60、90 min 后取样,涂布血平板,37℃培养24 h,进行菌落计数并计算存活率[8].
热激处理:正常和复苏的菌体细胞用预热的PBS(72℃)悬浮,再置于72℃的水浴中分别处理0、5、10、15 s 后取样,迅速冰浴冷却,涂布血平板,37℃培养24 h,进行菌落计数并计算存活率[8].
冷激处理:正常和复苏的菌体细胞用预冷的PBS(4℃)悬浮,分别在4℃冰箱中处理0、30、60、90 min 后取样涂布血平板,37℃培养24 h,进行菌落计数并计算存活率[9].
2 结果与分析
2.1 不同诱导条件下金黄色葡萄球菌数量变化规律
经过一定时间的诱导,随着诱导时间的延长,可培养菌的总数不断减少,下降最慢的是10 mmol/L山梨酸钾富营养状态37℃的诱导方案(诱导方案1),当至132 d 时,总数下降为0,说明诱导成功.另外5 种诱导方案分别于84、84、85、85 和76 d 进入VBNC 状态,结果如图1.
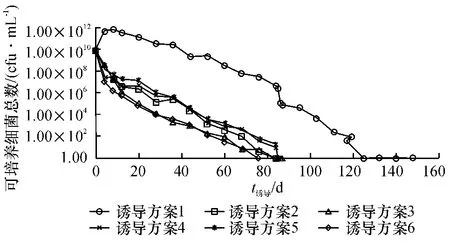
图1 金黄色葡萄球菌存活曲线Fig.1 The survival curve of Staphylococcus aureus
2.2 VBNC 状态金黄色葡萄球菌的复苏
分别采用肉汤(含75 g/L NaCl)、BHI 液体培养基升温的方法对VBNC 状态的金黄色葡萄球菌进行复苏,每隔24 h 取合适稀释度的菌液100 μL 涂布营养琼脂平板,于37℃培养.发现采用肉汤培养基升温的方法不能使菌体复苏,培养20 d 后仍未见有菌落长出.而采用BHI 液体培养基升温复苏法培养2 d 时,取样涂布营养琼脂平板可见有大小一致的金黄色葡萄球菌单一菌落,菌数为102cfu/mL.随着复苏时间的延长,可培养细菌数迅速增加,至120 h 时,可培养菌数约为107cfu/mL(图2).表明BHI 液体培养基复苏法可使VBNC 状态的金黄色葡萄球菌复苏.

图2 VBNC 状态金黄色葡萄球菌在BHI 液体培养基中的复苏曲线Fig.2 The resuscitation curve of Staphylococcus aureus from VBNC state in BHI medium
2.3 复苏后的金黄色葡萄球菌的形态特征
复苏后的金黄色葡萄球菌菌落形态与正常状态的菌落形态都是表面光滑湿润、凸起、边缘整齐,但正常状态的菌落呈金黄色,复苏后的菌落呈乳白色,并且没有溶血圈.
经过革兰染色和扫描电镜观察,发现复苏后与正常状态的金黄色葡萄球菌均呈球形,成葡萄串状,无芽孢,无荚膜,革兰染色阳性(图3).

图3 正常状态和复苏后的金黄色葡萄球菌的扫描电镜观察Fig.3 Morphological characteristics of the normal and resuscitative cells of Staphylococcus aureus by scanning electron microscope
2.4 复苏后的金黄色葡萄球菌的生理生化特性
使用法国生物梅里埃公司的API STAPH 生化鉴定试剂盒对复苏的金黄色葡萄球菌进行生化鉴定,按照API STAPH 生化反应表对反应的结果进行判读和记录:标准菌株与复苏菌株均可分解D-葡萄糖、D-果糖、D-甘露糖、麦芽糖、乳糖、D-海藻糖、D-甘露醇、蔗糖和N-乙酰-葡萄糖甙,产酸不产气;能还原硝酸盐至亚硝酸盐;分解丙酮酸钠为乙酰-甲基-甲醇,水解精氨酸;不能分解木醇、D-蜜二糖、棉籽糖、木糖和α-甲基-D-酸性磷酸盐.但与标准菌株不同的是复苏菌株不能水解尿素.将上述鉴定得到的生化谱输入软件,得到鉴定结果,金黄色葡萄球菌鉴定百分比为98.1%.复苏后的菌株除尿素酶阴性外,其他代谢特征均与标准菌株相同,以此可以推断VBNC 状态的金黄色葡萄球菌经过复苏,基本恢复了正常的代谢过程.
2.5 复苏后的金黄色葡萄球菌对环境应激的抵抗力
紫外照射时,正常的和复苏的金黄色葡萄球菌的存活率随着时间的延长而逐渐降低,正常的细胞存活率比复苏细胞存活率略大,照射90 s 后2 种状态的菌体全部失去培养能力(图4a).在热激(72℃)条件下,正常和复苏的细胞的存活率随着处理时间的延长迅速降低,处理5 s 后,正常细胞存活率仅为1.2%,复苏细胞已经降为0%,15 s 后两种状态的细胞全部失去培养能力(图4b).冷激(4℃)条件下,正常和复苏的细胞存活率均有所下降,90 min 后正常细胞存活率为41%,比复苏细胞存活率高(图4c).高渗条件下保持90 min 后,正常状态细胞的存活率为10%,复苏细胞的存活率为9%(图4d).
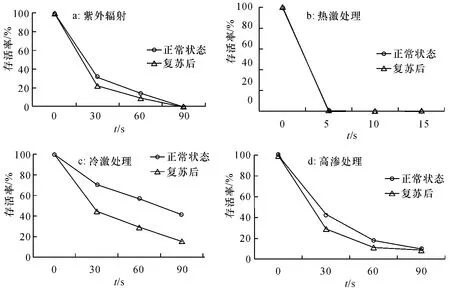
图4 环境应激对不同状态金黄色葡萄球菌存活率的影响Fig.4 Effects of environmental stress on survival of Staphylococcus aureus in different states
3 讨论与结论
活的非可培养状态是细菌抵抗不良环境的一种生存方式,不同细菌对外界环境压力的耐受性不同[10].本文研究了食品防腐剂条件下金黄色葡萄球菌的VBNC 状态,将金黄色葡萄球菌置于适量山梨酸钾、富营养或寡营养状态下,分别于常温和低温下诱导,都能使其进入VBNC 状态.其中,10 mmol/L 山梨酸钾、富营养状态、37℃诱导条件下,诱导时间长达132 d.而鲁梅芳等[5]采用低温、铜离子溶液诱导金黄色葡萄球菌4 d 内就能进入VBNC 状态.国内外的研究显示,VBNC 的诱导因素多样,不同种类的细菌,同种不同株的细菌,诱导因素亦不同,但这些因素变化均是向着不利于正常细胞存活的方向.
杨政[11]将进入VBNC 状态的金黄色葡萄球菌接种到肉汤培养基中,37℃条件下培养,实现了复苏.但本试验用该方法无法起到复苏的作用,而接入BHI 液体培养基中,37℃培养2 d 后,细菌数量达到102cfu/mL.分析其原因可能是本试验中进入VBNC状态的金黄色葡萄球菌对培养的营养条件要求增加,而BHI 培养基比普通肉汤营养更高,能给VBNC状态的金黄色葡萄球菌提供充分的营养,从而使其恢复到可培养状态.复苏后的细胞大小与形态与正常状态相同,细胞的结构完整.复苏后的细胞除了脲酶呈阴性外,其他生理生化代谢基本恢复.该结果与郝小斌等[12]研究结果相似,脲酶由脲酶基因簇(ure)编码,复苏后菌株脲酶阴性,说明ure 在VBNC 状态或复苏时发生了变化.
有研究报道发现,金黄色葡萄球菌菌落呈金黄色是因为产类胡萝卜素的缘故[13],而类胡萝卜素具有抗氧化功能[14-15],通过长期研究发现,这种类胡萝卜素能够帮助金黄色葡萄球菌抵御外来杀伤[16],当研究人员将金黄色葡萄球菌中的类胡萝卜素基因敲除后,它们就容易被杀死,而研究人员进一步将类胡萝卜素转入一种威胁性很小的链球菌中,结果发现链球菌不仅变成了金黄色,而且变得更具危险性[17].复苏后的金黄色葡萄球菌对紫外照射、温度应激和高渗透压的抵抗能力都比正常状态的金黄色葡萄球菌弱,这可能与复苏后的金黄色葡萄球菌不产类胡萝卜素有关.
[1]XU Huaishu,ROBERTS N,SINGLETON F L,et al.Survival and viability of nonculturable Escherichia coli and Vibrio cholerae in the estuarine and marine environment[J].Microb Eclol,1982,8(4):313-323.
[2]COLWELL R R,BRAYTON P R,GRIMES D J,et al.Viable but non-culturable Vibrio cholerae and related pathogens in the environment:Implications for release of genetically engineered microorganisms[J].Nat Biotechnol,1985,3:817-820.
[3]COLWELL R R,GRIMES D J.Nonculturable microorganisms in the environment[M].Washington:ASM Press,2000:57-75.
[4]OLIVER J D.Recent findings on the viable but nonculturable state in pathogenic bacteria[J].FEMS Microbiol Rev,2010,34(4):415-425.
[5]鲁梅芳,金玉妍.金黄色葡萄球菌获得非可培养的诱导和检出[J].环境与健康,2009,26(10):877-879.
[6]SALMA M,MICHEL D,SAMI M.Inactivation of the gene katA or sodA affects the transient entry into the viable but non-culturable response of Staphylococcus aureus in natural seawater at low temperature[J].Mar Pollut Bull,2010,60(12):2209-2214.
[7]WATSON S P,CLEMENTS M O,FOSTER S J.Characterization of the starvation survival response of Staphylococcus aureus[J].Bacteriol,1998,180(7):1750-1758.
[8]MARY P,SAUTOUR M,CHIHIB N E,et al.Tolerance and starvation induced cross protection against different stresses in Aeromonas hydrophila[J].Int J Food Microbiol,2003,87(1/2):121-130.
[9]CHIANG M L,HO W L,CHOU C C.Response of Vibrio parahaemolyticus to ethanol shock[J].Int J Food Microbiol,2006,23(5):461-467.
[10]WONG H C,WANG P.Induction of viable but non-culturable state in Vibrio para-haemolyticus and its susceptibility to environmental Stresses[J].Appl Microbiol,2004,96(2):359-366.
[11]杨政.三种致病菌“活的非可培养状态”的诱导与研究[D].天津:天津科技大学,2009.
[12]郝小斌,宁喜斌,张继伦.副溶血弧菌活的非可培养状态及其复苏菌株特性的分析[J].辽宁农业科学,2010(5):10-16.
[13]MARSHALL J H,WILMOTH G J.Pigments of Staphylococcus aureus a series of triterpenoid carotenoids[J].Bacteriol,1981,147(3):900-913.
[14]KRINSKY N.Actions of carotenoids in biological systems[J].Annu Rev Nutr,1993,13(7):561-587.
[15]LOWE G M,MCGARVEY J D,MORTENSEN A,et al.Carotenoid radical chemistry and antioxidant/pro oxidant properties[J].Arch Biochem Biophys,2004,430(1):37-48.
[16]GEORGE Y L,ANTHONY E,JOHN T B,et al.Staphylococcus aureus golden pigment impairs neutrophil killing and promotes virulence through its antioxidant activity[J].Exp Med,2005,202(2):209-215.
[17]朱自强.金黄色葡萄球菌更具杀伤力的原因在于其金黄色“外壳”[J].基础医学与临床,2005,25(11):1053-1054.

