亚洲栽培稻与短花药野生稻种间杂交障碍观察
傅雪琳,刘向东,卢永根
(华南农业大学 农学院,广东 广州 510642)
稻属Oryza 有2 个栽培种和22 个野生种,野生稻蕴含着宝贵的基因资源,其中短花药野生稻O.brachyantha属FF 基因组,是稻属中与亚洲栽培稻O.sativa(AA 基因组)亲缘关系较远的一个野生稻种[1],其基因组与亚洲栽培稻基因组明显不同[2-3].尽管短花药野生稻蛋白质编码基因远少于水稻[4],但是短花药野生稻具有对多种水稻病虫较好的抗性,如抗褐飞虱、螟虫、稻纵卷叶螟、稻瘿蚊以及草丛矮缩病、柱头外露等[5-6],是水稻育种重要的遗传资源.IRRI 通过栽培稻与短花药野生稻种间杂交,培育了栽培稻品种IR56 背景的短花药野生稻渗入系,将短花药野生稻的新白叶枯病抗性基因Xa34 (t)成功转入栽培稻[7-8].通过杂交,短花药野生稻对稻纵卷叶螟高的抗性也成功转入栽培稻品种[9].通过对栽培稻与短花药野生稻渗入系的分子标记检测分析,在水稻第6、7、9 和11 号染色体上检测到1~2 个短花药野生稻RFLP 标记的渗入,尽管观察到的渗入水平较低,但这一结果表明了从远缘的短花药野生稻基因组向栽培稻进行染色体片段以及有利基因渗入的可能性[7].
由于短花药野生稻与栽培稻属于不同的基因组,其遗传分化明显,种间杂交存在严重的生殖障碍,因此,对短花药野生稻有利基因转移利用研究难度较大,相关的研究报道极少.已有的报道中栽培稻和野生稻杂种后代的获得均是通过杂种幼胚拯救途径获得[10],但缺乏对栽培稻与短花药野生稻种间杂交障碍机理的研究,对克服栽培稻与短花药野生稻种间生殖障碍有效途径的探索也鲜见报道.随着短花药野生稻全基因组测序的完成[4],如何有效利用其大量的有利基因改良栽培稻品种成为人们关注的重要研究领域.因此,弄清楚栽培稻与短花药野生稻种间生殖隔离机理显得非常重要,这必将有助于推动通过有性杂交途径转移利用短花药野生稻的有利基因的研究进程.本研究利用整体曙红染色透明激光扫描共聚焦显微术(Whole-mount eosin B-staining confocal laser scanning microscopy,简称WE-CLSM)对栽培稻与短花药野生稻杂交后杂种胚胎胚乳发育及杂种胚囊结构与发育过程进行了观察,以期阐明栽培稻与短花药野生稻种间交配性障碍和杂种雌性不育障碍的细胞学机理,为探索种间有效杂交体系和方法奠定基础.
1 材料与方法
1.1 供试材料
栽培稻O.sativa 材料为籼稻品种广陆矮4 号,短花药野生稻O.brachyantha 为来自IRRI 的种子播种材料Accession No.IRGC 105171.
1.2 杂交配组、花粉萌发、受精及杂种胚胎胚乳发育观察
以广陆矮4 号为母本、短花药野生稻为父本配制杂交组合.母本去雄采用剪颖法结合温汤杀雄法进行,采用离体杂交方法进行杂交,杂交当日采集正在开花的野生稻的花药,以捻穗法给母本穗授粉.于授粉后第10—12 天调查各组合杂交小穗数、杂种子房膨大数,计算杂种子房膨大率.
采用苯胺蓝溶液染色法[11]观察短花药野生稻花粉在母本广陆矮4 号柱头上的萌发.取授粉后10~30 min 的杂交小穗,在Leica DMRXA (德国)光学显微镜下进行观察拍照.统计柱头上萌发花粉数和花粉总数,计算花粉萌发率.
采用WE-CLSM 观察杂交小穗胚胎胚乳发育.分别在授粉后第1 、3 和7 天用FAA 液固定杂交小穗24 h,以φ(乙醇)为50%的溶液冲洗,后转入φ(乙醇)为70%的溶液4℃冰箱保存.在普通解剖镜下解剖出子房,经φ(乙醇)为70%、50%、30%、10%梯度溶液及蒸馏水进行复水后(每级间隔20 min),再用40 g/L 蔗糖曙红溶液染色10 h,水洗多余染料2~3次,用φ(乙醇)为10%、30%、50%、70%、90%、100%的梯度溶液进行材料脱水(每级间隔20 min),再经无水乙醇脱水2 次后转入1/2 水杨酸甲酯[V(无水乙醇)∶V(水杨酸甲酯)=1 ∶1]整体透明1 h,转入纯水杨酸甲酯透明20 min 以上.观察时将子房放在凹面载玻片上,盖上盖玻片,在LeicaSP2激光扫描共聚焦显微镜下用543 nm 波长激发光扫描观察,并获取图像,用Adobe photoshop7.0 处理图像.
1.3 杂种幼胚培养与植株鉴定
从杂交小穗上剥取授粉后第10—12 天的膨大子房,用φ(乙醇)为70%的溶液对子房表面消毒30 s,无菌水冲洗2 次,再用1 g/L HgCl2表面消毒30 min,无菌水冲洗3~4 次,在超净工作台上无菌切取子房基部带胚部分,并接种到培养基上(25±1)℃暗培养,诱导出苗.待幼芽长出约2 cm 高时,进行昼夜连续光照培养.3~4 片叶时炼苗移栽.培养基:1/4 MS 培养基+30 g/L 蔗糖+7 g/L 琼脂.
采用形态性状和SSR 标记对杂种进行鉴定.植株形态性状调查参照中国农业科学院作物品种资源研究所实行的记载标准[12].SSR 标记鉴定参照Panaud 等[13]的方法.
1.4 杂种胚囊结构与发育过程观察
取杂种F1当天开花小穗,剪除颖壳顶部后固定于FAA 固定液24 h 以上.随后进行脱水、复水处理,蔗糖曙红溶液染色,以及激光扫描共聚焦显微镜观察.具体方法同“1.2”杂交小穗胚胎胚乳发育的观察.
2 结果与分析
2.1 杂交小穗发育与杂种植株获得
在授粉后第10—12 天,统计杂交组合广陆矮4号×短花药野生稻授粉小穗共439 个,其中有104个小穗子房膨大,子房膨大率23.7%.与广陆矮4 号花后第10 天子房(图1a)相比,杂种子房瘦瘪,未有淀粉充实积累,出现夭亡趋势(图1b).离体培养60粒杂种幼胚,获得植株3 棵,成活2 棵.杂种植株株型较分散,小穗有芒,柱头外露,落粒性强,这些形态性状偏向父本短花药野生稻(图1c、1d),杂种在引物RM186 位点扩增的主带带型呈双亲的杂合共显带型(图2),表明所得杂种为真杂种.

图1 杂种子房及杂种植株形态表现Fig.1 Hybrid ovaries,plantlets and spikes
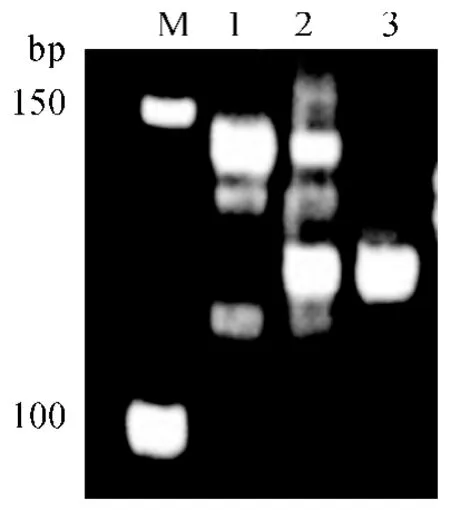
图2 杂种及亲本在引物RM186 位点的扩增结果Fig.2 PCR amplifications of hybrid and parents at the locus of RM186
2.2 杂交小穗受精及杂种胚胎胚乳发育特点
在给母本穗充足授粉的情况下,观察短花药野生稻花粉在广陆矮4 号柱头上的萌发情况.结果表明,短花药野生稻的花粉萌发率为84.3%,花粉管从花粉粒的伸出和向花柱的伸长生长均正常,绝大多数柱头上有多条花粉管向花柱和胚珠伸长生长,表明短花药野生稻花粉能够在广陆矮4 号柱头上正常萌发.取杂交小穗授粉后第1 天和第3 天的胚囊观察杂交受精情况表明,杂交小穗双受精率为82.93%,卵细胞单受精率为2.44%,以双受精为主.该结果表明栽培稻与短花药野生稻杂交双受精率高,受精前障碍不足以影响杂交结实.
与广陆矮4 号自交小穗胚胎胚乳发育过程[14]比较,杂种胚胎胚乳在各发育阶段均出现异常现象.杂交授粉后第1 天,杂交小穗胚囊内胚胎发育为球形胚的占95.65%(图3a、3b),极少数胚囊内游离胚乳核核仁明显,沿胚囊内壁零星分布,表现为正常发育(图3a);大多数胚囊内游离胚乳核提早解体,核仁弥散模糊,部分胚囊内反足细胞团开始解体(图3b).杂交授粉后第3 天,杂种胚胎仍呈球形胚,未观察到梨形胚,胚胎发育落后或处于停滞状态(图3c、3d),少数胚囊内游离胚乳核继续分裂增殖,游离胚乳核数目增多,但未形成细胞化的胚乳(图3c),多数胚囊内游离胚乳核发育停滞或解体退化(图3d).杂交授粉后第7 天,杂种胚胎仍呈球形胚,发育停滞或开始解体,游离胚乳核未发生细胞化,并且沿胚囊腔分布的游离胚乳核已在解体(图3e、3f).由此可见,杂种胚胎胚乳发育严重异常,导致杂种胚在发育中途夭亡,不能形成正常成熟的杂种种子.
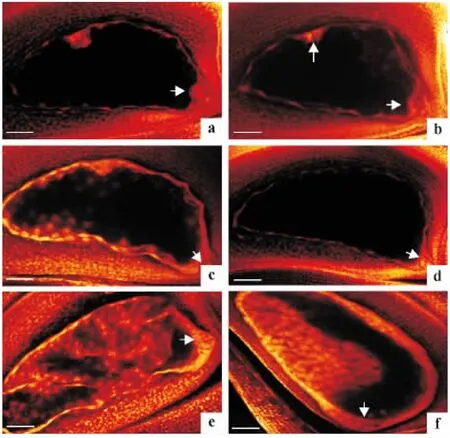
图3 授粉后第1、3 和7 天杂种胚胎胚乳发育Fig.3 Development of hybrid embryo and endosperm at 1,3 and 7 days after pollination
2.3 杂种胚囊败育与发育特点
共观察杂种成熟胚囊84 个,全部为结构异常,表现为胚珠内无胚囊轮廓或无完整的胚囊腔,在珠心组织内胚囊着生位出现退化残迹,周围珠心组织也异常解体,最终表现败育(图4a).
对杂种胚囊发育过程进行观察,其发育过程也经历了孢原细胞形成期、大孢子母细胞形成期、大孢子母细胞减数分裂期、功能大孢子形成期、单核胚囊形成期、胚囊有丝分裂期等时期,但是一些主要时期出现异常发育现象,难以完成发育过程而形成正常的成熟胚囊.杂种胚囊主要发育过程的特点表现为:孢原细胞能够正常启动形成大孢子母细胞(图4b、4c);大孢子母细胞减数分裂期能够完成减数分裂过程,形成四分体,但四分体处于异常状态,即子细胞不发育,合点端的子细胞不能进一步发育为功能大孢子(图4d);极少数情况下四分体合点端的子细胞形成功能大孢子,进一步形成单核胚囊(图4e),但更多是异常单核胚囊的形成(图4f);单核胚囊难以进入胚囊有丝分裂期,在珠心组织内大孢子母细胞的部位只残留退化痕迹(图4h),附近的珠心组织也随之解体(图4i);仅观察到1 个异常二核胚囊的形成(图4g).
综合以上结果来看,广陆矮4 号与短花药野生稻杂种F1胚囊形成和发育过程严重异常,异常发生的时期主要集中在大孢子母细胞减数分裂期和功能大孢子形成期,说明大孢子母细胞经过减数分裂过程不能形成正常的四分体,而四分体的异常直接导致不能形成正常的功能大孢子,这必将导致胚囊不能形成,杂种表现高度的雌性不育.

图4 杂种败育胚囊与胚囊发育过程Fig.4 Abortive embryo sac and the embryo sac development of hybrid
3 讨论
由于短花药野生稻是稻属基因组最小的一个种[15],其基因组分化程度高且相对稳定,在稻属进化与分类研究中具有重要而特殊的地位[4].近年来,对短花药野生稻基因组特点与分化、以及与亚洲栽培稻等稻属其他种之间比较基因组研究的报道日益增多,其基因组的组成特点越来越被人们所认识.在短花药野生稻着丝粒区存在特异的重复序列CentO-F,A 基因组和F 基因组存在高度分化[16];短花药野生稻着丝粒区有一个新的反转录转座元件FRetro3,而且该转座元件在短花药野生稻基因组以高拷贝数存在[17];短花药野生稻和亚洲栽培稻基因编码区核苷酸发生替换,短花药野生稻基因组反转录转座子的大小和数量远小于籼稻基因组,而短花药野生稻和亚洲栽培稻基因组存在共线性,为利用比较基因组学探究野生稻的遗传多样性并利用其改良栽培稻品种提供了可能[18].2013年短花药野生稻全基因组测序完成,表明在短花药野生稻基因组中包含不到30%的重复元件,长末端重复反转录转座子活性较低,且有大量的古老长末端重复元件被删除,从而导致该基因组维持较小的状态;短花药野生稻基因组注释了32 038个蛋白质编码基因,其中70%定位在对照水稻O.sativa 基因组的共线位置[4].这为研究和利用短花药野生稻有利基因提供了重要的信息资源.
随着对短花药野生稻基因组测序完成和基因信息的深入了解,如何利用其有利基因创新水稻育种的遗传资源越来越受到研究者的重视.有性杂交是迄今为止在野生稻有利基因转移利用方面的主要途径,在栽培稻与非AA 组野生稻种间杂交中杂交不结实和杂种不育障碍成为一种限制“瓶颈”,严重影响了杂交效率和效果[19].本研究利用激光扫描共聚焦显微术对栽培稻与短花药野生稻杂交后杂种胚胎和胚乳发育、以及杂种胚囊发育过程进行了观察.本研究结果表明,杂交小穗在母体植株上发育到一定时期出现杂种胚胎和胚乳发育停滞并解体,导致杂种不活,适时幼胚拯救可以帮助获得杂种植株.杂种胚囊高度不育,其原因主要在于大孢子母细胞减数分裂后不能形成正常的四分体以及正常的功能大孢子,最终导致胚囊不能形成,表现高度雌性不育.通过对杂种进行染色体加倍使得杂种产生2n 雌配子,将能够提高杂种育性,实现进一步的回交或自交结实.栽培稻与短花药野生稻种间生殖隔离机理研究对探索通过有性杂交途径转移利用短花药野生稻有利基因提供了指导依据.
[1]VAUGHAN D A.Wild relatives of rice:Genetic resources handbook[M].Manila:International Rice Research Institute,1994.
[2]ABBASI F M,SHAH A H,PERVEEN F,et al.Genomic affinity between Oryza sativa and Oryza brachyantha as revealed by in situ hybridization and chromosome pairing[J].Afr J Biotechnol,2010,9(21):3068-3072.
[3]CHANG Kweiduan,FANG Shaoan,CHANG Fangchi,et al.Chromosomal conservation and sequence diversity of ribosomal RNA genes of two distant Oryza species[J].Genomics,2010,96:181-190.
[4]CHEN Jinfeng,HUANG Quanfei,GAO Dongying,et al.Whole-genome sequencing of Oryza brachyantha reveals mechanisms underlying Oryza genome evolution[J].Nat Comms,2013,4:1595-1604.
[5]何光存.野生稻有利基因的挖掘与转移[M]∥罗利军,应存山,汤圣祥.稻种资源学.武汉:湖北科学技术出版社,2002:279.
[6]BRAR D S,KHUSH G S.Alien introgression in rice[J].Plant Mol Biol,1997,35:35-47.
[7]BRAR D S,DALMACIO R,ELLORAN R,et al.Gene transfer and molecular characterization of introgression from wild Oryza species into rice[M]∥KHUSH G S.Rice genetics(Ⅲ).Manila:International Rice Research Institute,1996:477-486.
[8]RAM T,LAHA G S,GAUTAM S K,et al.Identification of a new gene introgressed from Oryza brachyantha with broad-spectrum resistance to bacterial blight of rice in India[J].Rice Genetics Newsletter,2010(25):57-61.
[9]RAMACHANDRAN R,KHAN Z R.Mechanisms of resistance in wild rice Oryza brachyantha to rice leaffolder Cnaphalo crocismedinalis (Guenée)(Lepidoptera:Pyralidae)[J].J Chem Ecol,1991,17(1):41-65.
[10]BRAR D S,ELLORAN R,KHUSH G S.Interspecific hybrids produced through embryo rescue between cultivated and eight wild species of rice[J].Rice Genetics Newsletter,1991(8):91-93.
[11]胡适宜.植物胚胎学实验方法(五):检查花粉在柱头上萌发和花粉管在花柱中生长的制片法[J].植物学通报,1994,11:58-60.
[12]中国农业科学院作物品种资源研究所.稻属野生种种质资源调查项目及记载标准[S].北京:中国科学院,1986.
[13]PANAUD O,CHEN X,MCCOUCH S R.Development of microsatellite markers and characterization of simple sequence length polymorphism (SSLP)in rice (Oryza sativa L)[J].Mol Genet Genomics,1996,252:597-607.
[14]FU Xuelin,LU Yonggen,LIU Xiangdong,et al.Crossability barriers in the interpsecific hybridization between Oryza sativa L.and O.meyeriana Baill[J].J Plant Integrative Biol,2009,51(1):21-28.
[15]UOZU S,IKEHASHI H,OHMIDO N,et al.Repetitive sequences:Cause for variation in genome size and chromosome morphology in the genus Oryza[J].Plant Molecular Biology,1997,35(6):791-799.
[16]LEE H R,ZHANG Wenli,LANGDON T,et al.Chromatin immunoprecipitation cloning reveals rapid evolutionary patterns of centromeric DNA in Oryza species[J].PNAS,2005,102(33):11793-11798.
[17]GAO Dongying,GILL N,KIM H R,et al.A lineage-specific centromere retrotransposon in Oryza brachyantha[J].The Plant Journal,2009,60(5):820-831.
[18]ZHANG Shibo,GU Yongqiang,SINGH J,et al.New insights into Oryza genome evolution:High gene colinearity and differential retrotransposon amplification[J].Plant Molecular Biology,2007,64(5):589-600.
[19]FU Xuelin,LU Yonggen,LIU Xiangdong,et al.Progress on transferring elite genes from Non-AA genome wild rice into Oryza sativa through interspecific hybridization[J].Rice Science,2008,15(2):79-87.

