不同质量浓度脱落酸对小白菜硫代葡萄糖苷含量的影响
胡克玲,朱祝军
(1 安徽农业大学 园艺学院,安徽 合肥 230036;2 浙江农林大学 农业与食品科学学院,浙江 临安 311300)
硫代葡萄糖苷简称硫苷,是一种主要分布于十字花科植物中的富含氮硫的次生代谢产物,与人类的身体健康有非常密切的关系,在抗癌方面的作用已得到人们的公认[1].根据侧链基团的氨基酸来源不同,可将硫苷分为脂肪族、芳香族、吲哚族硫苷[2].硫苷合成除了受到硫、盐[3]等因素影响外,也受一些植物生长激素的调控[4].随着对植物激素生理功能和作用机制方面研究的不断深入,人们发现植物激素和硫苷存在着非常复杂的相互作用[4].
脱落酸(Absicsic acid,ABA)作为植物体内一种重要的植物激素,在调节植物生长发育、衰老以及适应环境胁迫方面具有重要的作用[5].但目前,有关外源ABA 影响植物硫苷含量的报道较少,外源ABA 对植株硫苷含量的影响机制尚不清楚.为了探索ABA对硫苷的调控机制,本文研究了不同浓度的外源ABA 对小白菜硫苷含量和组成的影响,探讨不同浓度ABA 处理对小白菜硫苷含量和组成的影响机制,以期为硫苷的合成调控提供理论依据.
1 材料与方法
1.1 材料培养与试验设计
选用小白菜Brassica campestris L.ssp.chinensis(L.)Makino var.communis Tsen et Lee‘上海青'为试验材料.将小白菜种子播种于蛭石中,待其生长至2~3 片真叶时,挑选生长一致的幼苗,移栽到10 L的塑料箱中,溶液培养.营养液成分:Ca (NO3)2、KH2PO4、KNO3、MgSO4和NH4NO3浓度分别为2.5、1.0、4.0、1.0 和0.5 mmol·L-1,H3BO3、H2MoO4、MnSO4、ZnSO4、CuSO4和EDTA-Fe 浓度分别为10.0、0.1、3.0、2.0、0.8 和40.0 μmol·L-1.培养期间每3~4 天更换1 次营养液.白天温度25~30℃,夜间温度15~18℃,最大光照强度为3 万lx.
试验设置5 、10 和20 mg·L-1的ABA 3 个处理,以清水为对照(CK).先将ABA(Sigma 公司产品)配制成1 000 mg·L-1的溶液,再根据试验所需进行稀释.将ABA 溶液均匀喷施于小白菜叶面,每株一次性喷施5 mL.每个处理重复3 次,每个重复为6 株,每处理共18 株.处理7 d 后取样.整株采收,用湿棉布包裹小白菜根部,放进泡沫箱中,迅速运回实验室.将地上部与根部分割,测定地上部鲜质量,并用液氮迅速处理,保存在超低温冰箱(-80℃)中,然后在冷冻干燥机中干燥,研磨,在超低温冰箱中保存备用.
1.2 硫苷含量分析
参照Krumbein 等[6]、陈新娟等[7]的方法并略微修改.称取0.25 g 冻干样品于80℃水浴中预热1 min 后,用4 mL 体积分数为70%的甲醇于75℃水浴条件下提取10 min,冷却后加入1 mL 乙酸钡,用漩涡仪充分混合后,4 000 r·min-1离心10 min,保存上清液,沉淀再用体积分数为70%甲醇提取2 次.将3 次提取的上清液定容至10 mL.同时做1 个平行重复,在另一份样品中加入5 mmol·L-1的2-丙烯基硫苷(Sigma-Aldrich Co.,MO,USA)100 μL 作为内标,其他操作相同.取5 mL 提取液在0.03 MPa 压力下流经DEAE SephadexTMA25 (Amersham Biosciences,Sweden)固相萃取柱,待提取液全部流出小柱后,加入200 μL 硫酸酯酶液(Sigma-Aldrich Co.,MO,USA).室温反应12 h 后用5 mL 超纯水洗脱.洗脱液用0.45 μm 滤膜过滤后在4℃条件下保存,待高效液相色谱(HPLC)分析.
HPLC 分离条件:色谱柱为Prontosil ODS2(250×4 mm,5 μm;Bischoff,Germany).柱温30℃.流动相为超纯水和乙腈.梯度条件为0~45 min 内乙腈浓度线性梯度变化0~20%,水梯度变化为100%~80%.检测波长229 nm,流速1.3 mL·min-1.
1.3 统计分析
作图采用Originlab 7.5 软件.数据采用SAS 软件进行方差分析.
2 结果与分析
2.1 ABA 处理对小白菜生长的影响
如图1 所示,在本试验所设置质量浓度下,小白菜的地上部鲜质量随ABA 处理质量浓度的增加有下降的趋势,但与对照相比并没有显著的差异.
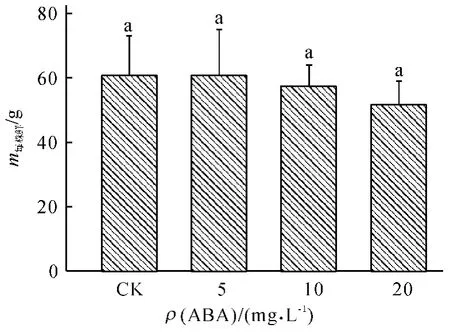
图1 不同质量浓度ABA 处理对小白菜地上部鲜质量的影响Fig.1 Effects of ABA with different concentrations on fresh mass of pakchoi shoots
2.2 ABA 处理对小白菜地上部脂肪族硫苷含量的影响
在小白菜地上部共检测到7 种单个硫苷,分别是:3 种脂肪族硫苷,包括5-甲基亚磺酰戊基硫苷(Glucoalyssin),3-丁烯基硫苷(Gluconapin),4-戊烯基硫苷(Glucobrassicanapin);3 种吲哚族硫苷,包括吲哚-3-甲基硫苷(Glucobrasscin),4-甲氧基吲哚-3-甲基硫苷(4-methoxyglucobrasscin),1-甲氧基吲哚-3-甲基硫苷(Neoglucobrassicin);1 种芳香族硫苷,即2-苯乙基硫苷(Gluconasturtin).
不同质量浓度ABA 处理对单个脂肪族硫苷和总脂肪族硫苷含量均产生了不同程度的影响.在ABA 处理下,5-甲基亚磺酰戊基硫苷(图2A)含量与对照差异不显著.不同质量浓度ABA 处理下,3-丁烯基硫苷(图2B)和总脂肪族硫苷(图2D)含量呈相似的变化趋势.较低质量浓度ABA(5 mg·L-1)处理对3-丁烯基硫苷和总脂肪族硫苷含量没有显著影响;但随着ABA 质量浓度的增加,两者含量有下降的趋势,特别是在ABA 质量浓度为10 mg·L-1时,两者含量最低,与对照相比,分别减少了38%和42%.不同质量浓度ABA 处理均降低了4-戊烯基硫苷(图2C)含量,尤其在ABA 质量浓度为10 mg·L-1时显著降低了4-戊烯基硫苷含量,比对照降低了56%.说明ABA 对脂肪族硫苷合成为负调控.
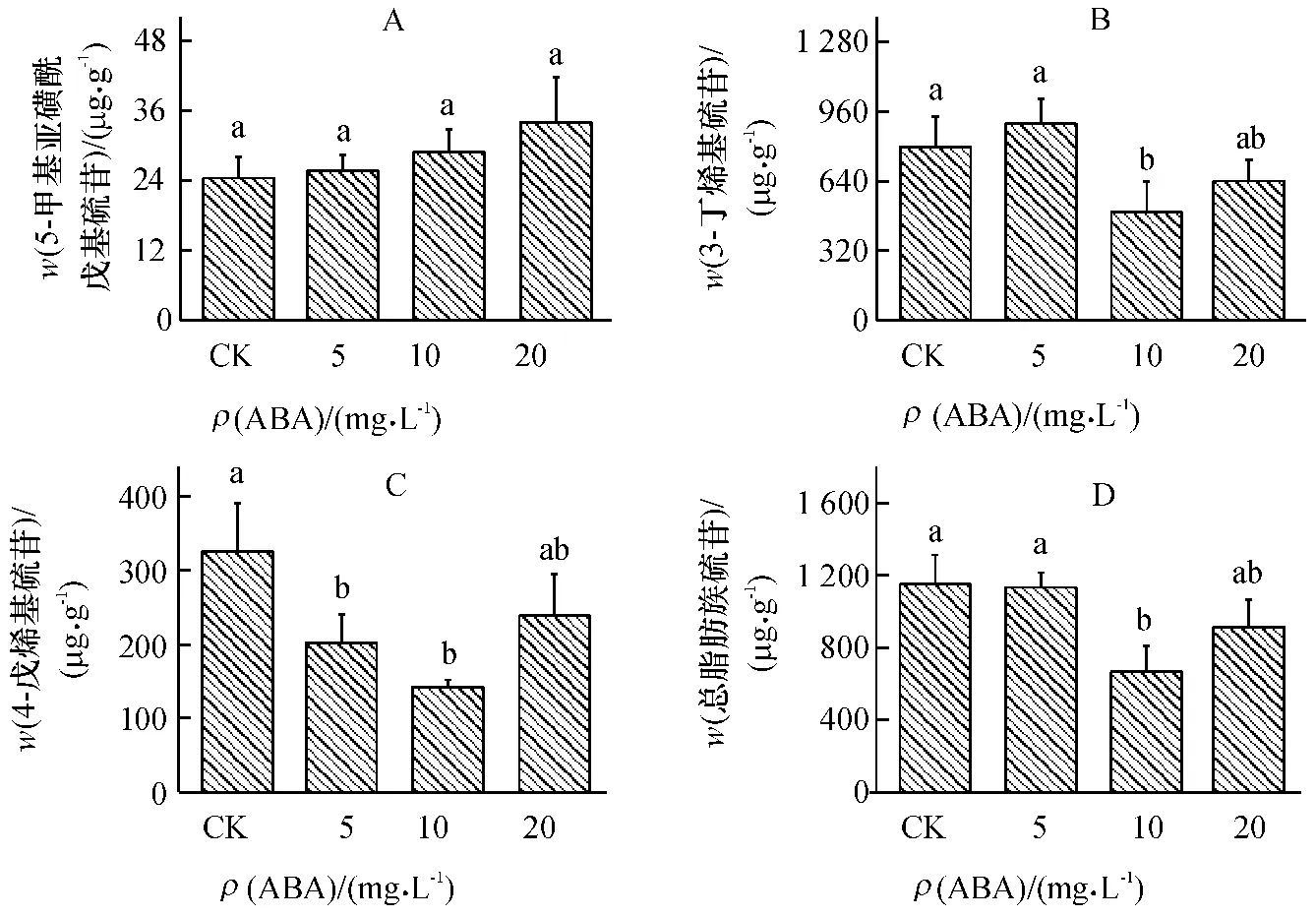
图2 不同质量浓度ABA 处理对小白菜地上部(干品)脂肪族硫苷含量的影响Fig.2 Effects of ABA with different concentrations on contents aliphatic glucosinolates
2.3 ABA 处理对小白菜地上部吲哚族硫苷含量的影响
与对照相比,ABA 质量浓度增加对吲哚-3-甲基硫苷含量没有显著的影响(图3A).在低质量浓度ABA(5 mg·L-1)处理时4-甲氧基吲哚-3-甲基硫苷含量无显著变化,但随ABA 质量浓度增加,4-甲氧基吲哚-3-甲基硫苷含量呈递减趋势(图3B).1-甲氧基吲哚-3-甲基硫苷含量随ABA 质量浓度的增加有先升高后下降的趋势,10 mg·L-1处理时达到最高值,比对照增加62%(图3C).总吲哚族硫苷含量随ABA 质量浓度增加,也呈先升后降的趋势,在ABA 质量浓度为10 mg·L-1时其含量达到最高,但在低质量浓度(5 mg·L-1)与较高质量浓度(10 mg·L-1)处理之间没有显著差异(图3D).可见,ABA 处理对多数吲哚族硫苷含量有一定的浓度效应.
2.4 ABA 处理对小白菜地上部芳香族硫苷含量的影响
如图4 所示,与对照相比,5 和10 mg·L-1ABA处理对芳香族硫苷/2-苯乙基硫苷含量没有显著影响.但较高质量浓度(20 mg·L-1)ABA 处理能够显著诱导2-苯乙基硫苷的合成,其含量比对照增加了143%.
2.5 ABA 处理对小白菜地上部总硫苷含量的影响
从图5 可知,与对照相比,在较低质量浓度(5 mg·L-1)ABA 处理下,总硫苷含量没有显著的变化.但随着ABA 质量浓度的增加,总硫苷含量显著降低,尤其在10 mg·L-1的ABA 处理下,总硫苷含量达到最低值,比对照减少30%.说明在试验所设置的浓度范围内,ABA 处理并不能提高小白菜总硫苷含量,在较高浓度下反而降低了总硫苷含量.
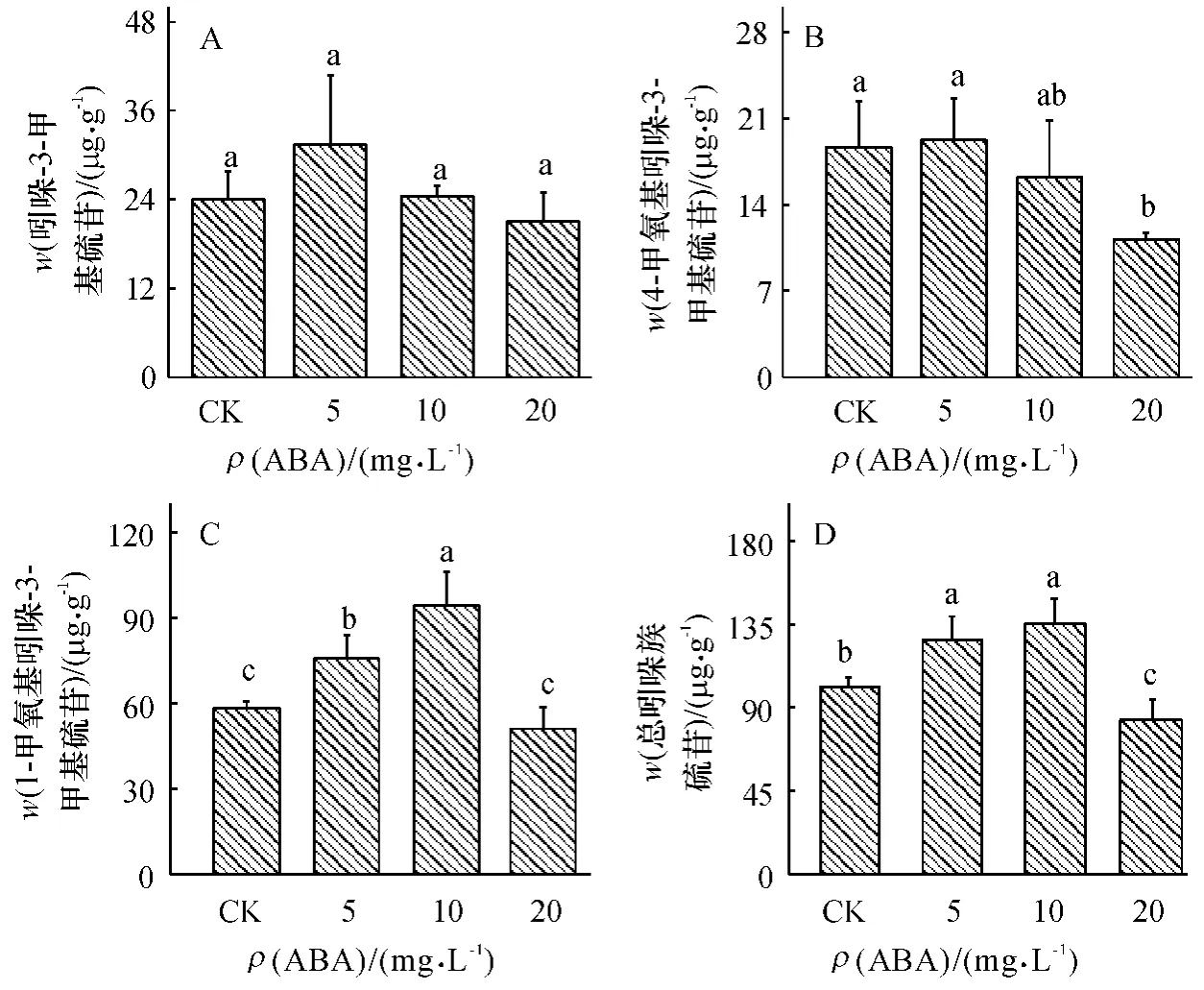
图3 不同质量浓度ABA 处理对小白菜地上部(干品)吲哚族硫苷含量的影响Fig.3 Effects of ABA with different concentrations on indole glucosinolate content in pakchoi shoots
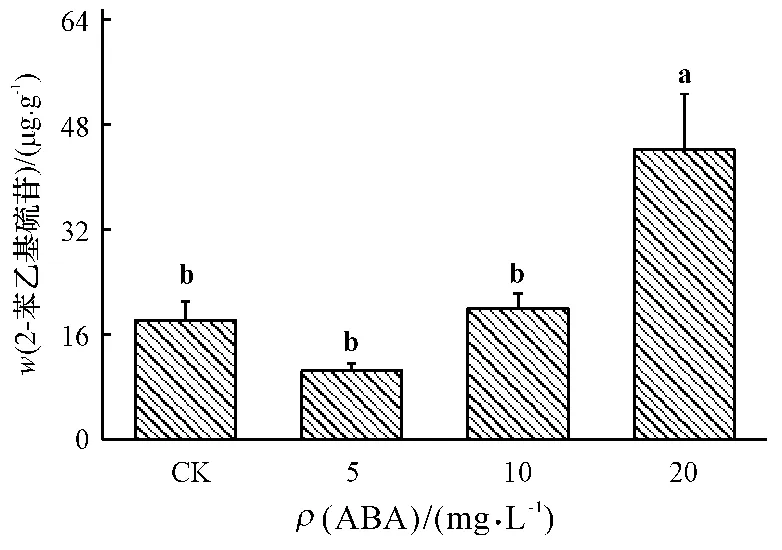
图4 不同质量浓度ABA 处理对小白菜地上部(干品)芳香族硫苷/2-苯乙基硫苷含量的影响Fig.4 Effects of ABA with different concentrations on the content of aromatic/gluconasturtin glucosinolates
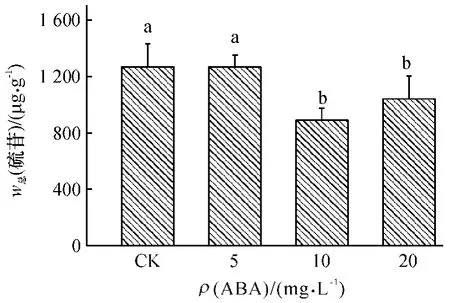
图5 不同质量浓度ABA 处理对小白菜地上部(干品)总硫苷含量的影响Fig.5 Effects of ABA with different concentrations on total glucosinolate content in pakchoi shoots
2.6 ABA 处理对小白菜地上部3 类硫苷相对百分含量的影响
总脂肪族硫苷、吲哚族硫苷和芳香族硫苷占总硫苷比例如图6 所示.ABA 处理对总脂肪族硫苷相对百分含量影响不大,仅10 mg·L-1的ABA 使其降低了11%.不同质量浓度ABA 处理下,总吲哚族硫苷相对百分含量呈先增后降趋势,在10 mg·L-1时吲哚族硫苷的相对百分含量达到最高,比对照增加109%,这可能与此时脂肪族硫苷相对百分含量减少有关.在5 mg·L-1的ABA 处理时,芳香族硫苷相对百分含量所占比例有所下降,但随ABA 质量浓度的增加又显著提高,在20 mg·L-1的ABA 处理时,比对照增加195%.
2.7 ABA 处理对小白菜地上部单个硫苷相对百分含量的影响
不同质量浓度ABA 处理对小白菜7 种单个硫苷占总硫苷比例的影响见表1.较低质量浓度(5 mg·L-1)ABA 处理时,5-甲基亚磺酰戊基硫苷相对百分含量并没有明显的变化,但较高质量浓度(10 和20 mg·L-1)ABA 处理时,5-甲基亚磺酰戊基硫苷相对百分含量显著增加.3-丁烯基硫苷是小白菜地上部最主要的硫苷,不同浓度ABA 处理下其相对百分含量没有显著变化.然而,4-戊烯基硫苷相对百分含量有下降的趋势,尤其在5 mg·L-1的ABA 处理时显著降低了4-戊烯基硫苷相对百分含量,与对照相比减少了37%.
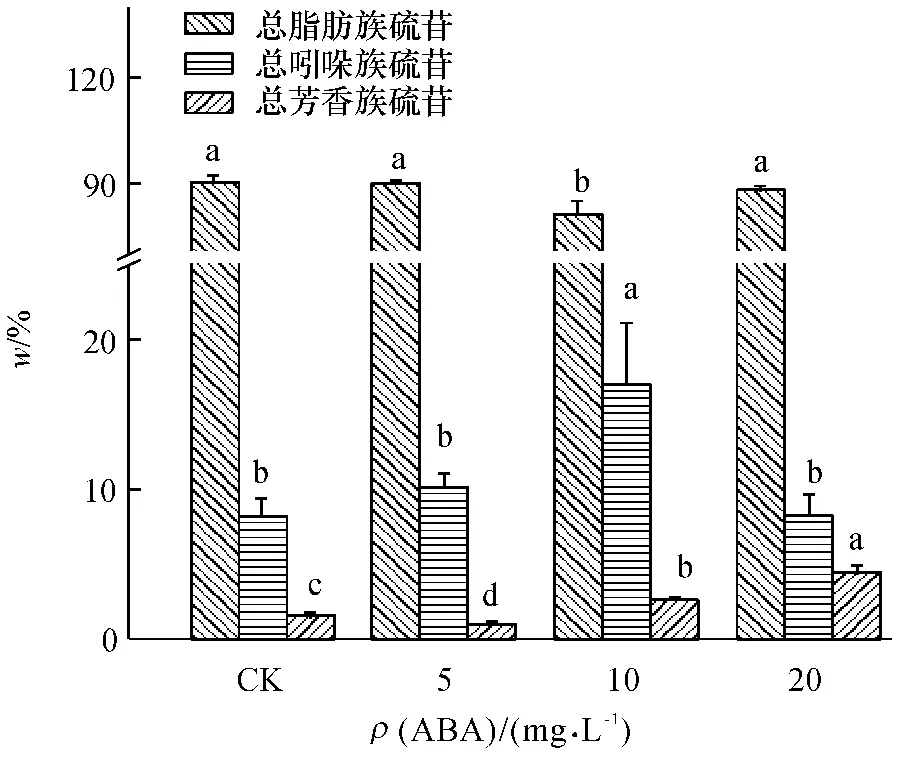
图6 不同质量浓度ABA 处理对总脂肪族、总吲哚族和芳香族硫苷相对百分含量的影响Fig.6 Effects of ABA with different concentrations on the composition of glucosinolates
随ABA 处理浓度的增加,吲哚-3-甲基硫苷相对百分含量呈先增加后降低趋势,尤其在10 mg·L-1的ABA 处理时比对照增加57%.4-甲氧基吲哚-3-甲基硫苷相对百分含量在10 mg·L-1ABA 处理时达到最大值,与对照相比增加38%.然而随着ABA处理浓度增加,其相对百分含量迅速降低并低于对照水平.在不同浓度ABA 处理下,1-甲氧基吲哚-3-甲基硫苷相对百分含量变化趋势与4-甲氧基吲哚-3-甲基硫苷相似,在10 mg·L-1的ABA 处理时达到最大值,与对照相比增加了153%,然后迅速降低至与对照水平相当.在5 mg·L-1的ABA 处理时,2-苯乙基硫苷相对百分含量与对照相比降低了42%,但随着ABA 处理浓度增加,2-苯乙基硫苷相对百分含量又迅速升高,并在20 mg·L-1的ABA 处理时达到最大值,比对照增加近2 倍.
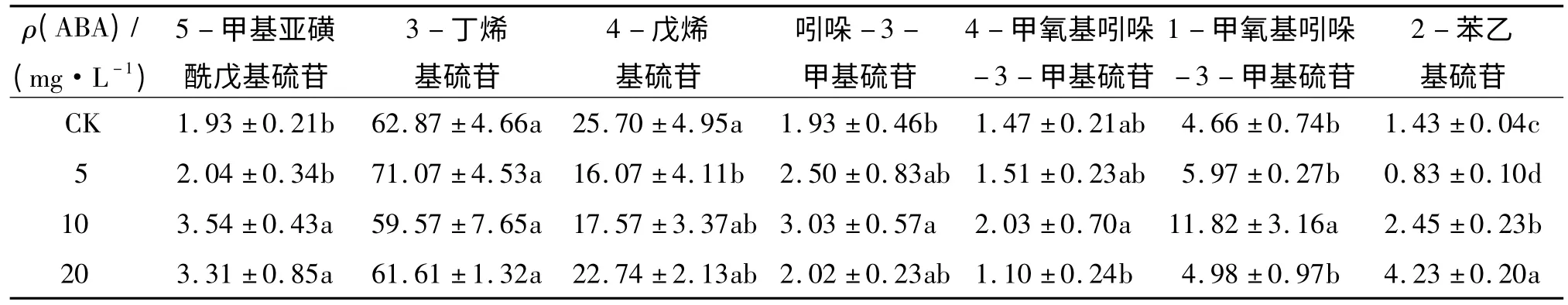
表1 不同质量浓度ABA 处理对小白菜地上部单个硫苷相对总硫苷质量分数的影响1)Tab.1 Effects of ABA treatments on the percentages of individual glucosinolates against total glucosinolate in pakchoi shoots%
3 讨论与结论
Moller 等[8]在油菜Brassica campestris 小孢子培养中发现,外源添加ABA 对烯基脂肪族硫苷含量没有显著影响.在本试验中发现,较低质量浓度(5 mg·L-1)ABA 处理显著降低了4-戊烯基硫苷含量,但对小白菜中另一种烯基硫苷3-丁烯基硫苷含量没有影响.然而,随着ABA 质量浓度的增加,脂肪族硫苷含量除了5-甲基亚磺酰基戊基硫苷以外都呈现下降趋势.由于脂肪族硫苷是小白菜地上部最主要的硫苷,而且下降程度较大,使总硫苷含量有下降的趋势.
较低质量浓度(5 mg·L-1)ABA 处理只显著提高了1-甲氧基吲哚-3-甲基硫苷和总吲哚族硫苷含量.而随ABA 质量浓度增加,4-甲氧基吲哚-3-甲基硫苷含量随ABA 质量增加呈现下降趋势,1-甲氧基吲哚-3-甲基硫苷含量和总吲哚族硫苷含量都呈先增加后降低的趋势.Moller 等[8]发现供应15 μmol·L-1的ABA 减少了吲哚族硫苷含量.然而,Bodnaryk[9]报道外源ABA 对植株吲哚族硫苷含量没有影响.这可能是由于试验作物的不同,但也说明了ABA 对吲哚族硫苷诱导作用具有浓度效应.
脱落酸与茉莉酸在结构上有相似之处,在生理效应上也有许多相似的地方,如促进气孔关闭、叶片脱落等[4].研究发现,茉莉酸能显著诱导吲哚族硫苷的合成[10].另外,Doughty 等[4]报道用不同浓度茉莉酸甲酯处理油菜,显著诱导了吲哚族硫苷的累积,并且对1-甲氧基吲哚-3-甲基硫苷含量的影响比对吲哚-3-甲基硫苷含量的影响更明显.与此结果类似,本试验也发现不同质量浓度ABA 处理提高了吲哚族硫苷的含量.10 mg·L-1的ABA 处理使总吲哚族硫苷和1-甲氧基吲哚-3-甲基硫苷含量显著提高,对吲哚-3-甲基硫苷含量则没有显著影响.而ABA 处理对单个吲哚族硫苷具有的这种选择性累积效应类似于机械伤害或油菜蓝跳甲Altica cyanea 的噬咬[11-12].这些信号物质选择性诱导单个吲哚硫苷的累积,也说明了这些硫苷具有不同的调控途径.
2-苯乙基硫苷的水解产物是苯乙基异硫腈酸酯,被认为具有降低致癌物质活性的作用.外源水杨酸处理油菜,显著诱导了2-苯乙基硫苷的合成[13].Smetanska 等[14]在芜菁Brassica rapa 中报道外源供应水杨酸和茉莉酸均显著诱导了2-苯乙基硫苷含量的提高.这是由于水杨酸和茉莉酸诱导了控制2-苯乙基硫苷合成基因CYP79A2 的表达[10].本试验中,20 mg·L-1的ABA 处理显著诱导了2-苯乙基硫苷的合成.ABA 在植物防御反应中可能是独立的信号分子,也可能通过与水杨酸、茉莉酸和乙烯所调控的生物胁迫信号传导途径互作,共同调控植物的防御信号[15].
ABA 对植物防御的调控较复杂,既有正向调控,也有负向调控,对小白菜3 类硫苷有不同的调控作用.ABA 对小白菜脂肪族硫苷含量为负调控作用,但对吲哚族硫苷和芳香族硫苷含量具有正向调控的作用,并具有一定的浓度效应.
[1]VERHOEVEN D T,VERHAGEN H,GOLDBOHM R A,et al.A review of mechanisms underlying anticarcinogenicity by brassica vegetables[J].Chem-biol interact,1997,103(2):79-129.
[2]HALKIER B A,GERSHENZON J.Biology and biochemistry of glucosinolates[J].Annu Rev Plant Biol,2006,57:303-333.
[3]HU Keling,ZHU Zhujun,ZANG Yunxiang,et al.Accumulation of glucosinolates and nutrients in pakchoi (Brassica campestris L.ssp.chinensis var.communis)two cultivar plants exposed to sulfur deficiency[J].Hortic,Environ Biotechnol,2011,52(2):121-127.
[4]DOUGHTY K J,KIDDLE G A,PYE B J,et al.Selective induction of glucosinolates in oilseed rape leaves with methyl jasmonate[J].Phytochemistry,1995,38(2):347-350.
[5]FUJITA M,FUJITA Y,NOUTOSHI Y,et al.Crosstalk between abiotic and biotic stress responses:A current view from the points of convergence in the stress signaling networks[J].Curr Opin Plant Biol,2006,9(4):436-442.
[6]KRUMBEIN A,SCHONHOF I,SCHREINER M.Composition and contents of phytochemicals(glucosinolates,carotenoids and chlorophylls)and ascorbic acid in selected Brassica species(B.juncea,B.rapa subsp.nipposinica var.chinoleifera,B.rapa subsp.chinensis and B.rapa subsp.rapa)[J].J Appl Bot Food Qual,2005,79(3):168-174.
[7]陈新娟,朱祝军,钱琼秋,等.硫苷的提取、分离和鉴定[J].中国食品学报,2007,7(3):43-48.
[8]MOLLER S C,NEHLIN L,GLIMELIUS K,et al.Influence of in vitro culture conditions on glucosinolate composition of microspore-derived embryos of Brassica napus[J].Physiol Plantarum,1999,107(4):441-446.
[9]BODNARYK R P.Potent effect of jasmonates on indole glucosinolates in oilseed rape and mustard[J].Phytochemistry,1994,35(2):301-305.
[10]MIKKELSEN M D,PETERSEN B L,GLAWISCHNIG E,et al.Modulation of CYP79 Genes and Glucosinolate Profiles in Arabidopsis by Defense Signaling Pathways[J].Plant Physiol,2003,131(1):298-308.
[11]KORITSAS V M,LEWIS J A,FENWICK G R.Glucosinolate responses of oilseed rape,mustard and kale to mechanical wounding and infestation by cabbage stem flea beetle (Psylliodes chrysocephala)[J].Ann Appl Biol,1991,118(1):209-221.
[12]BODNARYK R P.Effects of wounding on glucosinolates in the cotyledons of oilseed rape and mustard[J].Phytochemistry,1992,31(8):2671-267.
[13]KIDDLE G A,DOUGHTY K J,WALLSGROVE R M.Salicylic acid-induced accumulation of glucosinolates in oilseed rape (Brassica napus)leaves[J].J Exp Bot,1994,45(9):1343-1346.
[14]SMETANSKA B I,KRUMBEIN A,SCHREINER M,et al.Influence of salicylic acid and methyl jasmonate on glucosinolate levels in turnip[J].J Hortic Sci Biotech,2007,82(5):690-694.
[15]BARI R,JONES J D G.Role of plant hormones in plant defence responses[J].Plant Mol Biol,2009,69(4):473-488.

