小白菜不同叶期及不同叶位硫苷的质量摩尔浓度
马永华,陈文妃,陈凌云,韦俊涛,郁有健,朱祝军,2
(1.浙江农林大学 农业与食品科学学院,浙江 杭州 311300;2.浙江农林大学 浙江省农产品品质改良技术研究重点实验室,浙江 杭州311300)
硫代葡萄糖苷(glucosinolates,GS)又称芥子油苷,是一类富含氮、硫的植物次级代谢产物,主要存在于十字花科Cruciferae植物中[1]。它在植物的生长和发育过程中发挥着重要作用,硫苷及其水解产物有着非常活跃的生物学活性,主要包括参与植物的防御反应、赋予植物不同的风味、抗癌、抗营养作用等[2]。尽管所有十字花科植物均能合成硫苷,但不同品种之间硫苷种类和含量各不相同,其含量随生长阶段而改变[3],且受到诸多因素影响,如日照长短、损伤、病害等[4]。有关研究表明,油菜Brassica napus开花数天后不同器官硫苷含量起伏较大,均未表现出稳定的变化趋势[5]。宋志荣等[6]研究发现:甘蓝型油菜不同品种硫苷含量变化趋势不一致,高硫苷品种苗期叶片含量最高,从苗期到盛花期呈现下降趋势,低硫苷品种硫苷含量从苗期到盛花期上下波动。李培武等[7]研究证实,在不同甘蓝型油菜的不同生长期,硫苷含量差异显著,且与时间的变化趋势不一致。硫苷的生物学活性研究已较清晰,但对于小白菜Brassica rapassp.chinensis生长过程中硫苷组分和含量变化的研究相对较少。由于植物在生长过程中,硫苷含量受合成、运输和代谢等多方面的影响,不同种类的硫苷在植物防御体系中发挥的作用不尽相同。本试验研究了小白菜不同生长期和同时期不同叶位硫苷组分和含量变化,以期探究硫苷在小白菜中的分布,为硫苷在植物抗逆性方面的运用提供参考。
1 材料与方法
1.1 试验与处理
供试材料为小白菜 ‘黑油冬’ ‘Heiyoudong’(购于上海菲托种子有限公司)。试验于 “GXZ-500D型”智能光照培养箱内(购于宁波江南仪器厂),昼夜温度设置为(27±1)℃,光照强度3万 lx,日照长度为14 h,将种子播于5×10装有基质的穴盘中,待幼苗长到四叶一心时,选取长势一致的幼苗移至上口径11 cm的育苗盆中。分别在四叶期、八叶期和十二叶期以及八叶期的不同叶位,选取完好无损的叶片进行取样,去除主脉剪碎后液氮速冻,于-80℃冰箱中保存,每个叶期设3个重复。
1.2 仪器与方法
真空冷冻干燥机(1-16LSC,CHRIST),固相萃取仪(ASE-12,天津奥特赛恩斯仪器有限公司),高效液相色谱仪(1200,安捷伦)等。参考KRUMBEIN等[8]和ZHU等[9]的方法并加以改进。将上述样品置于冻干机内冻干72 h,完全去除组织水分后,用磨粉机将其磨成粉末并置于塑封袋内保存,在磨粉过程中务必将空调开启除湿模式,以防止样品受潮。
1.3 数据分析
实验结果采用Excel 2007软件进行数据整理,采用邓肯新复极差法测验(Duncan’s ANOVA),在5%水平进行差异显著性分析。
2 结果与分析
2.1 不同叶期的硫苷质量摩尔浓度
图1表明了 ‘黑油冬’在不同时期总硫苷、脂肪族硫苷、芳香族硫苷和吲哚族硫苷质量摩尔浓度的变化。在四叶期、八叶期和十二叶期,叶片硫苷质量摩尔浓度不同。从四叶期到八叶期,硫苷质量摩尔浓度呈显著上升趋势(P<0.05),在八叶期达到峰值,而在十二叶期有所下降。其中,脂肪族硫苷质量摩尔浓度随着叶期的生长呈现逐渐的下降趋势,在十二叶期时达到最低。吲哚族硫苷和芳香族硫苷质量摩尔浓度的变化趋势与总硫苷的变化趋势一致,八叶期时最高,四叶期和十二叶期较低。另外,在不同时期脂肪族硫苷、芳香族硫苷和吲哚族硫苷占总硫苷的比例不同。四叶期时,脂肪族硫苷的占比最高,约占总硫苷的65%;八叶期时,吲哚族硫苷占比最大,占总硫苷的48%;十二叶期脂肪族硫苷与吲哚族硫苷的质量摩尔浓度相当。在3个时期中,芳香族硫苷所占比例最低。

图1 不同时期总硫苷和各类硫苷的质量摩尔浓度Figure 1 Content of total glucosinolates and various types of glucosinolates in different periods
2.2 不同叶位硫苷质量摩尔浓度
‘黑油冬’小白菜在八叶期时硫苷质量摩尔浓度最高,因此选取了八叶期对其进行不同叶位硫苷质量摩尔浓度的分析。根据叶龄大小从上叶位到下叶位依次命名为Y1,Y2,Y3,Y4,Y5,Y6和Y7,叶片长度小于5 cm的统称为Y0(菜心)。由图2可见:随着叶位的升高,硫苷质量摩尔浓度呈现逐渐的上升趋势。Y7,Y6和Y5叶位之间,硫苷质量摩尔浓度有所上升但差异不显著 (P>0.05),Y4和Y3叶位较下叶位硫苷质量摩尔浓度呈现显著升高趋势(P<0.05),但Y4和Y3之间硫苷质量摩尔浓度差异不显著(P>0.05),其质量摩尔浓度分别为0.57和0.73 μmol·g-1。越靠近菜心部位硫苷升高的幅度越大,Y3,Y2和Y1叶位硫苷质量摩尔浓度都较其下叶位呈现显著的上升趋势(P<0.05),其中菜心部位的硫苷质量摩尔浓度高达4.35 μmol·g-1。脂肪族硫苷在不同叶位的变化趋势与总硫苷的变化趋势一致,其质量摩尔浓度由下叶位至上叶位逐渐上升,在菜心部位达到最高,为2.55 μmol·g-1,而吲哚族硫苷质量摩尔浓度随着叶位上升呈现先下降后上升的趋势,在Y5叶位最低,仅为0.08 μmol·g-1,菜心部位达到最高,为1.60 μmol·g-1。芳香族硫苷的质量摩尔浓度相对较低,且在Y4,Y5,Y6和Y7叶位没有检测到该类硫苷的存在。其他叶位芳香族硫苷的变化与总硫苷的变化趋势一致,菜心部位达到最高的0.19 μmol·g-1。在占比方面,吲哚族硫苷在Y7叶位所占比例最高,约为总硫苷的56.7%,其他叶位则以脂肪族硫苷为主,占比59.0%~79.0%,芳香族硫苷在所有叶位中质量摩尔浓度较低,所占比例低于7.1%。
3 讨论
BROWN等[10]从拟南芥Arabidopsis thaliana生长周期的不同阶段发现,不同器官的硫代葡萄糖苷质量摩尔浓度和种类存在显著差异。休眠和已发芽种子硫苷质量摩尔浓度最高,其次为花序、长角果(果实)、根、茎和叶[11]。虽然脂肪族硫苷质量摩尔浓度在大多数植物器官中占主导地位,但吲哚族硫苷质量摩尔浓度在根部和莲座叶末期占总硫苷质量摩尔浓度的近一半。在拟南芥中,GTR1和GTR2参与脂肪族硫苷而不是吲哚族硫苷的双向长距离转运,莲座叶期叶片是短链脂肪族硫苷主要的来源和储存位置,根部和叶片合成的长链脂肪族硫苷主要运输到根部储存[12]。
本研究发现: ‘黑油冬’在不同叶期叶片硫苷质量摩尔浓度由四叶期到八叶期上升,十二叶期下降的变化趋势,这与前人的研究结果[13]基本一致,不同的是脂肪族硫苷的变化趋势和其所占总硫苷的比例有所差异,可能是由于培养条件的不同所致。表明 ‘黑油冬’叶片在不同生长期的硫苷质量摩尔浓度变化较大。一般来说,硫苷在植物体内是不断积累的,而十二叶期硫苷质量摩尔浓度下降可能是因为硫苷的积累速率远不及植物的生长速率,从而表现为单位质量的降低[10],也可能是由于随着植株的生长,叶片新合成的硫苷被运输到植物的茎和根部等器官所致[12],由此在叶片中形成硫苷的动态平衡。脂肪族硫苷在叶片中占主要地位,其质量摩尔浓度随叶期增加而逐渐降低,可能是转运蛋白GTR1和GTR2参与长链脂肪族硫苷的长距离运输,将其运输到根部所致[12,14]。
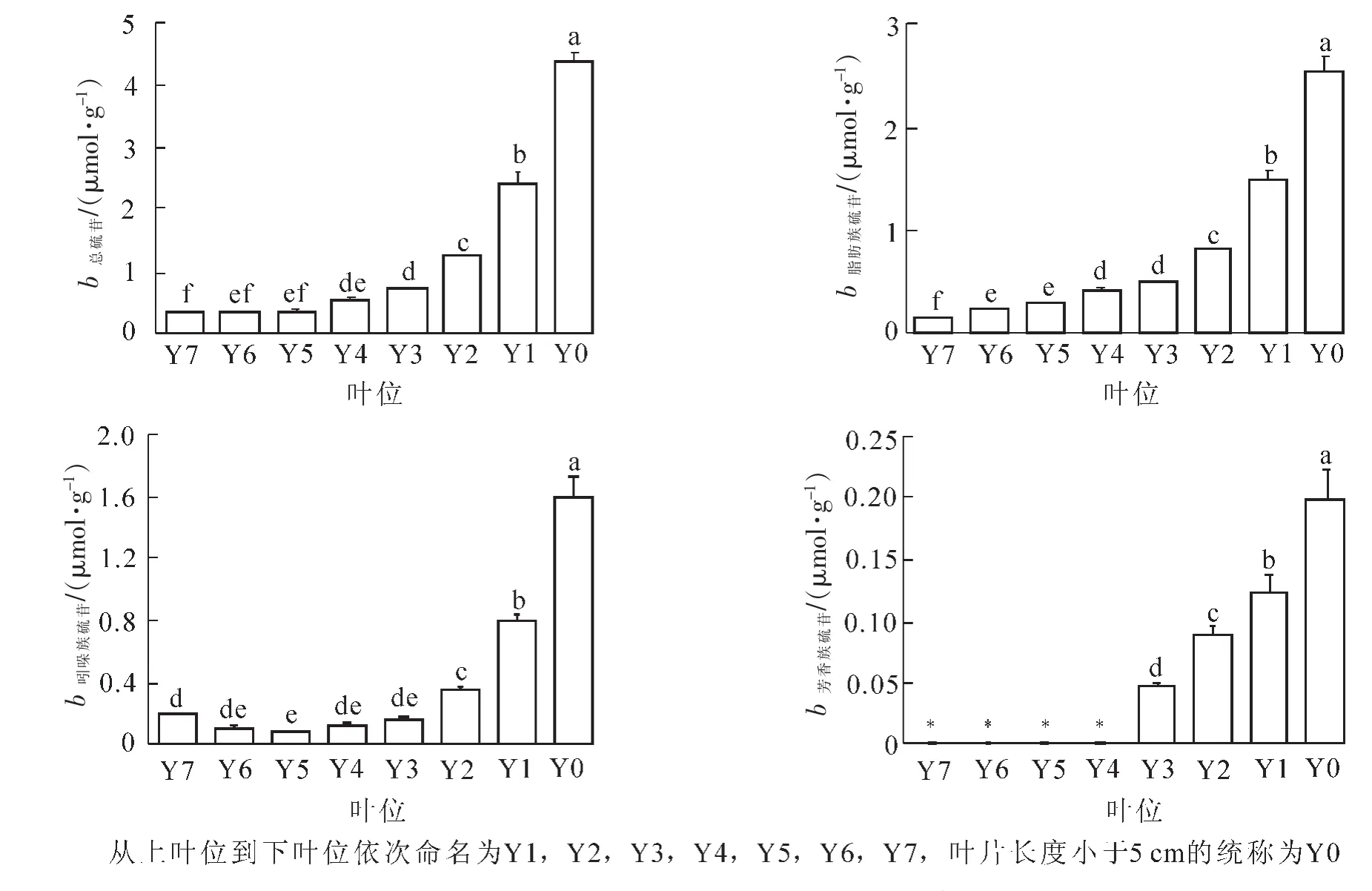
图2 不同叶位总硫苷和各类硫苷的质量摩尔浓度Figure 2 Contents of total glucosinolates and various types of glucosinolates in different leaves
从发育的角度来看,拟南芥幼嫩的莲座叶通常比老叶硫苷质量摩尔浓度更高,这是因为早期生长的叶片在其生长过程中每克干物质增加的硫苷累积量低[10]。莲座叶期叶片在叶片扩张时硫苷质量摩尔浓度相对稳定。在种子发芽和叶片衰老期间,硫苷质量摩尔浓度显著下降[15]。EAS等[16]的研究表明:甘蓝结球部位的硫苷质量摩尔浓度显著高于外部叶片。本试验发现 ‘黑油冬’不同叶位硫苷质量摩尔浓度的变化,内部叶片较外部叶片具有更高的硫苷质量摩尔浓度,Y4和Y3叶位硫苷变化不大,衰老叶片硫苷质量摩尔浓度最低,这与前人的研究结果[10,15]相一致。陈新娟[17]在小白菜不同叶位中硫苷质量摩尔浓度的研究发现,叶片膨大期硫苷质量摩尔浓度最高。在露地栽培条件下,环境中的病虫害会显著增加硫苷质量摩尔浓度[18-19]。
硫苷在病虫害防御中发挥重要作用,在植物中的分布并不均匀。在叶片中,硫苷的分布主要位于植物易受攻击的位置,如叶表面或叶缘部[20]。小白菜同一时期不同叶位之间的硫苷质量摩尔浓度存在显著差异,说明植物为适应环境有选择性地将硫苷分配至植株的重要部位,同时将衰老叶片中的硫苷运送到其他组织器官,使植物的防御能力达到最优,这是由植株特有的生理及防御机制决定的。通常情况下,硫苷分布在植物整个发育过程中所有的营养和生殖器官中。研究小白菜不同时期以及不同叶位的硫苷质量摩尔浓度变化规律,有助于探究硫苷在小白菜中的分布以及明确硫苷在小白菜中的代谢机理。

