气道喷雾博来霉素建立特发性肺纤维化模型的研究
王聪 朱绘明 钱卫平 韩晓冬
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是一种病因不明,以弥漫性肺泡炎、肺泡结构紊乱,最终肺间质纤维化为特征的疾病,发病人群主要为老年人[1],是老年人慢性咳嗽的主要发病原因[2]。其临床表现为进行性呼吸困难,限制性通气障碍,最终呼吸衰竭导致死亡。目前临床上治疗效果差,治愈率低,5 年生存率只有30% ~50%[3]。为了更好地探究IPF的发病机制,需要建立与人类IPF 发展进程相似的动物模型,模拟人类IPF 发生过程中的发病特点。博莱霉素所致大鼠IPF 模型是目前公认的最接近人类病理变化的模型,许多研究中采用该模型来评价各种治疗肺纤维化方法的疗效。但既往的造模基本都是采用气道滴入的方式给药,药物在肺内分布不均,影响实验的重复性。本实验采用美国PENN-CENTURY 公司生产的雾化器通过气管插管给予实验鼠博来霉素,建立IPF 动物模型,药物在肺内分布更均匀,形成的纤维灶更均一。通过病理切片观察,胶原染色、血气分析、特异蛋白检测等方法,探讨IPF 的病理进程。
1 材料和方法
1.1 实验动物 SD 雄性大鼠80 只,体质量180 ~200 g,平均(192.0 ±7.6)g,8 周龄,由南京市江宁区青龙山动物繁殖场提供。所有操作和实验流程均遵守《实验动物管理条例》。
1.2 2 种方法伊文斯兰染液分布的比较 经气管分别采用滴入或雾化向大鼠肺内注入伊文斯兰染液,给药5 min 后断颈处死大鼠,取其全肺,在PBS 中漂洗后放在滤纸上吸干表面液体,剥离肺周围脂肪组织,观察伊文斯兰染液在肺组织中的分布[4]。
1.3 实验分组 实验动物随机分为2 组:模型组(40只)和对照组(40 只)。模型组按5 mg/kg 气道给予博来霉素;对照组给予生理盐水。
1.4 主要试剂与设备 盐酸博来霉素(天津太河制药有限公司);MicroSprayereTM雾化器(美国PENN-CENTURY);Tissue-Tek DRSTMHE 染色系统(SAKURA 公司生产);羟脯氨酸检测试剂盒(南京建成生物工程研究所);Masson 染色试剂盒(南京建成生物工程研究所);动脉采血器(BD 公司生产);i-STAT 血气分析仪;i-STAT G3+血气分析卡片;兔抗鼠波形蛋白(vimentin),兔抗鼠α-SMA,兔抗鼠E-钙黏素,(一抗均为abcam 公司生产),HRP 标记羊抗兔IgG 抗体(南京生兴生物技术有限公司)。
1.5 建造IPF 大鼠模型
1.5.1 麻醉、固定:大鼠腹腔注射2%戊巴比妥钠(3 ml/kg)麻醉后仰面固定在60°倾斜鼠板上。
1.5.2 给药:将光源直接照射于大鼠咽喉部皮肤表面,左手垫纱布向外向上提起舌头,可见会厌,将雾化器的喷雾头置于舌根与会厌的交界处,暴露声门,将喷雾头经声门裂轻轻插入气管内,立即雾化给药博来霉素(5 mg/kg)予模型组,对照组用同样方法给予生理盐水。动物清醒后随意进食。
1.5.3 标本采集:2 组分别于第7、14、21、28 天4 个时间点使用一次性动脉采血针采集腹主动脉血样进行血气分析;取血后断颈处死动物,剖开胸腔,取下肺叶。
1.5.4 标本处理:取右肺下叶于4%多聚甲醛中固定24 h,连续石蜡切片,做HE 染色和Masson 染色,取右肺上叶进行羟脯氨酸含量测定,随机取右肺中叶提取蛋白,进行Western blot 检测。左叶肺组织放于-80 ℃冰箱待用。
1.6 统计学分析 统计数据应用SPSS 15.0 统计软件,统计结果用(±s)表示,2 组间均数比较用t 检验;多组间均数比较采用单因素方差分析。P <0.05 为差异有统计学意义。
2 结果
2.1 伊文斯兰染液在肺内的分布 伊文斯兰能将组织染成蓝色,以伊文斯兰作为指示剂,观察博来霉素在肺中的分布。通过观察,经气管滴入的伊文斯兰在肺内分布不均,呈块状分布,集中在肺内个别区域,各个肺叶之间差别明显,有的全肺叶被染成蓝色,有的肺叶没有被染色(图1 A);经雾化的伊文斯兰在肺内分布均匀,在肺叶中呈点状分布(图1 B)。

图1 气管内滴入(A)与气管内雾化(B)伊文斯兰溶液在肺组织内的分布
2.2 实验鼠生活状态的观察 对照组大鼠皮毛较光亮,行动敏捷、活泼,呼吸平稳,正常饮食,体质量逐渐增加,无死亡。模型组大鼠皮毛较暗淡,在给予博来霉素的前5 d,活动较少,反应迟钝,呼吸急促,常伴有咳嗽,在第3 天,模型组出现2 只鼠死亡,第4 天,有1 只死亡,在第5 天后模型组大鼠逐渐恢复,体质量增加,但相对于对照组增长较慢。剩余大鼠随机在各时间点分别处死观察。
2.3 肉眼观察肺组织外观形态改变 对照组大鼠双肺未见明显病变,呈淡红色,表面光滑,弹性良好,未见出血点。第7 天时,肺纤维化模型大鼠肺组织明显增大,颜色鲜红,并见肺组织轻度充血,表面出血点增加;第14 天双肺体积缩小,局部见大小不等结节样改变,仍有陈旧出血点。第21 天和第28 天,模型组表现双肺体积逐渐缩小,肺组织弹性减弱,颜色变浅,表面可见小片状、条索状凹凸不平的苍白灶。
2.4 组织学的改变 HE 染色:对照组未出现病理变化,肺内组织结构清晰,肺泡间隔未见增厚,无炎症和纤维化表现(图2A);模型组第7 天肺泡间隔轻度增厚,炎性细胞浸润,肺泡腔内有大量巨噬细胞和中性粒细胞,肺内结构开始紊乱(图2B);第14 天时,肺泡炎症有所减轻,肺泡间隔明显增厚,开始出现纤维化(图
2.5 羟脯氨酸含量测定 羟脯氨酸为胶原的特异组成成分,通过测定羟脯氨酸的含量可以间接反映组织2C);给药21 d 和28 d 后纤维化现象严重,纤维细胞聚集形成纤维灶,弥漫分布在肺组织中(图2D、E)。
Masson 染色:采用Masson 染色试剂盒可以将组织中的胶原特异性染为蓝色。结果发现,对照组在支气管壁上有较少的胶原,肺泡壁薄,有细小的胶原散在分布(图3A);模型组第7 天气管周围和增厚的肺泡壁中开始有胶原堆积,但没有形成片状(图3B);第14 天,气管周围胶原明显增多,肺间质中胶原有片状的分布(图3C);第21 天和28 天时,肺组织中胶原含量最多,弥漫呈束状分布在肺间质中(图3D、E)。中胶原的沉积情况。结果发现,各时间点模型组与对照组相比羟脯氨酸含量都有所增加,第7 天模型组羟脯氨酸含量与对照组相比,差异无统计学意义(P >0.05),第14、21、28 天模型组羟脯氨酸含量与对照组相比升高显著(P <0.05)。对照组各时间点之间差异无统计学意义(P >0.05)。见表1。
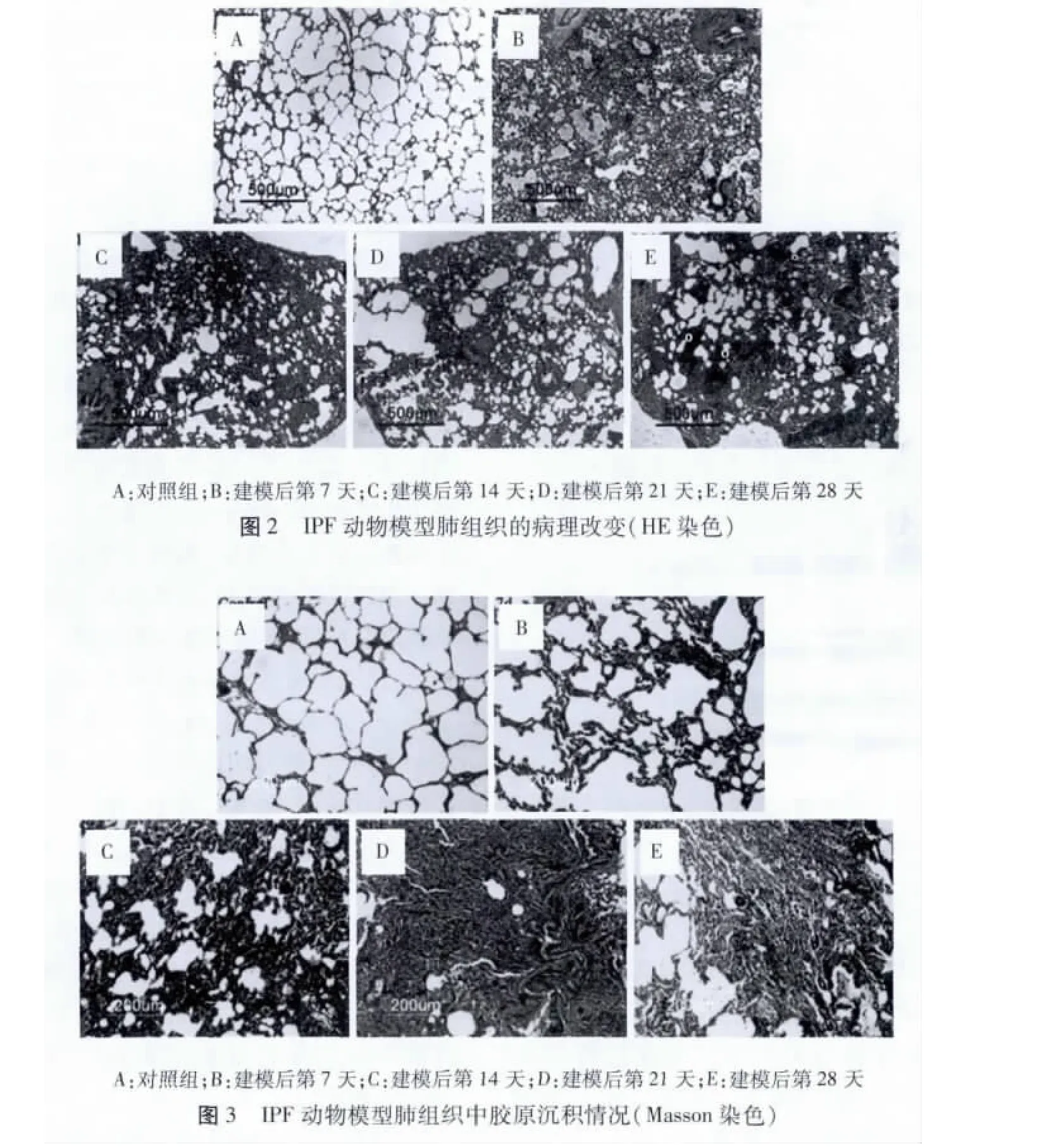
表1 IPF 动物模型组中羟脯氨酸含量的测定(±s,μg/g,n=40)

表1 IPF 动物模型组中羟脯氨酸含量的测定(±s,μg/g,n=40)
注:与对照组比较,* P <0.05,**P <0.01
组别第7 天第14 天第21 天第28天对照组680.7 ±106.4655.0 ±54.7673.3 ±45.0677.3 ±89.5模型组743.7 ±135.4789.3 ±27.6*1095.0 ±36.2**934.3 ±95.9*
2.6 血气分析 各时间点模型组与对照组相比血氧分压都有所下降,第7、14、21 天模型组血氧分压与对照组相比降低显著(P <0.05),第28 天模型组血氧分压与对照组相比下降差异无统计学意义(P =0.251)。对照组各时间点之间差别无统计学意义(P >0.05)。见表2。
表2 IPF 动物模型组动脉血中氧分压的测定(±s,mmHg,n=40)

表2 IPF 动物模型组动脉血中氧分压的测定(±s,mmHg,n=40)
注:与对照组比较,* P <0.05,**P <0.01
组别第7 天第14 天第21 天第28天85.7 ±3.181.7 ±4.286.3 ±2.384.3 ±1.2模型组62.0 ±4.2**63.3 ±11.4*68.7 ±7.5*对照组69.8 ±20.5
2.7 E-钙黏素、波形蛋白、α-SMA 蛋白的Western blot 结果比较 与对照组相比,第7、14、28 天模型组肺组织中E-钙黏素的表达量逐渐降低,成纤维细胞标记波形蛋白的表达量逐渐升高,肌成纤维细胞标记α-SMA 的表达量在第14 天和第28 天模型组中也明显升高,提示动物模型肺纤维化逐渐严重。见图4。

图4 IPF 动物模型中E-钙黏素、波形蛋白、α-SMA 在肺组织中的表达情况
3 讨论
3.1 目前国内外学者采用多种方法建立IPF 的动物模型[5-6],博来霉素致IPF 的动物模型虽与人类IPF 有所不同[7],但因其病理过程与人类的纤维化过程很相似[8-9],所以经气管给予博来霉素是目前建立IPF 动物模型的常用方法。不同剂量的博来霉素导致大鼠的肺纤维化程度不同,本实验室在既往研究中发现,低剂量(3.5 mg/kg)的博来霉素导致肺纤维化现象不明显,而高剂量(8 mg/kg)导致大鼠死亡率较高,严重影响实验的继续进行,所以本实验室目前采用较为通用的剂量(5 mg/kg)建造IPF 模型[10]。但使用传统的气管滴入灌注造模的方法容易造成动物窒息死亡,而且博来霉素在肺组织内分布不均匀,导致病灶不均一,不能准确地模拟人类IPF 病变的弥漫性分布,实验结果重复性低,不能满足实验需要[4]。本实验采用美国PENN-CENTURY公司生产的MicroSprayereTM雾化器,通过气管插管实现了单次雾化给药造模,降低了实验鼠的死亡率,并且药物剂量可以准确控制,药物在肺组织内均匀分布,实验结果重复性好,能够满足实验需要。
3.2 博来霉素致大鼠的IPF 过程是随时间而演变的,主要分为早期肺组织损伤和水肿,炎症反应及Ⅱ型上皮细胞增生,随后间质细胞增生,并最终发展为弥漫性的纤维化[11]。在本实验中,肺纤维化模型组在第7 天表现为明显的炎症反应,肺组织中有大量的中性粒细胞浸润;第14 天炎症明显减轻,并有纤维灶开始形成,胶原在气管周围开始累积;第21 天和第28 天,肺组织中弥漫性地分布有纤维灶和肺大泡,胶原含量明显增多,并呈束状分布在肺间质中。模型组羟脯氨酸含量逐渐增多,提示在模型组肺组织中胶原逐渐堆积,纤维化逐渐加重。
3.3 IPF 为肺功能限制性通气障碍,临床动脉血气分析为低氧血症。胶原的异常增生可加重低氧血症,动脉血气分析中氧分压的变化是反映肺生理功能中弥散功能的指标之一。采用BD 公司生产的动脉采血器,能够利用负压采集到实验鼠动脉血,且采血器内自带适量肝素防止凝血。管体具有高致密性,采血结束立即将针头插在绝气橡胶栓上,能够减少渗气,保证采集到血样的准确性。在本实验中,腹主动脉血气分析结果显示,模型组动脉血氧分压与对照组相比均有不同程度的降低,提示模型组的肺功能下降,肺纤维化加重。
3.4 在特定的病理条件下,肺间质内的干细胞和上皮细胞等转化为成纤维母细胞,成纤维母细胞增殖形成成纤维细胞灶,该病灶细胞分泌胶原、纤维蛋白等大量细胞外基质,使肺泡壁增厚,肺泡结构紊乱,导致IPF形成[12]。E-钙黏素是一种介导细胞间同质黏附的钙依赖性跨膜糖蛋白,主要存在于人和动物的上皮细胞中,参与形成和维护正常细胞间的连接,促进上皮细胞间相互黏附,维持组织结构的完整性和上皮极性[13]。研究表明由TGF-β 介导的上皮细胞分化(epithelialmesenchymal-transition,EMT)中,由于严重的间质纤维化和成纤维细胞的增殖,上皮细胞的标记物E-钙黏素表达减少,而间质细胞和成纤维细胞标记波形蛋白表达增加[14]。E-钙黏素表达的减少也提示细胞间黏附减弱,促进了成纤维细胞向损伤部位的迁移。由成纤维细胞转化形成的肌成纤维细胞的标记α-SMA 逐渐增多[15],肌成纤维细胞分泌大量胶原和其他细胞间基质,促进了肺纤维化的进程,但肺纤维化过程中更加全面的机制还有待进一步研究。在本实验中,通过Western bolt 检测到,肺纤维化模型组由于肺泡结构遭到破坏,上皮细胞减少,E-钙黏素的表达逐渐下降,各种细胞间黏附作用减弱;波形蛋白表达升高,提示间质细胞和成纤维细胞逐渐增多;α-SMA 表达升高,提示肌成纤维细胞增生,肺间质中胶原和其他细胞外基质得以进一步积累,促进肺实变的发展。
综上所述,利用美国PENN-CENTURY 公司生产的MicroSprayereTM雾化器经气道对大鼠的肺部进行雾化给予博来霉素建立的IPF 模型,与对照组相比,肺泡结构紊乱,肺实变发生,胶原在肺间质中堆积,动脉血中氧分压下降,肺组织中上皮细胞标记减少,成纤维细胞标记增加。这些特点与人类的IPF 的进程相似。同时,本实验采用气道喷雾的方法,相较于气道滴入的常规方法,该给药方式可使药物在肺组织中分布更为均匀,形成的病灶更加均一。利用此方法建立的动物模型可用于IPF 的研究。
[1] King TE Jr,Pardo A,Selman M. Idiopathic pulmonary fibrosis[J]. Lancet,2011,378(9807):1949-1961.
[2] 赖克方,许丹媛. 老年人慢性咳嗽的诊治[J]. 实用老年医学,2011,25(3):187-189.
[3] Rogliani P,Mura M,Assunta Porretta M,et al. New perspectives in the treatment of idiopathic pulmonary fibrosis[J]. Ther Adv Respir Dis,2008,2(2):75-93.
[4] 李伟峰,胡玉洁,袁伟锋,等. 气管内滴入与雾化博莱霉素致小鼠肺纤维化模型的比较研究[J]. 南方医科大学学报,2012,32(2):221-226.
[5] Matute-Bello G,Frevert CW,Martin TR. Animal models of acute lung injury[J]. Am J Physiol Lung Cell Mol Physiol,2008,293(5):L379-L399.
[6] Moore BB,Hogaboam CM. Murine models of pulmonary fibrosis[J]. Am J Physiol Lung Cell Mol Physiol,2008,294(2):L152-L160.
[7] Peng R,Sridhar S,Tyagi G,et al. Bleomycin induces molecular changes directly relevant to idiopathic pulmonary fibrosis:a model for“active”disease[J]. PLoS One,2013,8(4):e59348.
[8] Moeller A,Ask K,Warburton D,et al. The bleomycin animal model:a useful tool to investigate treatment options for idiopathic pulmonary fibrosis?[J]. Int J Biochem Cell Biol,2008,40(3):362-382.
[9] Chung MP,Monick MM,Hamzeh NY,et al. Role of repeated lung injury and genetic background in bleomycin-induced fibrosis[J]. Am J Respir Cell Mol Biol,2003,29(3 Pt 1):375-380.
[10]Guo H,Ji F,Liu B,et al. Peiminine ameliorates bleomycininduced acute lung injury in rats[J]. Mol Med Rep,2013,7(4):1103-1110.
[11]Cavazza A,Rossi G,Carbonelli C,et al. The role of histology in idiopathic pulmonary fibrosis:an update[J]. Respir Med,2010,104(Suppl 1):S11-S22.
[12] Phan SH. The myofibroblast in pulmonary fibrosis[J].Chest,2002,122(6 Suppl):286S-289S.
[13]Kim KK,Wei Y,Szekeres C,et al. Epithelial cell alpha3beta1 integrin links beta-catenin and Smad signaling to promote myofibroblast formation and pulmonary fibrosis[J]. J Clin Invest,2009,119(1):213-224.
[14] Kalluri R,Neilson EG. Epithelial-mesenchymal transition and its implications for fibrosis[J]. J Clin Invest,2003,112(12):1776-1784.
[15] Yamada M,Kuwano K,Maeyama T,et al. Dual-immunohistochemistry provides little evidence for epithelial-mesenchymal transition in pulmonary fibrosis[J]. Histochem Cell Biol,2008,129(4):453-462.

