日本蟾蜍皮肤胸腺素α 原cDNA 的克隆及序列分析
宋敏国, 袁进强, 杨仙玉, 张姝芳, 诸葛慧, 徐 跃
(浙江农林大学 农业与食品科学学院, 浙江 临安311300)
胸腺素α 原(prothymosin α, ProTα)是一种在哺乳动物细胞中广泛分布、 结构保守的酸性小分子蛋白, 是胸腺素α1(thymosin α1, Tα1)的前体蛋白[1]。 胸腺素α 原在抗肿瘤方面具有显著的作用, 如可降低鼠的膀胱癌发生率[2], 抑制HeLa 细胞凋亡, 诱导巨噬细胞产生干扰素和白介素等[3]。 鉴于蟾酥、 蟾衣、 蟾皮等中药材广泛应用于临床抗肿瘤治疗[4-5], 本研究开展以日本蟾蜍Bufo japonicus formosus 皮肤cDNA 质粒文库为模板, 通过菌落聚合酶链式反应(colony polymerase chain reaction, colony PCR)筛选具有完整开放阅读框(open reading frame, ORF)的全长cDNA 的工作。 本研究筛选到日本蟾蜍ProTα 全长cDNA 序列, 并运用多种软件对其编码的蛋白质进行了生物信息学分析, 构建系统进化树, 为进一步研究日本蟾蜍ProTα 蛋白的功能及其药物研发奠定基础。
1 材料与方法
1.1 主要材料和试剂
日本蟾蜍皮肤cDNA 质粒文库通过材料转让协议, 由日本产业技术总合研究所(AIST, Tsu-kuba, Japan)授权浙江农林大学使用(作者杨仙玉在日本AIST 博士后工作期间制备)。 该文库使用的载体为pSD64TR,上游和下游克隆位点分别为EcoR I 和Xho I, 载体上游和下游引物为SP6(5′-ATTTAGGTGACACTATAGAA-3′)和S.D.A.(5′-TTATGTAGCTTAGAGACTC-3′), cDNA 的长度介于500~2 000 bp。
大肠埃希菌Escherichia coli 感受态细胞DH5α, PCR 反应试剂盒, 2×PCR 混合试剂(master mix)等购自天根生化科技有限公司, DNA 梯状核酸片段(ladder)和质粒小量抽提试剂盒购自碧云天生物技术研究所。 引物合成与DNA 测序委托上海生工生物技术有限公司或上海桑尼生物科技有限公司。
1.2 方法
1.2.1 日本蟾蜍皮肤cDNA 质粒文库转化 将cDNA 质粒文库0.2 μL 电击转化到E. coli DH5α 感受态细胞中(40.0 μL), 然后迅速加入37 ℃预热的160.0 μL LB 培养液, 37 ℃恒温振荡复苏45 min, 取2.0 μL 转化液均匀涂布于LB 平板(含Amp+100 mg·L-1), 并在37 ℃恒温培养12~15 h。
1.2.2 全长cDNA 筛选 从平板上随机挑取单菌落接种于10.0 μL 的LB 液体培养基中, 以此菌液为模板实施菌落聚合酶链式反应。 使用的引物是载体上游引物SP6 和自行设计的含ploy(T)的cDNA 下游引物(5′-AGATCTCTCGAGTTTTTTTTTTTT-3′)。 反应体系如下: 菌液0.5 μL, 2×PCR master mix 5.0 μL, SP6和ploy(T)引物(2 μmol·L-1)各1.0 μL, 补加灭菌超纯水至10.0 μL。 为了防止聚合酶链式反应期间的水分蒸发, 在反应体系中补加矿物油10.0 μL。 反应条件为: 94 ℃/5 min, (94 ℃/30 s, 50 ℃/30 s, 72 ℃/120 s)×30 循环, 72 ℃/8 min, 4 ℃/∞。 聚合酶链式反应结束后, 取5.0 μL PCR 产物经10.0 g·kg-1琼脂糖凝胶电泳分析, 将扩增出介于500~2 000 bp 聚合酶链式反应产物的菌落初步确定为阳性。
1.2.3 质粒回收和DNA 测序 将通过菌落聚合酶链式反应初步确定为阳性克隆的菌液0.2 μL 接种于3.5 mL LB 培养液中(含Amp+100 mg·L-1), 在37 ℃恒温振荡培养12~15 h, 然后使用试剂盒进行质粒回收并对其进行DNA 限制性内切酶(EcoR I 和Xho I)消化(双酶切), 进一步确定阳性克隆及质粒浓度。 首先委托公司将阳性克隆质粒使用载体上游引物(SP6)对cDNA 进行正向测序。 测序结果利用DNAstar/EditSeq 查找cDNA 的完整开放阅读框, 推导氨基酸序列, 对具有合理完整开放阅读框的克隆继续委托公司使用载体下游引物(S.D.A.)进行反向测序。
1.2.4 序列分析 利用DNAstar/EditSeq 寻找完整开放阅读框, 推导其编码蛋白的氨基酸序列并分析其理化性质, 运用NCBI 的Blast 功能在GenBank 中查找并下载其他物种同源蛋白的氨基酸序列, 运用MegAlign 7.1 软件进行同源性比较, 并构建系统进化树。
2 结果
2.1 cDNA 的筛选
将日本蟾蜍皮肤cDNA 质粒文库转化E. coli 感受态细胞DH5α 获得的菌落, 以SP6 和ploy(T)为引物, 实施菌落聚合酶链式反应。 10 g·kg-1琼脂糖凝胶电泳分析显示, 在1 500 bp 左右出现一特异性聚合酶链式反应条带(图1A, 箭头所示), 在500 bp 左右出现一非特异性聚合酶链式反应条带。 将此菌液进行扩大培养和质粒回收, 并对质粒进行EcoR I 和Xho I 双酶切和10 g·kg-1琼脂糖凝胶电泳检测, 结果显示该质粒含有1 500 bp 左右的cDNA(图1B, 箭头所示), 与菌落聚合酶链式反应的结果吻合。 将此质粒委托DNA 测序公司进行了正、 反双向测序。
2.2 序列分析
2.2.1 测序结果分析及其编码蛋白的理化性质 使用DNAstar/EditSeq 对测序结果进行分析, 表明该cDNA 全长1 480 bp, ORF 为339 bp, 5′ 端125 bp 及3′ 端1 016 bp 的非翻译区。 完整开放阅读框中三磷酸腺嘌呤脱氧核糖核苷和三磷酸胸腺嘧啶脱氧核糖核苷(A+T)的质分数为53.10%, 三磷酸鸟嘌呤脱氧核糖核苷和三磷酸胞嘧啶脱氧核糖核苷(G+C)的质量分数为46.90%, 共编码112个氨基酸(图2), 其中酸性氨基酸(D+E)55 个,大部分成簇集中于序列中部, 碱性氨基酸(R+K)13 个, 极性氨基酸(N, C, Q, S, T, Y)16个, 疏水性氨基酸18 个, 缺乏芳香族氨基酸和含硫氨基酸。 其等电点(PI)理论值为3.554, 蛋白质分子质量为12.345 kD, 是一种高度酸性的亲水性多肽。 同源性比较发现, 该cDNA 编码的蛋白与其他物种的ProTα 具有较高的同源性,故命名为日本蟾蜍ProTα。

图1 pSD64TR-ProTα 菌落聚合酶链式反应产物(A)和重组质粒EcoRⅠ和Xho I 双酶切(B)产物的琼脂糖凝胶电泳Figure 1 Agarose gel electrophoresis of colony PCR product (A)and enzyme digestion product of recombinant plasmid of pSD64TR-ProTα
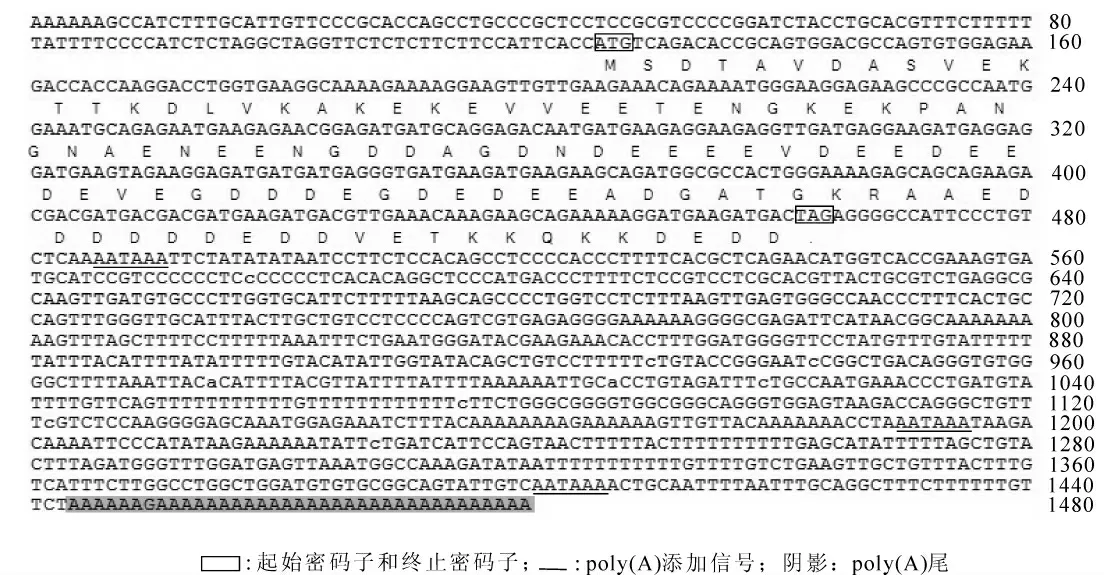
图2 日本蟾蜍ProTα 全长cDNA 序列及其ORF 编码的氨基酸推导序列Figure 2 Full length cDNA of ProTα and its deduced amino acid sequence of Bufo japonicus formosus
2.2.2 氨基酸序列同源性分析和系统进化树构建 将日本蟾蜍ProTα 氨基酸序列和美国国家生物技术信息中心(NCBI)网站上的其他物种的ProTα 氨基酸序列进行同源性比较。 结果显示, 与食用蛙Rana esculenta 同源性高达82%, 与牛Bos taurus, 狨猴Callithrix jacchus, 智人Homo sapiens, 恒河猕猴Macaca mulatta, 小鼠Mus musculus, 穴兔Oryctolagus cuniculus, 黑猩猩Pan troglodytes, 食蟹猴Macaca fascicularis, 褐家鼠Rattus norvegicus, 大西洋鲑Salmo salar, 非洲爪蟾Xenopus laevis 等11 种动物的同源性为54%~73%(图3)。 通过MegAlign 7.1 软件邻接法进行不同物种的氨基酸序列比对以及构建系统进化树。9 种哺乳类动物分属1 支, 日本蟾蜍和食用蛙等两栖类分属1 支, 大西洋鲑分属1 支(图4)。 整个进化树表明: ProTα 的进化史遵循传统动物进化规律。
3 讨论

图3 不同物种间ProTα 氨基酸序列比对Figure 3 Multiple alignment of ProTα amino acid sequences among different species
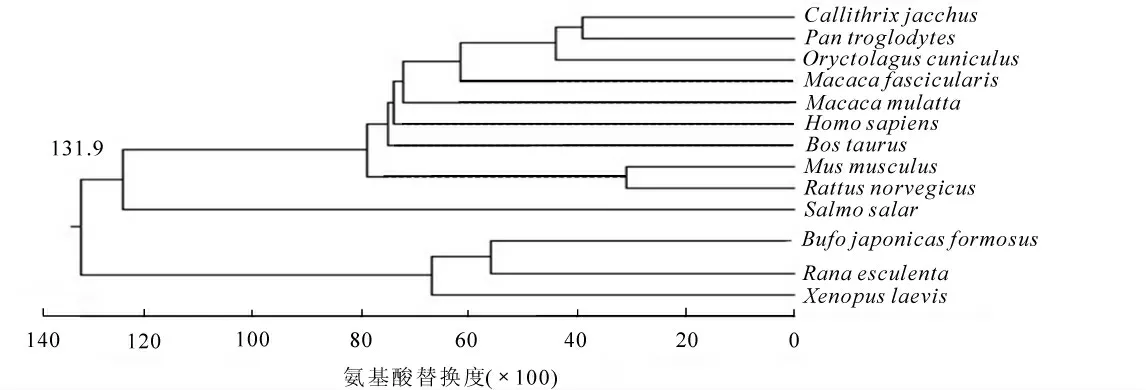
图4 日本蟾蜍与其他物种ProTα 的系统进化树Figure 4 Phylogenetic tree of ProTα among different species
本实验成功克隆到日本蟾蜍ProTα 的全长cDNA(图1~2), 编码112 个氨基酸残基组成的蛋白, 其中酸性氨基酸(D+E)55 个, 其等电点(PI)理论值为3.554, 甚至在中性pH 的溶液中也带有大量负电荷,被认为是真核生物中酸性最强的肽类之一[1]。 由于大量酸性氨基酸主要集中在其序列中部, 使得Pro-Tα不能形成高级结构, 在生理条件下蛋白呈现无规则卷曲构象, 即所谓的 “天然无结构蛋白”[6-7]。 中部序列能和组蛋白H1 特异性相互作用, 是促进细胞增殖的主要功能域[8-9]。 ProTα 缺乏含硫氨基酸和芳香族氨基酸, 不能在波长280 nm 处形成吸收峰[1]; 缺乏疏水性氨基酸, 不可能形成信号肽结构, 也就不能以限定途径分泌到胞外[1]。 现已明确ProTα 在细胞外具有抗肿瘤功能及其他免疫刺激功能, 但它如何分泌到胞外, 至今尚不明确, 有待进一步深入研究。
ProTα 有2 个方面功能: 一是胞内促进细胞增殖。 ProTα 在肝癌、 乳癌、 结肠癌和胃癌细胞中高表达, 表明ProTα 与肿瘤细胞的增殖密切相关[10-13]。 这可能是由于在细胞周期中, ProTα 的高表达缩短了G1 期[14]。 二是胞外具有免疫刺激活性。 ProTα 在细胞外, 通过潜在的膜受体调节免疫应答, 促进IFN-y,TNF-α, IL-2 等细胞因子的产生, 进而增强细胞和体液免疫应答, 从而产生抗肿瘤作用[1]。 另外ProTα作为免疫佐剂, 在小鼠体内能够维持较高的抗体滴度, 延长免疫保护的时间[15]。 最近有报道, CD8+ T细胞中的ProTα 能够强烈抑制HIV-1[16]。
ProTα 已作为一种新型的抗瘤药物进人到临床前期的研究阶段[17]。 因此, 构建合适的含ProTα 全长开放阅读框(ORF)的表达载体, 大量生产ProTα 蛋白, 对今后ProTα 生物学功能的进一步研究具有参考意义。
[1] 杨晓征, 吴军, 熊凌霜. 胸腺素α 原的研究进展[J]. 生物技术通讯, 2006, 17 (3): 443-446.YANG Xiaozheng, WU Jun, XIONG Lingshuang.Advances in research on prothymosin alpha [J].Lett Biotech, 2006, 17(3): 443-446.
[2] GOYA R G, BOLOGNANI F.Homeostasis, thymic hormones and aging [J].Gerontology, 1999, 45 (2): 174-178.
[3] MOODY T, FAGARASAN M, ZIA F, et al. Thymosin alpha 1 down regulates the growth of human non-small cell lung cancer cells in vitro and in vivo [J]. Cancer Res, 1993, 53 (21): 5214-5218.
[4] 张飞春, 孙文革, 高晓玲, 等. 蟾酥乙醇提取物抗肿瘤剂量效应关系实验研究[J]. 中国药业, 2011, 20 (16):23-24.ZHANG Feichun, SUN Wenge, GAO Xiaoling, et al. Experimental studies of the relationship between dose-dependency of ethanol extract of toad venom and antitumor effects [J]. J Chin Pharm, 2011, 20 (16): 23-24.
[5] 缪珠雷, 张康, 杨鸣泽, 等. 蟾蜕抗肿瘤及增强免疫效应研究[J]. 中国中药杂志, 2010, 25 (2): 211-214.MIAO Zhulei, ZHANG Kang, YANG Mingze, et al. Studies on anti-tumor and enhancing immunity activity of toad coat [J]. Chin J Chin Mater Med, 2010, 25 (2): 211-214.
[6] 刘俊珊, 张冬梅, 栗原博, 等. 蟾酥及其活性成分抗肿瘤作用研究进展[J]. 国际药学研究杂志, 2009, 36 (2):115-120.LIU Junshan, ZHANG Dongmei, KURIHARA Hiroshi, et al. Antitumor effects of venenum bufonis and its active components [J]. J Int Pharm Res, 2009, 36 (2): 115-120.
[7] GAST K, DAMASCHUN H, ECKERT K, et al. Prothymosin alpha: a biologically active protein with random coil conformation [J]. Biochem, 1995, 34 (40): 13211-13218.
[8] COVELO G, SARANDESES C S, DíAZ-JULLIEN C, et al. Prothymosin alpha interacts with free core histones in the nucleus of dividing cells [J]. J Biochem, 2006, 140 (5): 627-637.
[9] WILSON C L, MONTEITH W B, DANELL A S, et al. Purification and characterization of the central segment of prothymosin alpha: methodology for handling highly acidic peptides [J]. Pept Sci, 2006, 12 (11): 721-725.
[10] WU C G, HABIB N A, MITRY R R, et al. Overexpression of hepatic prothymosin alpha, a novel marker for human hepatocellular carcinoma [J]. Br J Cancer, 1997, 76 (9): 1199-1204.
[11] MAGDALENA C, DOMINGUEZ F, LOIDI L, et al. Tumour prothymosin alpha content, a potential prognostic marker for primary breast cancer [J]. Br J Cancer, 2000, 82 (3): 584-590.
[12] SHIWA M, NISHIMURA Y, WAKATABE R, et al. Rapid discovery and identification of a tissue-specific tumor biomarker from 39 human cancer cell lines using the SELDI ProteinChip platform [J]. Biochem Biophys Res Commun,2003, 309 (1): 18-25.
[13] 王梅, 潘吉勇, 安利佳. 胸腺素α 原反义寡核苷酸对胃癌细胞生长的影响[J]. 现代生物医学进展, 2009, 9(11): 2051-2054.WANG Mei, PAN Jiyong, AN Lijia. Effect of prothymosin alpaha antisense oligodeoxynucleotide on human gastric cancer in vitro [J]. Prog Mod Biomed, 2009, 9 (11): 2051 - 2054.
[14] WU Chaoliang, SHIAU Aili, LIN Cheinsheng. Prothymosin α promotes cell proliferation in NIH3T3 cells [J]. Life Sci, 1997, 61 (21): 2091-2101.
[15] 靳彦文, 陈婷, 李平, 等. 胸腺素α 原作为乙型肝炎表面抗原佐剂的研究[J]. 生物技术通讯, 2008, 19 (4):497-499.JIN Yanwen, CHEN Ting, LI Ping, et al. Study of prothymosin alpha as adjuvant to HbsAg [J]. Lett Biotechnol,2008, 19 (4): 497-499.
[16] MOSOIAN A, TEIXEIRA A, BURNS C S, et al. Prothymosin-α inhibits HIV-1 via Toll-like receptor 4 mediated type I interferon induction [J]. PNAS, 2010, 107 (22): 10178-10183.
[17] ECKERT K, GRUNBERG E, GARBIN F, et al. Preclinical studies with prothymosin alpha 1 on mononuclear cells from tumor patients [J]. J Immunopharmacol, 1997, 19 (9-10): 493-500.
——一道江苏高考题的奥秘解读和拓展

