地衣芽孢杆菌YB15 发酵培养优化的研究
朱天辉,李姝江,向潇潇,谯天敏
(四川农业大学林学院,四川 雅安 625014)
地衣芽孢杆菌(Bacillus lincheniformis),属于芽孢杆菌属(Bacillus),是一种革兰氏阳性细菌[1],在自然界分布非常广泛,是土壤和植物微生态优势种群[2]。它对多种植物病原菌有很强的抑制作用,如对镰刀菌、核盘菌、稻瘟病病菌和水稻纹枯病病菌等具有较强的抑菌活性,表现出很好的生防潜力[3~8]。在对番茄灰霉病的田间防效试验中,地衣芽孢杆菌与化学药剂腐霉利效果相当,可达60%以上[9];并且还具有在番茄植株体表定殖竞争能力[10]和诱导植株产生系统抗性的能力[11];可以产生多种抗生物质,其抗菌蛋白对苹果轮纹病菌、炭疽病菌的抑制作用使其对轮纹病具有防治作用[12]。
地衣芽孢杆菌YB15是从健康的撑×绿杂交竹上分离获得的一株对撑×绿杂交竹梢枯病病原菌(暗孢节菱孢菌)有很好的抑制作用的优势拮抗菌株。本试验旨在对地衣芽孢杆菌YB15 的发酵培养基及其培养条件进行优化,为撑×绿杂交竹梢枯病生物防治奠定基础。
1 材料与方法
1.1 材料
1.1.1 供试菌种
拮抗菌:地衣芽孢杆菌YB15(Bacillus lincheniformis)
病原菌:暗孢节菱孢菌(Arthrinium phaeospermum)(森林保护实验室)
1.1.2 培养基
PDA 培养基:马铃薯200 g,葡萄糖15 g~20 g,琼脂20 g,蒸馏水1 000 ml,0.1 MPa 灭菌30 min。
牛肉膏蛋白胨培养基(基础培养基):牛肉膏3.0 g,蛋白胨10.0 g,氯化钠5.0 g,琼脂20 g,蒸馏水1 000 ml,pH 值7.0,0.1 MPa 灭菌30 min。
1.2 方法
1.2.1 病原菌与拮抗菌的处理
将实验室保存的暗孢节菱孢菌接种到新鲜的PDA 培养基上,25 ℃培养,直到病原菌长满,取出,用5 mm 直径打孔器打孔得菌饼,待用。
取培养48 h 的地衣芽孢杆菌YB15 斜面,用10 ml 无菌水将其洗下,作为发酵种子液,取其3 ml 接入100 ml 的牛肉膏蛋白胨基础培养基中,25 ℃,140 r·min-1旋转培养72 h,待用。
1.2.2 抑菌活性的测定
地衣芽孢杆菌YB15 发酵无菌滤液的制备:取25 ℃,140 r·min-1旋转培养72 h 后的发酵液,于4℃下6 000 rpm 离心10 min,取其上清液,过0.22 μl的细菌过滤器,得到无菌滤液。
抑菌活性测定采用孔洞法,将暗孢节菱孢菌饼接种到PDA 平板中央,在距菌饼1 cm 相互垂直的4个方向,用5 mm 打孔器打孔,其中3个孔中加入80 μl 地衣芽孢杆菌YB15 发酵无菌滤液,另外一个孔加入等量无菌水做对照,然后进行恒温培养,4 d 后测定抑菌圈直径。
1.2.3 发酵培养基组分的单因素试验
碳源:分别选择葡萄糖、蔗糖、可溶性淀粉、麦芽糖、乳糖、糊精等,等量代替基础培养基中的碳源,25℃,140 r·min-1旋转培养48 h,测定不同碳源对地衣芽孢杆菌YB15 抑菌活性的影响。
氮源:分别以酵母浸膏、蛋白胨、牛肉膏、氯化铵、硫酸铵、牛肉膏+蛋白胨、酵母浸膏+蛋白胨、酵母浸膏+蛋白胨+氯化铵、酵母浸膏+蛋白胨+硫酸铵等,等量代替基础培养基中的氮源,25 ℃,140 r·min-1旋转培养48 h,测定不同氮源对地衣芽孢杆菌YB15 抑菌活性的影响。
无机盐:分别以磷酸氢二钾、磷酸二氢钾、硫酸镁、碳酸钙、硝酸钾等,等量代替基础培养基中的氯化钠,25 ℃,140 r·min-1旋转培养48 h,测定不同无机盐对地衣芽孢杆菌YB15 抑菌活性的影响。
1.2.4 发酵培养基组分优化
结合单因素试验结果,设计正交试验进行培养基组分的优化,每种培养基3次重复,测定不同培养基组分配比对地衣芽孢杆菌YB15 抑菌活性的影响,正交试验因素编码表设计如下(见表1)。

表1 地衣芽孢杆菌YB15 发酵培养基组分正交试验因素编码表
1.2.5 发酵培养基条件优化
结合发酵培养基组分正交试验的最优结果,设计正交试验进行培养基条件的优化,每种培养基3次重复,测定不同发酵条件对地衣芽孢杆菌YB15抑菌活性的影响,正交试验因素编码表设计如下(见表2)。
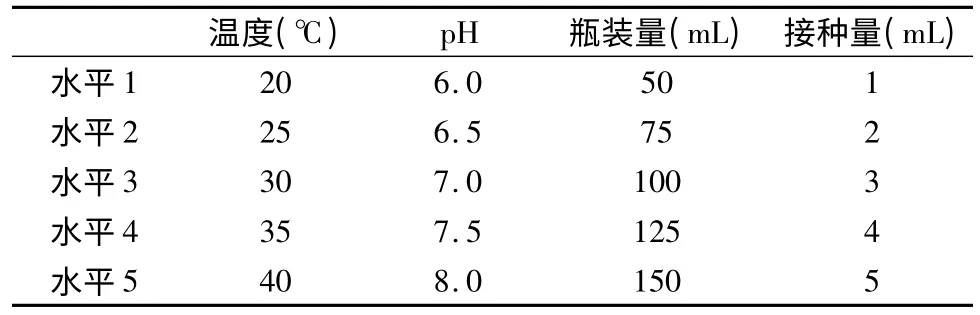
表2 地衣芽孢杆菌YB15 发酵培养条件正交试验因素编码表
1.2.6 生长曲线的测定
以培养基优化后的最优方案处理以下各培养基,将4 ml 发酵种子液转入100 ml 最优培养基中(共21 瓶)于25 ℃,140 r·min-1摇床培养。每6 h取出一瓶,以分光光度法在波长650 nm 处测出各发酵液OD 值,以培养0 h 的发酵液OD 值为对照,测定时间为0~102 h。最后以发酵时间(h)为横轴,以各无菌发酵液的OD 值为纵轴绘出生长曲线。
2 结果与分析
2.1 发酵培养基组分的单因素试验
从图1可以看出,当使用麦芽糖和葡萄糖作为碳源,等量代替基础培养基中的碳源进行培养时,地衣芽孢杆菌YB15 的抑菌圈直径都较大,抑菌活性都较强,但效果相差不大,而葡萄糖则更加经济易得。所以,地衣芽孢杆菌YB15 发酵培养基的最适碳源是葡萄糖。
从图2可以看出,当使用酵母浸膏+蛋白胨+硫酸铵等作为氮源,等量代替基础培养基中的氮源进行培养时,地衣芽孢杆菌YB15 的抑菌圈直径最大,抑菌活性最强。所以,地衣芽孢杆菌YB15 发酵培养基的最适氮源是酵母浸膏+蛋白胨+硫酸铵。
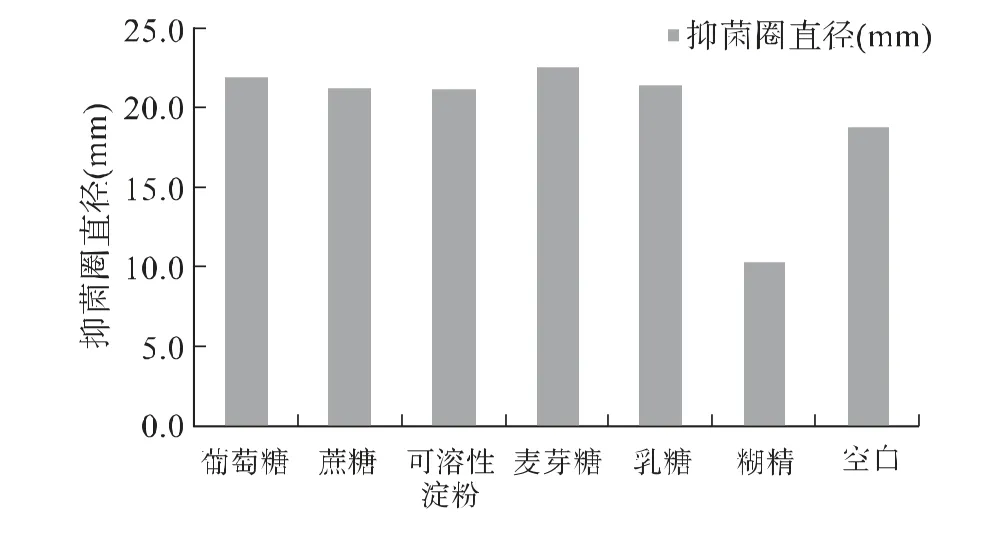
图1 不同碳源对地衣芽孢杆菌YB15 抑菌活性的影响

图2 不同氮源对地衣芽孢杆菌YB15 抑菌活性的影响
从图3可以看出,当使用原基础培养基中的无机盐进行培养时,地衣芽孢杆菌YB15 的抑菌圈直径最大,抑菌活性最强。所以,地衣芽孢杆菌YB15发酵培养基的最适无机盐仍为氯化钠。

图3 不同无机盐对地衣芽孢杆菌YB15 抑菌活性的影响
2.2 发酵培养基组分优化
正交试验培养基组分优化的方差分析显示(见表3),以上各不同处理导致地衣芽孢杆菌YB15 的抑菌圈直径差异极显著。SSR 法对各处理进行多重比较,结果表明(见表4),9种不同处理中以3 号处理的抑菌圈直径最大,且显著大于其他处理,因此发酵培养基的最适配比为葡萄糖5.0 g,酵母浸膏7.5 g,蛋白胨7.5 g,硫酸铵5.0 g。
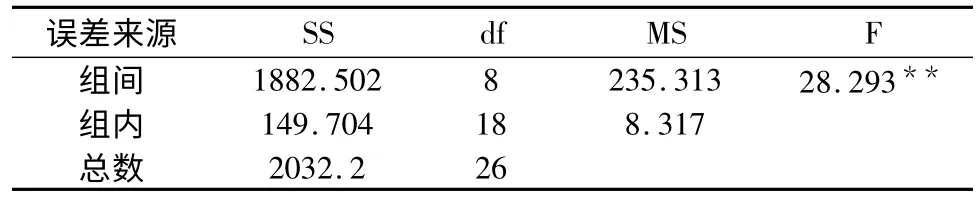
表3 地衣芽孢杆菌YB15 发酵培养基组分正交试验方差分析

表4 地衣芽孢杆菌YB15 发酵培养基组分多重比较
2.3 发酵培养基条件优化
正交试验的发酵培养条件优化方差分析(表5)表明,以上各不同发酵条件导致地衣芽孢杆菌YB15的抑菌圈直径差异极显著。
各发酵条件因素进行单因素方差分析结果(表6)显示,不同温度导致的地衣芽孢杆菌YB15 抑菌圈直径差异极显著,而不同pH、瓶装量和接种量之间差异不显著。
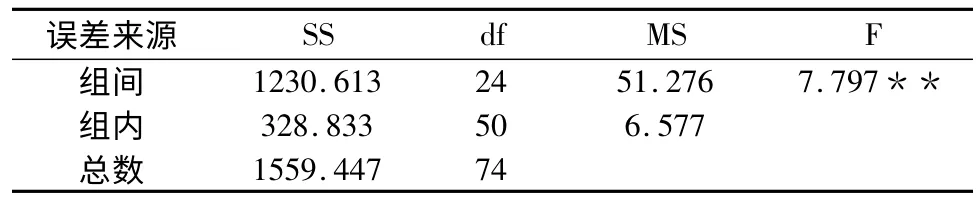
表5 地衣芽孢杆菌YB15 发酵培养基条件正交试验方差分析

表6 发酵条件单因素方差分析
SSR 法对温度各不同处理进行多重比较(见表7),显示2 号处理的抑菌圈直径最大,因此地衣芽孢杆菌YB15 的发酵培养的最适条件为2 号处理,即25 ℃,pH 值为6.5,瓶装量为100 ml,接种量为4 ml。

表7 不同温度处理的多重比较
2.4 生长曲线的测定
由图4可知,在以上实验得出的发酵培养基最适组分和培养最适条件下,发酵种子液接入最优培养基0~6 h 为菌体生长延迟期,镜检可见菌体小、数量极少;从6 h 以后进入对数生长期,镜检结果菌体数量急剧增多,菌体形态增大增长,并开始形成芽孢;在18 h 以后,地衣芽孢杆菌处于生长的稳定期,菌体生长缓慢,镜检可知菌体全部形成芽孢,孢囊略为膨大。地衣芽孢杆菌YB15 的发酵周期为18 h~20 h。所以应在12 h~18 h 时收集菌体,因为这时地衣芽孢杆菌YB15 处于对数生长末期,此时收集菌体既可保持较高的细胞活性,又可得到尽可能多的细胞数。

图4 地衣芽孢杆菌YB15 生长曲线
3 结论与讨论
本试验采用单因素实验法确定了地衣芽孢杆菌(Bacillus lincheniformis)YB15 发酵培养基的碳源、氮源、无机盐的最适组分,并通过正交试验得出发酵培养基组分的最适配比为葡萄糖5.0 g,酵母浸膏7.5 g,蛋白胨7.5 g,硫酸铵5.0 g。另外,最适培养条件为25 ℃,pH 值为6.5,瓶装量为100 ml,接种量为4 ml。在此优化条件下,地衣芽孢杆菌YB15 的生长对数期为6 h~18 h,收集菌体的最佳时间为12 h~18 h。发酵周期为18 h~20 h,与丰贵鹏和杨丽云[13]的实验结果,发酵周期为22 h~24 h 相比,缩短了4 h,比经验周期缩短了14 h;与刘莹等[14]的实验结果中从21 h 开始进入衰亡期相比,大大延长了地衣芽孢杆菌的稳定期;谷春涛[15]研究发现地衣芽孢杆菌TS-01 的最适生长温度为40 ℃,且微量MnSO4可促进其产孢量的增减。众多关于地衣芽孢杆菌发酵条件研究结果有所差异,可能是由于不同生理小种的特性不同,或者是环境条件各异,具体原因有待进一步的探讨。
[1]王贺祥.农业微生物学[M].北京:中国农业大学出版社,2003:14~15.
[2]赵国纬,陆彬,周义彬,等.地衣芽孢杆菌L3 发酵培养基的响应面法优化[J].湖北农业科学,2009,48(8):1852~1855.
[3]郭贵海,王崇文.肠道菌群调节剂的研究进展[J].临床内科杂志,2002,19(2):88~90.
[4]王旭明,陈宗泽,袁毅.益生菌作用机理的研究进展[J].吉林农业科学,2002,27(1):50~53.
[5]唐丽娟,纪兆林,徐敬友,等.地衣芽孢杆菌W10 对灰葡萄孢的抑制作用及其抗菌物质[J].中国生物防治,2005,21(3):203~205.
[6]彭化贤,刘波微,陈小娟,等.水稻稻瘟病拮抗细菌的筛选与防治初探[J].中国生物防治,2002,18(1):25~27.
[7]Ahmed SA,Ezziyyani M,S'Anchez PC,et al.Effect of chitin on biological control activity of Bacillus spp.and Trichoderma harzianum against root rot disease in pepper(Capsicum annuum)plants[J].European Journal of Plant Pathology,2003,109:633~637.
[8]周鸣,刘云国,李欣,等.地衣芽孢杆菌对Cr6+的吸附动力学研究[J].应用与环境生物学报,2006,12(1):84~87.
[9]童蕴慧,徐敬友,陈夕军.番茄灰霉病菌拮抗细菌的筛选和应用[J].江苏农业研究,2001,22(4):275~281.
[10]童蕴慧,纪兆林,徐敬友,等.灰葡萄孢拮抗细菌在番茄植株体表的定殖[J].中国生物防治,2003,19(2):807~811.
[11]童蕴慧,郭桂萍,徐敬友,等.拮抗细菌对番茄植株抗灰霉病的诱导[J].中国生物防治,2004,20(3):187~189.
[12]纪兆林,凌筝,张清霞,等.地衣芽孢杆菌对苹果轮纹病菌和炭疽病菌的抑制及其对贮藏期苹果轮纹病的防治作用[J].果树学报,2008,25(2):209~214.
[13]丰贵鹏,杨丽云.地衣芽孢杆菌发酵培养基的优化[J].安徽农业科学,2009,37(15):6862~6864.
[14]刘莹,孙荣丹,杨翔华,等.衣芽孢杆菌LNPU-1 发酵条件研究及培养基优化[J].食品科技,2008,(8):28~31.
[15]谷春涛.地衣芽孢杆菌TS-01 培养条件的研究[D].硕士论文,中国农业大学,2004.

