紫玉兰(Magnolia liliflora)的繁育系统研究
唐 婷,胥晓,吴庆贵,胡进耀* ,曾阳梅
(1.西华师范大学生命科学学院,四川 南充 637002;2.绵阳师范学院生命科学与技术学院,四川 绵阳 621000;3.西华师范大学国土资源学院,四川 南充 637002)
1 引言
繁育系统通常的定义是代表直接影响后代遗传组成的所有有性特征[1],主要包括花综合特征、花各性器官的寿命、花开放式样、自交亲和程度和交配系统,它们结合传粉者和传粉行为是影响生殖后代遗传组成和适合度的主要因素[2],其中交配系统是核心。繁育系统在决定植物的进化路线和表征变异上起重要作用,是种群有性生殖的纽带,并成为当今进化生物学研究中最为活跃的领域之一[3]。就国内对植物繁育系统的研究现状来看,对小桐子[4]、滇丁香[5]、百子莲[6]、灯盏花[7]、地下结实植物白番红花[8]、淫羊藿[9]、濒危植物夏腊梅[10]、凹叶厚朴[11]、三角叶黄连[12]、短葶飞蓬[13]等植物的繁育系统以及传粉特性做了详细的研究[14-18],这些相关研究工作的开展对深入了解植物花部形态与功能的关系、物种形成以及保护生物学操作具有重要的理论和实际意义,而有关紫玉兰(Magnolia liliflora)繁育系统的研究则未见相关报道。
近年来国内学者对紫玉兰的研究日趋系统深入,主要侧重于对其化学成分、药用价值[19]、栽培观赏[20]、组织培养[21-22]以及其幼树的光合特征[23]等几方面的研究,特别是对其花蕾(又称“辛夷”)的成分及药用价值做了较深的研究[24-26],而有关其开花特性及繁育系统的研究则未见报道。本实验以紫玉兰为实验材料,通过对其繁育系统包括花部形态、花粉活力及柱头可授性、花粉-胚珠比(P/O)、杂交指数及传粉特征等进行研究,以期为紫玉兰的培育与利用及其资源保护提供科学依据。
2 材料和方法
2.1 研究样地设置
样地Ⅰ选在海拔约500 m 的绵阳师范学院校园内,本样地有紫玉兰树13株,由于本样地周围无其他高大植物遮掩(主要有海桐、二球悬铃木、麦冬),光照充足,开花较早。样地Ⅱ选在北川片口自然保护区,本样地有紫玉兰树22株,样地Ⅱ四周生长有大量的高大植物(主要有樟树、芭蕉、海桐、银杏、黄金间碧玉竹、棕榈、罗汉松等),植物生长茂盛,遮掩部分光照,使样地Ⅱ的平均温度较样地Ⅰ低3℃~6℃。
2.2 研究方法
2.2.1 花部形态特征及观察
3月上旬选择标准植株及花朵进行标记,每株选择5个花朵,观察花瓣颜色、花柱长度等花部主要形态指标。并在紫玉兰种群中任意选择30 朵紫玉兰花,观察并记录其花部特征。
2.2.2 花粉活力检查
每天6:30~18:30 每隔3h 分别采集不同发育时期的新鲜花备用。从3月上旬开始采集花粉,每天对不同时期的花粉进行3次活力检测,持续到花谢,总计10 d 左右。花粉活力采用TTC 法测定[27](将新鲜花粉置于载玻片上,同时用火加热致死的花粉作对照)。具体操作如下:将开花后不同时期的花粉撒在载玻片上,滴加1 滴~2 滴0.5%TTC(2,3,5-triphenyl tetrazolium chloride)溶液,迅速盖上盖玻片,置入垫有湿润滤纸的培养皿中,放在25℃黑暗条件下培养2h 左右。在显微镜下观察,若花粉变红则表明有活力,若红色很浅或无变化或变黑色则表明无活性。统计全部花粉中红色花粉所占比例(每片载玻片上的花粉数>500 粒,重复5 朵花)。
2.2.3 柱头可授性检测
用联苯胺- 过氧化氢法测定柱头可授性[27]。具体方法是:取不同时期的花朵,将其柱头完全浸泡在联苯胺- 过氧化氢反应液中(1%联苯胺∶3%过氧化氢∶水=4∶11∶22,体积比)。若柱头具有可授性,则柱头周围的反应呈现蓝色并伴有大量气泡出现;否则无气泡产生且不变蓝,对比确定自然条件下柱头颜色的变化与柱头可授性的相关规律。
2.2.4 花粉-胚珠比(pollen-ovule ratio,P/O)的估算
随机摘取花蕾20 朵(每株最多5 朵)花药尚未开裂的花固定于FAA 中,取单花的全部花药挤碎于含有0.5%亚甲蓝染液的乙醇溶液中,定溶至1 ml。摇匀后用移液器取1 ul 悬浮液在显微镜下统计花粉数量,重复5次,最后得出单花花粉总量。将每朵花的子房置于载玻片上,在40 倍解剖镜下进行解剖,在载玻片上滴1 滴蒸馏水,将子房置于其中。小心解剖将胚珠从胎座中解开,观察并计数。每朵花的P/O 比用该花的花粉总量除以胚珠数得到。依据Cruden[28](1977)的标准:P/O 为18.1~39.0 时,繁育系统为专性自交;P/O 为31.9~396.0 时,繁育系统为兼性自交;P/O 为244.7~2 588.0时,繁育系统为兼性异交;P/O 为2 108.0~195 525.0时,繁育系统为专性异交,即P/O 值的降低意味着近交程度的升高,而P/O 值的升高伴随着远交程度的上升。
2.2.5 杂交系数(out-crossing index,OCI)的估算
按照Dafni[27](1992)的标准进行花序直径;花朵大小及开花行为测量及繁育系统的评判。具体方法:(1)花朵或花序直径<1mm 记为0;1~2 mm 记为1;2~6 mm 记为2;>6 mm 记为3。(2)花药开裂时间与柱头可授期之间的时间间隔,同时或雌蕊先熟记为0;雄蕊先熟记为1。(3)柱头与花药的空间位置,同一高度记为0;空间分离记为1。三者之和为OCI 值。评判标准为,OCI=0 时,繁育系统为闭花受精;OCI=1 时,繁育系统为专性自交(obligate autogamy);OCI=2 时,繁育系统为兼性自交(facultative autogamy);OCI=3 时,繁育系统为自交亲和有时需要传粉者;OCI=4 时,繁育系统为部分自交亲和,异交,需要传粉者。
2.2.6 套袋实验
依照Dafni[27](1992)描述的方法进行下述处理:(1)对照,不套袋、不去雄、自由传粉,用于检测自然条件下的传粉情况。(2)自发的自花传粉,开花前套硫酸纸袋,不去雄,检测是否存在自交。(3)同株异花传粉,去雄、套硫酸纸袋,同株异花之间人工授粉,检测是否存在同株异花式自交及是否亲和(检测能否受精结实)。(4)异株异花授粉,去雄、用不同植株相同类型的花粉进行人工授粉,然后套袋,检测杂交是否亲和。(5)自然条件下的异花授粉,去雄、不套袋、自由传粉,与前面四项的结果比较,检测座果状况是否受采粉者限制以及各种授粉方式所占的比例。(6)去雄、套网袋,检测风媒传粉的效果。(7)去雄或去雌、套硫酸纸袋不授粉,检测是否有无融合生殖现象。
2.2.7 传粉媒介的观察
选择紫玉兰相隔一定距离的花序,以小时(h)为单位在8:00~18:00 观察,记录访花者的种类、数量、访花行为和访花频率,直至花瓣脱落。在观察访花者的访花行为和访花频率时记录天气变化。
3 结果与分析
3.1 花部形态特征
紫玉兰的花雌雄同株,其花期较长,一般为15 d左右,3月初开始开花。花蕾卵圆形,被淡黄色绢毛;花先叶开放,钟形,直立于粗壮、被毛的花梗上,稍有香气;花被片9~12,外轮3 片萼片状,紫绿色,披针形长2 cm~3 cm,常早落,内两轮肉质,外面紫色或紫红色,内面带白色,花瓣椭圆状倒卵形,长8 cm~10 cm,宽3 cm~4.5 cm;雄蕊紫红色,长8 mm~10 mm,花药黄色,长约7 mm,侧向开裂,药隔伸出成短尖头;雌蕊群长约1.5 cm,淡紫色,无毛,心皮多数,子房上位,柱头微微卷曲,分离,绿色。单花期为10 d~15 d。样地Ⅰ和样地Ⅱ由于所处的地方的温度、光照、湿度、生境植物(见表1)等的不同,因此样地Ⅱ比样地Ⅰ晚开花2 d~3 d,并且两个样地的花部特征也存在一定差异(见表2)。

表1 样地Ⅰ和样地Ⅱ紫玉兰的生境Table 1 The habitat of quadratⅠand quadratⅡ
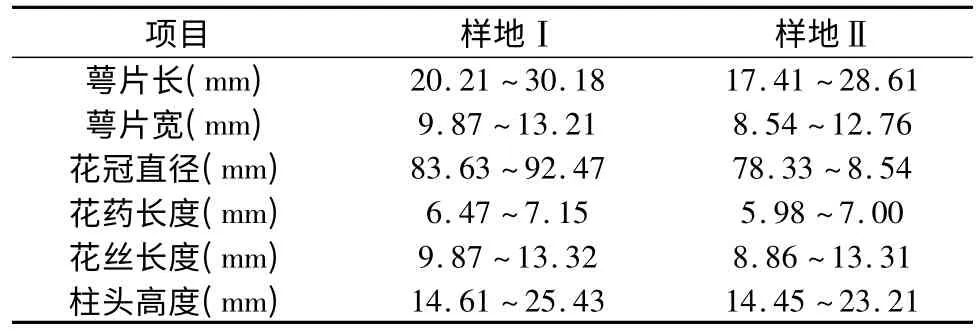
表2 样地Ⅰ和样地Ⅱ紫玉兰花的数量性状Table 2 The qualitative character of Magnolia liliflora flowers in quadrat Ⅰand quadrat Ⅱ
3.2 花粉活力
花粉活力与花粉数量均为雄性适合度的重要组成部分,并进一步影响繁殖成功率。紫玉兰的花粉寿命只有2 d~3 d 左右,花药刚散粉时花粉活力最高,样地Ⅰ和样地Ⅱ分别为86.56%和98.77%(表3 和表4)。此时为甲虫类、蜜蜂类等访花昆虫的活动高峰期,利于花粉的传播。随后开始慢慢下降,散粉24 h 后样地Ⅰ与样地Ⅱ的花粉活力分别降为57.23%、69.18%。夜间花粉活力下降得较快。随着散粉的时间越长,花药的颜色也逐渐发生变化,由黄色变为黄红色,花粉活力分别下降至5.76%、32.37%。由于样地Ⅰ在校园,干扰因素较多,所以其花粉活力要比样地Ⅱ的花粉活力低12.21%~19.87%。散粉48h 时,花药由黄红色变成红褐色,样地Ⅰ几乎全部花粉丧失活力,样地Ⅱ的花粉活力下降为29.85%,但样地Ⅱ花粉的活力仍比样地Ⅰ的花粉活力高许多。但若遇到降雨,花粉的活力将大幅度降低,寿命缩短。有效花粉数量是异花授粉成功与否的关键,在自然条件下,紫玉兰的花粉活力还是比较高的,因此在总体上还是保证了紫玉兰的成功繁育(表3 和表4)。
3.3 柱头可授性检测结果
紫玉兰花粉从雄花传到雌花柱头上,成熟柱头对花粉的接受能力持续时间为5 d~6 d(参见表3和表4)。紫玉兰的柱头在未授粉之前是卷曲分开的,当柱头授粉后,柱头就合拢。当柱头在雌花开放后1 d~3 d可授性最强,具有较强的过氧化物酶活性。样地Ⅰ从第4 天开始有极少量柱头部分变黑,样地Ⅱ从第3 天开始有极少量柱头部分变黑,过氧化物酶活性减弱,可授性降低。随着开花日数的增加,过氧化物酶活性更低,开花后第6 天大部分柱头都合拢并变黑,过氧化物酶活性已很低;到开花后第7 天,完全检测不到过氧化物酶活性,此时柱头失去可授性。柱头可授性的降低与柱头颜色的变化以及柱头的合拢情况密切相关,即开花后1 d~3 d 柱头全部都呈绿色,可授性最强,4 d~6 d 绿色衰减且柱头开始合拢,可授性降低,7 d 后柱头几乎全部失绿且合拢,柱头失去可授性。因此,可用柱头颜色来指示其可授性。同时,授粉后的柱头过氧化物酶活性也明显降低且柱头的合拢程度也有不同,表明其授粉过程已经完成[4]。

表3 样地Ⅰ的花粉活力、柱头可授性Table 3 The pollen viability and stigma receptivity of M.liliflora in quadratⅠ
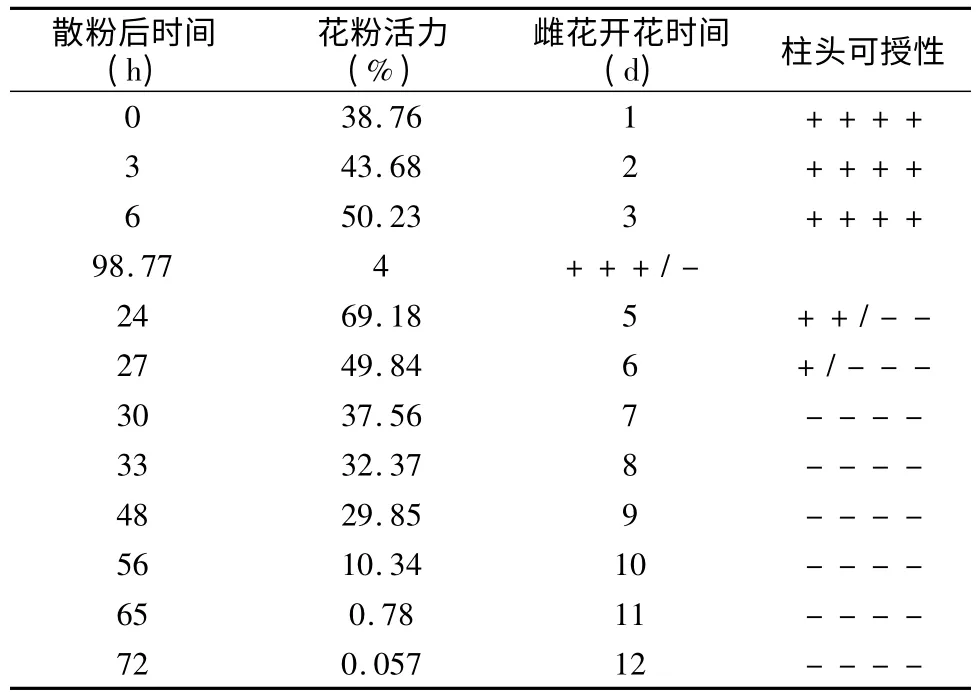
表4 样地Ⅱ的花粉活力、柱头可授性Table 4 The pollen viability and stigma receptivity of M.liliflora in quadrat Ⅱ
3.4 紫玉兰的花粉-胚珠比(P/O)
样地Ⅰ紫玉兰每朵花具雄蕊58 枚~72 枚,每朵花的花粉量为896 160粒~1 188 000粒,胚珠数为56;样地Ⅱ紫玉兰每朵花具雄蕊55个~58个,每朵花的花粉量924 000~1 001 000,胚珠数为54。样地Ⅰ和样地Ⅱ的花粉-胚珠比(P/O)均高于2 500(表5 和表6)。依据Cruden[28]的标准,紫玉兰的繁育系统属于专性异交。

表5 样地Ⅰ紫玉兰花粉-胚珠比观察结果Table 5 The results of P/O of M.liliflora in quadrat Ⅰ

表6 样地Ⅱ紫玉兰花粉-胚珠比观察结果Table 6 The results of P/O of M.liliflora in quadrat Ⅱ
3.5 紫玉兰的杂交指数
按照Dafni[27]的方法进行紫玉兰杂交指数的测量(表7)。样地Ⅰ紫玉兰花直径为8.36 cm~9.24 cm;样地Ⅱ紫玉兰花直径为7.82 cm~8.53 cm。样地Ⅰ和样地Ⅱ紫玉兰花药开裂时间与柱头可授期之间的时间间隔为雌蕊先熟,柱头与花药不在同一高度。按照Dafni 的标准,紫玉兰的OCI=4,即紫玉兰的繁育系统为异交、部分自交亲和、需要传粉者。

表7 样地Ⅰ和样地Ⅱ紫玉兰的OCI 值观测结果Table 7 The results of OCI of M.liliflora in quadrat Ⅰand quadrat Ⅱ
3.6 套袋实验结果
样地Ⅰ和样地Ⅱ通过套袋和人工授粉对紫玉兰基本繁育系统的检测表明在开花前套硫酸纸袋隔离传粉者的条件下,两个样地的紫玉兰均能有较高的结实率。紫玉兰在自花传粉的条件下可获得较高的结实率,表明该树种具有一定的自交亲和性。同时,在自然条件以及在人工去雄套袋处理的情况下,目前统计发现样地Ⅰ和样地Ⅱ的紫玉兰均有较高的结实率,这主要是由于紫玉兰果实在还未完全成熟的情况下,无法检测其是否能最终形成成熟、可育的种子(紫玉兰的果实成熟期为9月)。因此,通过套袋实验还不能完全确定紫玉兰授粉是否需要传粉者。
3.7 传粉媒介
紫玉兰的花较大型,呈钟状,花瓣也较长,对雄蕊有较好的保护作用,为了提高繁育,紫玉兰也存在虫媒传粉。在未开花之前,紫玉兰未散粉,当花开后几小时内,花药室裂开,开始散粉。紫玉兰花均有浓郁的香气,增强了对传粉者的吸引。此外,紫玉兰还具有虫媒植物的花部综合特征,即花粉粒较大(平均直径为37.0 μm~72.0 μm),有粘性。因此可以肯定,虫媒传粉是紫玉兰的主要传粉途径。通过野外观察发现,紫玉兰的访花昆虫类群主要有鞘翅目(Coleoptera)的甲虫、膜翅目(Hymenoptera)的蜜蜂和蚁类、双翅目(Diptera)的蚊等几种访花昆虫,但这几种昆虫的传粉质量各不相同。膜翅目的蜂类昆虫都具有飞行速度快,访花速率高,携粉量大的特点[29],对紫玉兰的异花传粉起主要作用;蚁类是喜花昆虫,数量较多,但由于个体小,长时间停留于同一花朵中,活动能力差,只能在紫玉兰的自花授粉中发挥一定的传粉作用;甲虫类也是喜花昆虫,数量较多,在未开花之前就聚集在花朵里,但由于个体较小,体表光滑,长时间停留于同一花朵中,活动能力差,也只能在自花授粉中发挥一定的传粉作用。至于双翅目的蚊类,数量较少且主要是吸食紫玉兰的花蜜,因此,对紫玉兰的传粉作用不大。
4 讨论
4.1 紫玉兰的繁育类型
紫玉兰繁育系统具有多样性,近交衰退,远交代价很高,受外界条件影响大。进化是折中的,权衡近交和远交利弊的途径是混合的交配系统。自然界绝对自交或杂交的植物类群很少,大多是两者兼而有之并采取混合交配的繁殖对策模式。根据紫玉兰P/O 比、杂交系数和去雄-套袋-人工授粉试验结果显示,其繁育系统不完全一致。P/O 值测定具有快速简便等特点,但正确性相对较低。杂交系数检测是从植物的表观形态适应于虫媒传粉的角度入手,因而一般以其测试数据为传粉结果的依据更为真实可靠。因此紫玉兰的繁育系统异交、部分自交亲和、需要传粉者的混合交配型。
4.2 紫玉兰的传粉系统
传粉系统由3个部分组成,即花粉、柱头和传粉媒介[28]。本文对紫玉兰的传粉媒介检测结果表明,紫玉兰为虫媒植物。花粉活力和柱头可授性检测结果显示,紫玉兰柱头可授期为5 d~6 d,在开花1 d~3 d 之内均具有较强的可授性,其后可授性逐渐降低。当遇到降雨时导致花粉量不足、花粉活力丧失,但紫玉兰通过较长的柱头可授期,仍可提高结实率,即雌性生殖适合度(fitness)较高。花粉活力在第1 天较高,第2 天明显下降,至花朵枯萎时仅有少量花粉具有活力。样地Ⅰ和样地Ⅱ紫玉兰的花期都是阳光明媚、温度较高的(3月~4月)时节,花粉的活力较高,加之访花昆虫的高效率传粉,因此对花粉的利用率较高。紫玉兰较高的P/O 比、较长的柱头可授期及丰富的传粉媒介,是保证传粉系统完善和提高结实率的主要原因。
4.3 紫玉兰的传粉媒介
经过长期的协同进化,传粉动物与显花植物之间形成一种互利的关系,即动物在采食划分和花蜜的同时,为植物起传粉的重要作用。花色气味等诱物作为一种信号或招牌诱使访问者来访花,而报酬是指最终吸引昆虫且能补偿访花所付出的能量消耗物质,如花粉、花蜜及热量等[30]。花色气味是一种较古老的吸引机制,访花昆虫能精确地识别花中特定的气味组分,有相关研究认为,比起花冠直径、形状、花色等花部外形特征,气味对传粉者的吸引更重要,因为花部释放出的挥发性气体向外扩散,可以吸引数千米以外的授粉者[31~32]。植物花朵散发的气味越浓,其传粉者访花频率越高,种子的数量也就越多,花部散发的气味是吸引昆虫授粉传粉成功的保证,如欧亚香花芥[33]。在雌蕊成熟阶段,紫玉兰散发出浓郁的花香,并提供柱头分泌物作为吸引访花的信号或是访花昆虫的食物;雄蕊成熟阶段,花的香味迅速变淡,此时,花粉成为访花昆虫的首选食物。但是,通过实验观察,在雌蕊成熟阶段,昆虫很少去光顾此阶段的紫玉兰花朵。因此,在有高报酬的阶段缺乏合适的诱物也使得紫玉兰难以吸引高效率的传粉者。研究表明,木兰属的专属昆虫为甲虫类,如圣甲虫等[34~35]。通过本实验,了解到紫玉兰主要是虫媒花,其访花昆虫类群主要有鞘翅目的甲虫、膜翅目的蜜蜂,同时也有少量膜翅目的蚁类、双翅目的蚊等几种访花昆虫。自然条件下,甲虫的传粉效率较低,而关于其他几种访花昆虫的传粉效率还有待研究,特别是其中双翅目的蚊类是否具有传粉作用还值得观察。
地理分布不同的种群其自交水平也各不相同,如种群边缘自交率高[2]。紫玉兰的不同种群因生境条件的不同,花期、访花者都有可能不太一样,交配系统也有可能发生改变。紫玉兰种群大小、密度和开花数量等影响访花者的访花频率和行为机制并不清楚,自花传粉的程度与自交率的大小也并不明确,这些问题都有待进一步研究。
[1]Wyatt R.Pollination plant interaction and evolution of breeding systems[A].In Leslie Real (ed):Pollination Biology[M].Orlando,Florida:Academic Press Inc,1983:51~86.
[2]何亚平,刘健全.植物繁育系统研究的最新进展和评述[J].植物生态学报,2003,27(20):151~163.
[3]Dafni A,H esse M Pacini E.Pollen and pollination New York Spring-V erlag 2000.
[4]李昆,尹伟伦,罗长维.小桐子繁育系统与传粉生态学研究[J].林业科学研究,2007,20(6):775~781.
[5]马宏,王雁,李正红,等.滇丁香的繁育系统研究[J].林业科学研究,2009,22(3):373~378.
[6]孙颖,卓丽环.百子莲的传粉昆虫及其访花行为研究[J].上海农业学报,2009,25(1):87~91.
[7]李林玉,杨丽英,王馨,等.灯盏花的繁育系统与访花昆虫初步研究[J].西南农业学报,2009,22(2):454~458.
[8]张洋,谭敦炎.地下结实植物白番红花的繁育系统与传粉生物学[J].生物多样性2009,17(5):468~475.
[9]权秋梅.淫羊藿传粉生态的研究[D].2007.
[10]张文标,金则新.濒危植物夏蜡梅花部综合特征与繁育系统[J].浙江大学学报(理学版),2009,36(2):204~210.
[11]杨旭,杨志玲,王洁,等.濒危植物凹叶厚朴的花部综合特征和繁育系统[J].生态学杂志,2012,03:551~556.
[12]李小锋,宋良科,代春初,等.三角叶黄连的繁育系统与形态解剖学特征分析[J].中国中药杂志,2010,14:1789~1794.
[13]李鹂,党承林.短葶飞蓬(Erigeron breviscapus)的花部综合特征与繁育系统[J].生态学报,2007,02:571~578.
[14]操国兴,严娟,罗畅.珍稀濒危植物珙桐繁育系统的初步研究[J].西南大学学报(自然科学版),2007,29(4):124~126.
[15]张仁波,窦全丽,何平,等.濒危植物缙云卫矛繁育系统研究[J].广西植物,2006,26(3):308~312.
[16]黄修梅,郝丽珍,胡宁宝,等.中国特有种—沙芥繁育系统和传粉生物学研究[J].西北植物学报,2009,29(11):2232~2237.
[17]王翠翠,刘文哲,张莹.喜树开花特性及繁育系统的研究[J].热带亚热带植物学报,2009,17(3):275~282.
[18]郑桂灵,李鹏.四川黄龙杓兰属植物资源及繁育系统研究[J].安徽农业科学,2009,37(12):5468~5469,5483.
[19]朱雄伟,杨晋凯,胡道伟.辛夷成分及其药理应用研究综述[J].海峡药学,2002,14(5):5~7.
[20]张超,苗立旺,周金铎,等.辛夷育苗栽培技术[J].河南林业科技,2003,23(2):53~55.
[21]周丽华,许冲勇,曾雷,等.紫玉兰组织培养繁殖研究[J].经济林研究,2002,20(4):37~38.
[22]沈作奎.辛夷植物繁殖技术研究概况[J].湖北民族学院学报(自然科学版),2006,24(4):359~362.
[23]周建,刘弘,齐安国,张琳.紫玉兰幼树的光和特性[J].福建林学院学报,2008,28(1):56~60.
[24]陈志东,王锋,汪年松.辛夷挥发油对肾缺血再灌注损伤的保护作用[J].中国现代医学杂志,2009,19(10):1484~1490.
[25]王琦,齐美玲,傅若农.固相微萃取气质联用测定中药辛夷挥发性成分[J].世界科学技术—中医药现代化★专题讨论,2009,11(1):168~172.
[26]程勋,王刚,何国柱,等.辛夷鼻炎合剂治疗鼻炎90 例临床观察[J].四川中医,2009,27(6):112~113.
[27]Dafni A.Pollination ecology[M].New York:Oxford Univ Press,1992:59~89.
[28]Cruden R W.Pollen ovule ratios:A conservative indicator of breeding systems in flowering plants[J].Evolution,1977,31(1):32~46.
[29]龚燕兵,黄双全.传粉昆虫行为的研究方法探讨[J].生物多性,2007,15(6):576~583.
[30]王若涵.木兰属生殖生物学研究及系统演化表征探析[D].北京林业大学,2010.
[31]Eevin G N,Wetzel R G.Allelochemical autotoxicity in the emergent wetland macrophyte Juncus effusus (Juncaceae).[J].American Journal of Botany,2000,87:853~860.
[32]Andersson S,Dobson H E.Behavioral foraging responses by the butterfly Heliconius melpomene to Lanatana camara floral scent.[J].Journal of Cheemical Ecology,2003,29:2303~2318.
[33]Majetic C J,Raguso R A,Ashman T L.The sweet smell of success:Floral scent affects pollinator attraction and seed fitness in Hesperis matronalis.[J].Functional Ecology,2009,23:480~487.
[34]Dieringer G,Espinosa J E.Reproductive ecology of Magnolia schiedeana (Magnliaceae),a threatened cloud forest trees species in Veracruz,Mexico.[J].Bulletin of Torrey Botanical Club,1994,121:154~159.
[35]Dieringer G,Lara M,Reyes-Castillo L,et al.Beetle pollination and floral thermogenicity in Magnolia tamanlipana (Magnliaceae).[J].International Journal of Plant Sciences,1999,160:64~71.

