大气CO2浓度和温度升高对紫花苜蓿生物量及其分配的影响
袁 晖,何显平,兰立达,李德文*
(1.四川省林业调查规划院,四川 成都 610081;2.广元市规划建设和住房局风景名胜管理处,四川 广元 628000)
气候变化是当今人类所面临的最重大挑战之一。自工业化时代以来,人类活动所排放的温室气体持续增加,全球地表温度逐步增加,导致了全球气候变化。随之而来的是积雪消融、海平面上升、环境污染、生物多样性丧失和沙漠化加剧。CO2是主要的温室气体之一,其浓度已由工业化前时代的约280 μmol· mol-1增 加到 2005 年的 379 μmol·mol-1。根据IPCC第四次评估报告(2007)预测,随着世界人口和经济发达程度的增加,预计本世纪中后期的大气 CO2浓度将达到560 μmol·mol-1~700 μmol·mol-1;到2100年全球表面大气平均温度将增加1℃ ~4.5℃[1]。
温度是控制生物生化反应的关键环境要素,尤其在生物酶活性方便面。尽管光合作用合成的碳水化合物要转移到植物的根、茎、叶等器官储存还要经历许多的生理过程,但是从众多的已有试验中均证实:CO2浓度的升高导致光合作用的增强,对农作物生物量的增加有促进作用[2]。当CO2浓度升高是,水稻和小麦的产量升高约40%、玉米升高15%[3]。但也有学者认为温度升高将对作物产量起到负效应[4]。在不考虑CO2作用的前提下,温度升高超过2.5℃,稻谷、小麦、玉米的产量持续下降[5]。到目前为止,关于CO2和温度升高交互作用对农作物产量影响方面的研究还不多[2]。已有的研究发现,高温、高 CO2条件下水稻总生物量提高 23% ~37%[6]。但是,Prasad等(2007)发现温度升高将会减弱CO2升高对作物增产的效果[7]。
紫花苜蓿(Medicago sativa)是重要的豆科牧草植物,具有营养价值高、适口性好、适应性强等特点,在全世界范围内分布广泛。在我国,紫花苜蓿也是许多农牧区的首选草种。有研究表明,CO2倍增促进紫花苜蓿对光能的吸收,提高光合作用[8,9]。但迄今为止,关于CO2倍增和温度升高交互作用条件下紫花苜蓿生物量及分配的研究鲜有报道。因此,研究CO2浓度和温度升高对紫花苜蓿的生物量积累及其分配的影响,将有助于深入全面了解全球气候变化对牧草产量及其可食性生物量比例的影响,为农作物对气候的响应提供基础数据。
1 材料与方法
1.1 植物-气候模拟生长室系统
植物-气候模拟生长室系统建立在中国科学院成都生物研究所茂县山地生态研究站(31°41'07″N,103°53'58″E,海拔1820 m)。该站地处青藏高原东缘横断山系北段高山峡谷地带的岷江上游中部,年均气温8.6℃,年均相对湿度82%,年均降水量919.5 mm,年均蒸发量795.8 mm,年均日照时数1139.8 h,年无霜期200 d左右。
独立、自控和封顶的生长室由下部近似圆柱体和上部近似球缺两部分构成,其主体骨架为不锈钢矩管和圆管。下部圆柱体由11个面构成(宽1.0 m,高 2.0 m),用 8 mm的浮法玻璃(透光率约85%)密封。生长室上部球缺高1.5 m,用10 mm的双层中空PC板(透光率约80%)密封。生长室底面面积约9.4 m2,内部总体积约24.5 m3。生长室内光合有效辐射相当于生长室外的57%。通过上位计算机、下位控制模块和相关的软硬件控制,使生长室内CO2浓度、温度达到试验设计要求,其详细的环境要素信息见文献[10]。
1.2 试验材料
2010年3月,将紫花苜蓿种子播种于装满当地耕地土壤的塑料花盆内(容积为10 L),置于自然环境状态下萌发。2010年5月中旬,将花盆内多余的紫花苜蓿幼苗去除,保证每盆内的健壮幼苗数为1株(大小相对均匀),然后把花盆移入植物-气候模拟生长室系统的生长室内进行CO2浓度和温度升高处理。整个实验处理期间,保证土壤水分对紫花苜蓿生长不形成胁迫,也不向土壤施加肥料。
1.3 实验处理
本实验采用2因素完全随机设计,即两种CO2浓度(环境 CO2浓度,约 350 ±40 μmol·mol-1;环境 CO2浓度加倍处理,约700 ±20 μmol·mol-1)×两种温度(环境温度、环境温度+2.2℃)。本实验共计4个处理:对照(CON)、CO2浓度升高(EC)、温度升高(ET)以及二者同时升高(ECT)。连续处理时间为2010年5月中旬至9月中旬,共计4个月。
1.4 测定指标与方法
实验处理结束后,采用全收获法分别测定每株的根、茎、叶生物量。各组分生物量在70℃下烘干至恒重后再称量。文中所有生物量均以干重表示。
根冠比(root to shoot ratio,R/S)=单株根生物量/单株地上生物量(g·g-1)。
源汇重比(leaf weight to non-leaf weight ratio,Wsource/Wsink)=单株叶生物量/单株非叶生物量(g·g-1)。
利用率(Use ratio)=单株茎、叶根生物量/单株总生物量(g·g-1)。
1.5 数据处理
所有数据的统计分析与制图采用SPSS和Sigmaplot软件完成。
2 结果与分析
2.1 生物量积累
大气CO2浓度升高对紫花苜蓿根、茎、叶及其总生物量的累积有极显著促进作用(P<0.001)。其中,根、茎、叶及其总生物量分别比对照增加了92.3%,512.0%、405.1%和277.9%(表1和表2)。
温度升高也能显著促进紫花苜蓿茎、叶和总生物量的累积(P<0.001)。其中,茎、叶及其总生物量分别比对照增加了122.0%、121.4%和58.4%。但是,对根的生物量积累有一定的负效应,比对照的根生物量降低了1.9%(表1和表2)。
CO2浓度和温度同时升高对紫花苜蓿的茎、叶、根及其总生物量的累积有显著的促进作用(P<0.05)。其中,茎、叶、根及其总生物量分别比对照增加了848.3%、710.0%、59.9%和419.6%(表1和表2)。

表1 4种实验处理下的紫花苜蓿生物量积累Table 1 Biomass of M.sativa under elevated CO2and temperature treatments
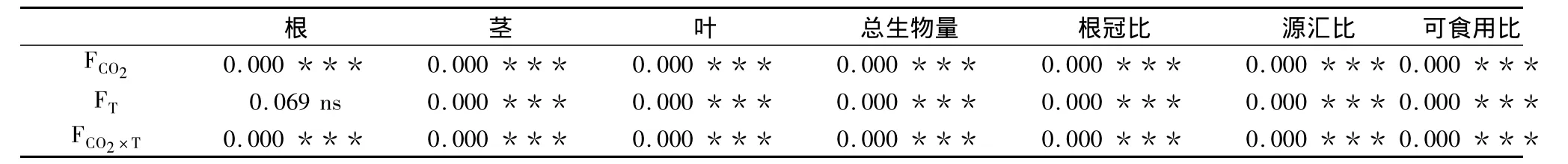
表2 4种处理对紫花苜蓿根、茎、叶、总生物量、根冠比、源汇比和可食用比影响的统计显著性Table 2 Statistical significance of single and interactive effects of elevated CO2,elevated temperature on root,stem,leaf,total biomass,R/S,Wsource/Wsinkand Use ratio based on two-way ANOVA
2.2 生物量分配
CO2浓度升高条件下,紫花苜蓿的R/S显著降低了65.7%,但Wsource/Wsink和Use ratio分别提高了45.7%和51.2%(P<0.05)(图1和表2)。
与对照相比,温度升高使 R/S显著降低了55.2%,而 Wsource/Wsink和 Use ratio分别提高了57.3%和39.3%(P<0.05)(图1和表2)。
CO2浓度和温度升高的交互作用下,R/S显著降低了82.3%,而 Wsource/Wsink和 Use ratio增加了77.7%和72.4%(P<0.05)(图1和表2)。

图1 CO2浓度升高和温度升高条件下的紫花苜蓿根冠比、源汇比及可食用比Fig.1 The R/S,Wsource/Wsinkand Use ratio of M.sativa under elevated CO2and temperature R/S,根冠比;Wsource/Wsink,源汇比;Use ratio可食用比
3 结论与讨论
Körner(2006)报道,CO2浓度加倍处理的植物生物量增加率在50%以下,即使是生长条件相当好的农作物,一个生长季节的生物量增加率大约也只有30%[11]。本研究的结果与上述研究结果一致。CO2浓度对生物量的增加效应也受其他因子的影响。如Kimball等(2002)的整合分析显示,在正常N供应条件下C3植物的生物量增加幅度为17%;高N供应条件下生物量的平均增加幅度为19%[3]。而在N供应不足的情况下,植物生物量的平均增加幅度仅为3%。紫花苜蓿是豆科植物,具有菌根,有较好的固氮能力,因此,CO2浓度升高带来的施肥效应并不受氮的限制。对红豆草的研究发现高CO2浓度下生物量的增加与固氮量的增加有关[12]。
有研究认为温度升高将对作物产量起到负效应[4]。Wada等人利用OTC模拟增温对高山植物生长和生物量的影响,结果发现芽的生长和生物量对模拟增温的响应在不同物种间存在明显的差异[13]。紫花苜蓿在温度升高的条件下,叶和总生物量增加。温度升高将会减弱CO2浓度升高对作物的增产效果[7],但是高温、高CO2浓度条件下水稻总生物量提高23% ~37%[6]。在高CO2浓度条件下,温度升高2℃对紫花苜蓿的生物量累积有促进作用。这样的差异主要由于温度敏感性和植物生长发育的最佳温度存在着种间差别[14]。在一些草原植物C3种类的研究中,Lilley等(2001)报道在温度和CO2浓度升高的共同作用下,植物体的营养需求增加导致根系生长的加强[15]。在CO2浓度升高和温度升高交互作用条件下,紫花苜蓿的R/S减少比例远高于CO2浓度升高和温度升高单独作用的情况。同时,交互作用下,紫花苜蓿的可使用比增加最高。
总之,大气CO2浓度升高和温度升高单独作用将显著提高紫花苜蓿生物量累积;在交互作用下更有利于生物量积累,也更有利提高可食用比(地上部分)。本研究是在实验室控制条件下进行的盆栽试验,主要集中于一个生长季的生长情况。由于盆栽条件和试验时间短,本研究结果用于判断气候变化对较长时间、较大空间尺度的影响是困难的。所以需要进一步进行野外试验是非常必要的,尤其是多因子共同作用的研究。
[1]IPCC(Intergovernmental Panel on Climate Change.The physical science basis.//Solomon S,Qin D,Manning M,Chen Z,MarquisM,Averyt KB,Tignor M,Miller HL(eds)Contribution of working group I to the fourth assessment report of the intergovernmental panel on climate change.Cambridge University Press,2007.
[2]房世波,沈斌,谭凯炎,等.大气[CO2]和温度升高对农作物生理及生产的影响[J].中国生态农业学报,2010,18(5):1116~1124.
[3]Kimball B A,Kobayashi K,Bindi M.Responses of agricultural crop to free air CO2enrichment.Advances in Agronomy,2002,77:293~368.
[4]Michael H.2007.Climate takes aim.Nature,446:706 ~707.
[5]Polley H W.Implications of atmospheric and climate change for crop yield and water use efficiency.Crop Science,2002,42:131 ~140.
[6]De Costa W A J M,Weerakoon W M W,Herath H M L K.Physiology of yield determination of rice under elevated carbon dioxide at high temperatures in a subhumid tropical climate.Field Crops Research,2006,98(1):336 ~347.
[7]Prasad P V,Boote K J,Allen L H.Species,ecotype and cultivar differences in spikelet fertility and harvest index of rice in response to high temperature stress.Field Crops Research,2006,95:398 ~411.
[8]张其德,卢从明,冯丽洁,等.CO2加富对紫花苜蓿光合作用原初光能转换的影响[J].植物学报,1996,38(1):77~82.
[9]董志新,韩清芳,贾志宽,等.不同苜蓿(Medicago sativa)品种光合速率对光和CO2浓度的响应特征[J].生态学报,2007,27(6):2272~2278.
[10]张远彬,王开运,乔云周.研究高寒区植物生长过程对气候变化响应的封顶式生长室系统[J].应用与环境生物学报,2007,13(5):601 ~608.
[11]Körner C.Carbon limitation in trees.Joural of Ecology,2003,91:4-17.
[12]周正朝,上官周平.红豆草与土壤氮含量对大气二氧化碳浓度升高的响应[J].应用生态学报,2006,17(11):2175~2178.
[13]Wada N,Shimono M,Miyamoto M.Warming effects on shoot developmental growth and biomass production in sympatric evergreen alpine dwarf shrubs Empetrum nigrum and Loiseleuria procumbens.Ecological Research,2002,17(1):125 ~132.
[14]Coleman J S,Bazzaz F A.Effects of CO2and temperature on growth and resource use of co-occurring C3and C4annuals.E-cology,1992,73:1244 ~1259.
[15]Lilley J M,Bolger T P,Peoples M B,Gifford R M.Nutritive value and the nitrogen dynamics of Trifolium subterraneum and Phalaris aquatica under warmer,high CO2conditions.New Phytologist,2001,150:385 ~395.

