日本血吸虫重组抗原rSjGALE对小鼠的免疫保护效果分析
曹宇凡,乔洪宾,刘萍萍,杨云霞,石耀军,李 浩,刘金明,林矫矫,金亚美
(中国农业科学院上海兽医研究所 农业部动物寄生虫重点实验室,上海 200241)
血吸虫病(Schistosomiasis)是一种分布广泛、危害严重的人畜共患寄生虫病,威胁亚洲、非洲及拉丁美洲的76个国家和地区,感染人数达两亿,是仅次于疟疾的重要热带疾病[1,2]。目前吡喹酮是该病唯一高效的大规模治疗药物,但已有抗药性的相关报道,并且药物治疗无法控制重复感染[3],因此急需开发研制新的高效的疫苗和治疗药物。近几年的研究发现,一些重组蛋白抗原,可以产生高达50%左右的减虫率,说明血吸虫疫苗的研制具有可行性[4,5]。
UDP-葡萄糖表异构酶(GALE)在生物体中参与葡萄糖代谢的催化作用,是主要参与催化这一过程的三种酶之一(另两种为半乳糖激酶,半乳糖-1-磷酸尿苷酰转移酶)[6-8],它催化UDP-葡萄糖和UDP-半乳糖之间的可逆反应。GALE还参与细胞壁上多种糖化物的合成,如LPS、EPS等[9-11]。在果蝇和锥虫等模式生物中,GALE蛋白对生长发育具有重要影响[12,13];在人体内,该蛋白的缺失引起代谢异常,导致半乳糖血症[14]。曼氏血吸虫和日本血吸虫体内也存在GALE蛋白[15,16],本实验室前期工作中发现日本血吸虫GALE主要存在于虫体表膜,这可能与血吸虫通过皮肤转化宿主能量有关[17]。
206佐剂(montanide ISA 206)是一种新型佐剂,乳化时不需添加其他乳化剂即可与水相稳定结合,对硬件设备要求低,方便操作且对抗原的机械破坏小,故此类佐剂应是未来佐剂的发展方向[18]。
本实验室前期已经就rSjGALE重组蛋白的免疫保护效果和类型经行了评估,证实rSjGALE与弗氏佐剂联合免疫能够获得良好的保护效果[17]。但由于弗氏佐剂对宿主有一定的损伤作用,易形成局部结节和无菌性脓肿[19],为寻求更适宜的免疫保护方案,本研究着重评估rSjGALE重组蛋白与206佐剂联合免疫的保护效果,为SjGALE的功能和实际应用研究奠定基础。
1 材料和方法
1.1 实验材料虫株及实验动物由中国大陆株日本血吸虫尾蚴由上海兽医研究所农业部动物寄生虫学重点实验室保存;6周龄 BALB/c小鼠(SPF级)购自中国科学院上海实验动物中心。Agrose购自上海生工生物工程公司;Bacto-yeast extract、bactotryptone购自 OXOID 公司;Ni-NTA His Resin购自QIAGEN公司;辣根过氧化物酶(HRP)标记的羊抗小鼠 IgG 购自鼎国生物公司;HRP标记羊抗小鼠IgE购自AbD Serotec公司;206佐剂由SEPPIC公司提供。
1.2 rSjGALE重组蛋白的表达采用实验室前期冻存表达菌种。前期构建的pET-SjGALE质粒,由SjGALE CDS基因全长序列(GenBank:AY815833,1056 bp)与 pET28b连接,并转化至BL21(DE3)感受态细胞[17]。
复苏冻存菌种,于固体培养基划线培养,37 ℃温箱过夜。挑取数个阳性菌落小量表达,37 ℃培养,当 OD600达 0.4~0.6 时加入终浓度为 1 mmol/L IPTG诱导表达,收集菌体蛋白。SDS-PAGE分析,采用表达量最高的菌株大量表达,收集可溶性重组蛋白,并使用Ni-NTA His-Bind Resin参照说明书纯化。
1.3 小鼠的免疫保护试验6~8 w 龄雄性 BALB/c 小鼠随机分成免疫组和对照组,每组10只。免疫组皮下注射 rSjGALE(50 μg)与206佐剂混合物,对照组皮下注射 PBS与206佐剂混合物。佐剂油相与水相的比例为54:46,冰浴超声乳化,4℃静置30 min不分层后使用。每隔2 w免疫1次,共免疫3次。第3次免疫后14 d,每只小鼠经腹部皮肤贴片攻击感染40±2条日本血吸虫尾蚴,攻虫38 d后,剖杀小鼠,收集血清,以肝门静脉灌注法收集虫体并计数,收集肝脏并分别计算减虫率和减卵率。重复试验攻虫后42 d剖杀。
1.4 免疫保护效果评估以肝门静脉灌注法收集虫体并计数:
减虫率=(1 -实验组虫体数目/对照组虫体数目)×100%
虫卵计数:剖杀小鼠,取肝脏称重,置于50 mL离心管内加去离子水适量,匀浆机匀浆后定容至20 mL,取 1 mL 匀浆液和 10% NaOH 等体积混合,37 ℃消化约30 min,消化过程中不时混匀并少量取样观察,待消化完全后,光学显微镜下计数虫卵,重复3次取平均值:
减卵率=(1-实验组卵胚数目/对照组卵胚数目)×100%
虫卵孵化:取4 mL匀浆液加入烧瓶中,加入去氯水至瓶颈上3~5 cm,液面上塞入薄层棉花(避免气泡产生),棉花上方再轻轻加入适量去离子水,26~27℃孵化 2 h,将棉花上层 8 mL 液体转移至 15 mL尖底离心管中,加入1~2滴碘酊固定染色毛蚴,4000×g 4℃离心 5 min,吸去大部分上清,剩余液体定容至2 mL,显微镜下计数毛蚴,重复3次取平均值:
孵化率 = 毛蚴总数/卵胚总数
减孵化率=(1-实验组孵化率/对照组孵化率)×100%
1.5 特异性抗体水平检测IgG检测:于小鼠一免、二免、三免后的2 w收集血清,间接ELISA检测各个时期IgG抗体水平。以纯化的重组蛋白SjGALE (10 μg/ mL)包被96孔板,收集血清1:100稀释后作为一抗,羊抗小鼠IgG(1:5000)为二抗,检测抗体水平。IgE检测:于小鼠一免、二免、三免后的d 10收集血清,利用间接ELISA的方法检测各个时期IgE抗体效价。以纯化的重组蛋白SjGALE (10μg/mL)包被96孔板,收集血清1:100稀释后作为一抗,羊抗小鼠IgE(1:1000)为二抗,检测抗体水平。
2 结果
2.1 重组蛋白rSjGALE原核表达纯化及抗原性分析pET-SjGALE质粒在大肠杆菌 BL21(DE3)中,加入IPTG终浓度 1 mmol/L诱导表达。SDS-PAGE分析显示重组蛋白为40 kDa(图1)。裂解液上清经纯化获得较纯的重组蛋白(图2)。

图1 pET-SjGALE在大肠杆菌BL21(DE3)中表达产物的SDS-PAGE分析Fig.1 SDS-PAGE analysis of cell extracts and fractions from E.coli BL21(DE3)

图2 纯化的pET-SjGALE重组蛋白SDS-PAGE分析Fig.2 SDS-PAGE analysis of the purifi ed recombinant protein pET-SjGALE
2.2 动物免疫保护试验为了考察rSjGALE的免疫保护效果,对三免2 w后的小鼠进行攻击感染,在攻虫后38/42 d剖杀小鼠,利用肝门静脉灌注的方法冲虫并收集虫体,统计虫体数目,同时收集并处理小鼠肝脏,统计肝虫卵数目,并孵化虫卵、统计毛蚴孵出情况。第一次实验中取得每只雌虫对肝脏荷卵贡献下降13.7%,毛蚴孵化减少49.01%;第二次实验中肝脏荷卵减少51.5%。其余数据 p-value 过高,组间差异度不够,未参考(表1)。
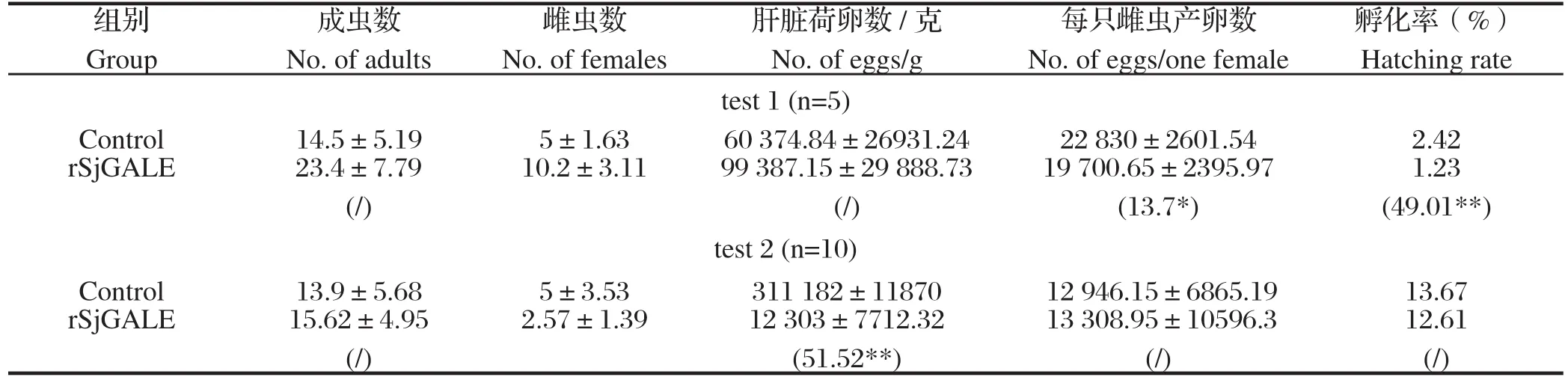
表1 两次免疫保护结果分析Table 1 Protective levels of BALB/c mice immunized with rSjGALE in two experiments
2.3 血清抗体水平IgG抗体水平检测结果表明,实验组与佐剂对照组相比,二免后抗体水平即大幅升高(图3)。IgE抗体水平检测结果表明,IgE水平在二免后也缓慢升高(图4)。
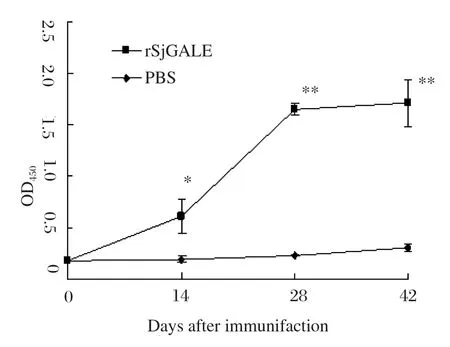
图3 rSjGALE蛋白免疫小鼠后特异性抗rSjGALE IgG抗体检测Fig.3 Analysis of specifi c anti-rSjGALE IgG induced in mice immunized with rSjGALE

图4 rSjGALE蛋白免疫小鼠后特异性抗rSjGALE IgE抗体检测Fig.4 Analysis of specifi c anti-rSjGALE IgE induced in mice immunized with rSjGALE
3 讨论
前期实验结果表明,rSjGALE重组蛋白可以与抗日本血吸虫全虫抗体发生特异性反应,具有良好的抗原性;以rSjGALE免疫小鼠所得血清也具有良好的反应原性。rSjGALE与弗氏佐剂联合免疫小鼠诱导产生了较好的免疫保护效果,尤其是对雌虫产卵能力有一定抑制效果;对抗体水平和细胞因子的分析表明rSjGALE诱导宿主产生对寄生虫病有保护作用的Th1型免疫反应[17]。
根据UDP-葡萄糖表异构酶在其他物种中的研究,我们认为SjGALE参与日本血吸虫生长代谢过程,为血吸虫的生长发育提供能量。前期研究表明SjGALE的表达在感染宿主23 d即开始排卵时达高峰[17],可能与成熟雌虫排卵时需要大量能量有关,这应该与在免疫保护实验中表现的导致雌虫产卵能力下降有关系。
我们分析了rSjGALE与206佐剂联合应用后在减虫率、减卵率、雌虫对肝脏荷卵率的贡献降低及减孵化率的情况。此次免疫保护单位肝脏减卵率达51.52%,和使用弗氏佐剂相当;每条雌虫对肝脏荷卵的贡献率降低13.7%,低于弗氏佐剂试验结果的66.2%,59.5%[17];我们还发现rSjGALE免疫动物体内肝脏虫卵的孵化率降低为49.01%,这方面的研究在弗氏佐剂实验中未涉及。抗体水平检测发现,IgG水平自二免后显著升高,IgE水平也缓慢升高。IgE水平对寄生虫病的有保护性作用[20],能够激活巨噬细胞,诱发细胞毒反应[21,22]。有实验证明,血吸虫感染42 d大鼠的血小板被动至正常同系受体,在攻击感染的当日即导致高度的保护作用;但若血吸虫感染42 d的大鼠血液经IgE固相免疫吸附后,其促进正常血小板毒性的能力则消失[23]。现已证明特异性IgE抗体与抗血吸虫病再感染能力呈正相关[24,25],因此在血吸虫候选疫苗抗原的研究中,能否刺激机体产生IgE抗体是一个重要指标。本实验中IgE二免后即与对照组产生显著差异,这应与rSjGALE提供的免疫保护有关。两次实验中虫卵孵化率的差别,可能来源于攻虫后剖杀天数的不同。血吸虫虫卵产出后还需约10 d左右才能成熟,所以42 d比38 d应有更多成熟虫卵,因此第二次实验比第一次实验虫卵孵化率高。
日本血吸虫雌虫日产卵500~3500个,部分卵沉积在肝脏形成肉芽肿,严重破坏肝组织,是造成宿主病理损害的主要原因,虫卵排出体外也是造成血吸虫病传播的主要根源。因此,减少产卵和降低虫卵的孵化对血吸虫病病理损害的减轻和传播的阻断具有重要意义[26]。rSjGALE不仅能够明显降低宿主肝脏中虫卵数目,且降低虫卵的孵化能力,可能在抗血吸虫病传播中发挥一定的作用。
[1]龚震宇, 杨小平.全球血吸虫病流行概况[J].疾病监测,2011, 26(6): 504.
[2]宋红霞, 薛晓东.日本血吸虫病的危害与诊治[J].科技信息, 2009, (30): 698.
[3]吴月英, 宁安.血吸虫对吡喹酮抗药性的研究现状[J].中国人兽共患病学报, 2009, 25(1): 83.
[4]Tran M H, Pearson M S, Bethony J M,et al.Tetraspanins on the surface of Schistosoma mansoni are protective antigens against schistosomiasis[J].Nat Med, 2006, 12(7):835-40.
[5]Cardoso F C, Macedo G C, Gava E,et al.Schistosoma mansoni tegument protein Sm29 is able to induce a Th1-type of immune response and protection against parasite infection[J].PLoS Negl Trop Dis, 2008,2(10): e308.
[6]Leloir L F, Trucco R E,et al.The co-enzyme of phosphoglucomutase[J].Arch Biochem, 1948, 19(2): 339.
[7]Frey P A.The Leloir pathway:a mechanistic imperative for three enzymes to change the stereochemical configuration of a single carbon in galactose[J].Faseb J,1996,10(4): 461-470.
[8]Kresge N, Simoni R D, Hill R L,et al.Leloir and the biosynthesis of saccharides[J].J Biol Chem, 2005,280(19): 158-160.
[9]Canter Cremers H C, Batley M, Redmond J W,et al.Rhizobium leguminosarum exoB mutants are deficient in the synthesis of UDP-glucose 4' -epimerase[J].J Biol Chem, 1990, 265(34): 21122-21127.
[10]Boels I C, Ramos A, Kleerebezem M,et al.Functional analysis of the Lactococcus lactis galU and galE genes and their impact on sugar nucleotide and exopolysaccharide biosynthesis[J].Appl Environ Microbio, 2001, 67(7):3033-3040.
[11]Nakao R, Senpuku H, Watanabe H.Porphyromonas gingivalis galE Is Involved in Lipopolysaccharide O-Antigen Synthesis and Biofilm Formation[J].Infect Immun, 2001, 74(11): 6145-6153.
[12]Sanders R D, Sefton J M, Moberg K H,et al.UDP-galactose 4'-epimerase (GALE) is essential for development of Drosophila melanogaster[J].Dis Model Mech, 2010, 3(9-10): 628-638.
[13]Urbaniak M D, Turnock D C, Ferguson M A.Galactose starvation in a bloodstream form Trypanosoma brucei UDP-glucose 4'-epimerase conditional null mutant[J].Eukaryot Cel, 2006, 5(11): 1906-1913.
[14]Novelli G, Reichardt J K, Molecular basis of disorders of human galactose metabolism: past, present, and future[J].Mol Genet Metab, 2000, 71(1-2): 62-65.
[15]Liu F, Lu J, Hu W,et al.New perspectives on hostparasite interplay by comparative transcriptomic and proteomic analyses of Schistosoma japonicum[J].PLoS Pathog, 2006, 2(4): e29.
[16]Berriman M, Haas B J, LoVerde P T,et al.The genome of the blood fluke Schistosoma mansoni[J].Nature, 2009,460(7253): 352-358.
[17]Liu P, Shi Y, Yang Y,et al.Schistosoma Japonicum UDP-Glucose 4-Epimerase Protein Is Located on the Tegument and Induces Moderate Protection against Challenge Infection[J].PLoS One, 2012, 7(7): e42050.
[18]贾英, 王晓蒙, 张建春.206佐剂乳化工艺的研究[A].首届中国兽药大会-兽医生物制品学、兽医微生物学学术论坛论文集[C].2008, 372-376.
[19]潘杭君, 孙红祥.免疫佐剂的研究进展[J].中国兽药杂志,2004, 38(1): 32-37.
[20]沈继龙, 张元和.IgE在寄生虫感染中的保护作用[J].国外医学(免疫学分册), 1986, (1): 11-14.
[21]Capron A, Dessaint J P, Capron M,et al.Specific IgE antibodies in immune adherence of normal macrophages to Schistosoma mansoni schistosomules[J].Nature, 1975,253(5491): 474-475.
[22]Joseph M, Capron A, Butterworth A E,et al.Cytotoxicity of human and baboon mononuclear phagocytes against schistosomula in vitro: induction by immune complexes containing IgE and Schistosoma mansoni antigens[J].Clin Exp Immunol, 1978, 33(1): 48-56.
[23]Smith M A, Clegg J A, Snary D,et al.Passive immunization of mice against Schistosoma mansoni with an IgM monoclonal antibody.Parasitology, 1982, 84(1):83-91.
[24]Hagan P, Blumenthal U J, Dunn D,et al.Human IgE,IgG4 and resistance to renfection with Schistosoma haematobium[J].Nature, 1991, 349(6306): 243-245.
[25]Dunne D W, Butterworth A E, Fulford A J,et al.Immunity after treatment of human schistosomiasis:association between IgE antibodies to adult worm antigens and resistance to reinfection[J].Eur J Immunol,1992, 22(6): 1483-1494.
[26]刘萍萍.日本血吸虫抱雌沟蛋白相互作用分子的鉴定及两个相关蛋白的研究[D].北京: 中国农业科学院, 2011.

