马立克氏病病毒RB1B株UL14蛋白原核表达及多抗血清制备
徐文财,刘 秋,秦爱建,,胡序明,,吴庚华,孙 苹,钱琨,,邵红霞,,金文杰,
(1.扬州大学教育部禽类预防医学重点实验室,扬州 225009;2.扬州大学江苏省动物预防医学重点实验室,扬州 225009)
马立克氏病病毒(Marek's disease virus, MDV)是一种致肿瘤性疱疹病毒,能够引起皮肤和内脏肿瘤,侵害中枢神经系统,导致易感鸡的瘫痪或死亡[1,2]。UL14蛋白是MDV编码的一种被膜蛋白,而被膜是MDV病毒粒子的重要组成部分。在1型单纯疱疹病毒(Herpes simplex virus 1,HSV1)中,UL14不仅具有抗凋亡作用[3],还具有热休克蛋白(Host shock protein,HSP)功能并可以调节病毒的复制[4,5]。通过氨基酸序列分析发现,MDV UL14蛋白与HSV UL14蛋白同源,推测MDV的UL14也可能在病毒复制和转化中扮演着关键角色。通过基因芯片技术研究发现感染RB1B 毒株21 d后的SPF鸡胸腺组织中,UL14高水平表达[6],这种表达的意义和作用是什么还不清楚。目前在MDV感染中还没有UL14功能的相关报道。为了弄清UL14在MDV感染中所起的作用,特别是UL14对MDV致瘤性是否有影响,本研究对UL14进行原核表达并制备特异性多抗,为以后UL14功能研究提供生物材料。
1 材料与方法
1.1 病毒 菌株与细胞RB1B超强毒株、E.coliDH5α、BL21(DE3)工程菌由扬州大学教育部禽类预防医学重点实验室保存,CEF细胞按实验室常规方法制备。
1.2 载体与主要试剂原核表达载体pGET32a购自Clontech公司;pGEM-T easy载体、T4连接酶购于美国Promega公司;凝胶回收DNA试剂盒购于德国AXYGEN公司;限制性核酸内切酶EcoR I、XhoI购自Fermentas公司;碱性磷酸酶(AP)标记的羊抗鼠IgG、IPTG、胰蛋白酶均购自Sigma公司。
1.3 引物设计与合成根据RB1B株UL14基因序列(GI:148806278)设计引物。为了便于目的基因的克隆,在上游引物中加入EcoR I 酶切位点,下游引物中加入XhoI 酶切位点。上游引物序列为5'-CCGAATTCATGTTTGCAGTGAGCGC-3',下游引物为5'-TTCTCGAGTCATACACAGCTGTCTGA GA-3',划线部分为引入的酶切位点。
1.4 UL14基因的扩增与克隆参照文献[7]报道的方法,从感染RB1B的CEF细胞中提取病毒DNA基因组。UL14基因的 PCR 扩增条件:95℃ 5 min;94℃ 1 min ,55℃ 1 min,72℃ 2 min,30 个循环;72℃ 10 min。PCR产物经凝胶回收后连入pGEM-T载体,并送上海英骏生物技术公司(Invitrogen)测序。
1.5 原核表达载体的构建将测序正确的pGEM-T-UL14重组质粒与 pET32a质粒 DNA 经EcoR I和XhoI双酶切,酶切产物电泳,回收相应的UL14片段与pET32a空载体片段,然后进行连接、转化,次日挑取单菌落制备质粒DNA,然后再利用EcoR I和XhoI双酶切,用1%琼脂糖凝胶电泳筛选正确插入目的基因的重组质粒。
1.6 UL14蛋白的原核表达将含有pET32a-UL14重组质粒的细菌接种于含氨苄青霉素的LB液体培养基中,37℃ 200 rpm 震荡培养 12 h,然后以 1:100 转接种到含有氨苄青霉素的2YT培养基中培养3 h,再加入 IPTG 至终浓度为 1 mmol/L,28℃ 180 rpm 震荡培养培养5 h,同时设未诱导的重组质粒转化菌作为对照。取出培养物,超声波裂解后,经12%SDSPAGE电泳分析鉴定,并用His亲和层析柱纯化。
1.7 鼠抗融合蛋白UL14多抗血清的制备将4只BALB/c小鼠分别腹腔注射纯化的融合蛋白,免疫剂量为每只100 μg蛋白,首次免疫后,每隔2 w以相同的方法和剂量进行加强免疫。小鼠4免10 d后分别采血分离血清。
1.8 Western blot鉴定参照文献[8]报道的方法。转印后用5%脱脂乳4℃封闭过夜。分别用抗UL14小鼠多抗血清和His单抗稀释后作为一抗,37℃作用1 h。然后用AP标记的羊抗鼠IgG作为二抗,37℃作用1 h。用NBT避光显色20 min,最后用ddH2O终止反应。
1.9 IFA鉴定鼠抗融合蛋白UL14多抗血清的反应性用96孔细胞板培养RB1B感染的CEF细胞,约5~6 d后进行免疫荧光试验。分别用抗UL14小鼠多抗血清和ICR小鼠血清作为一抗,37℃作用1 h。然后用FITC标记的羊抗鼠IgG作为二抗,37℃作用1 h。最后每孔加50%甘油100 uL,并在荧光显微镜下观察结果。
2 结果
2.1 重组质粒pGEM-T-UL14与pET32a-UL14的鉴定PCR扩增目的基因,经1%琼脂糖凝胶电泳鉴定,结果扩增出条带大小为732 bp的片段。经连接、转化后,挑取白色菌落扩大培养,用碱裂解法提取质粒DNA,用EcoR I和XhoI双酶切,经1%琼脂糖凝胶电泳鉴定,结果获得了载体(2900 bp)和目的基因(732 bp)两个片段,与预期结果相符。将胶回收的UL14基因片段与pET32a空载体片段转化后得到pET32a-UL14重组质粒,并用EcoR I和XhoI双酶切重组质粒,经电泳后结果可见清晰的750 bp左右和5900 bp左右两条带,即获得了正确插入目的基因的重组质粒,且目的基因测序结果正确。
2.2 His-UL14融合蛋白的SDS-PAGE和Western blot分析将重组质粒pET32a-UL14转化的BL21(DE3)大肠杆菌,经培养和诱导表达,菌体裂解物上清在分子量55 kDa处出现高表达条带,与His-UL14融合蛋白分子量一致(图1A),而未诱导组无此条带(图1B)。用His亲和层析柱纯化表达的融合蛋白,然后分别用抗His标签的单抗和抗UL14多抗血清进行Western blot检测,结果显示,抗His标签单抗能特异性地识别出55 kDa的蛋白条带(图2A),并且多抗血清也能特异性地识别出55 kDa的蛋白条带(图2B)。
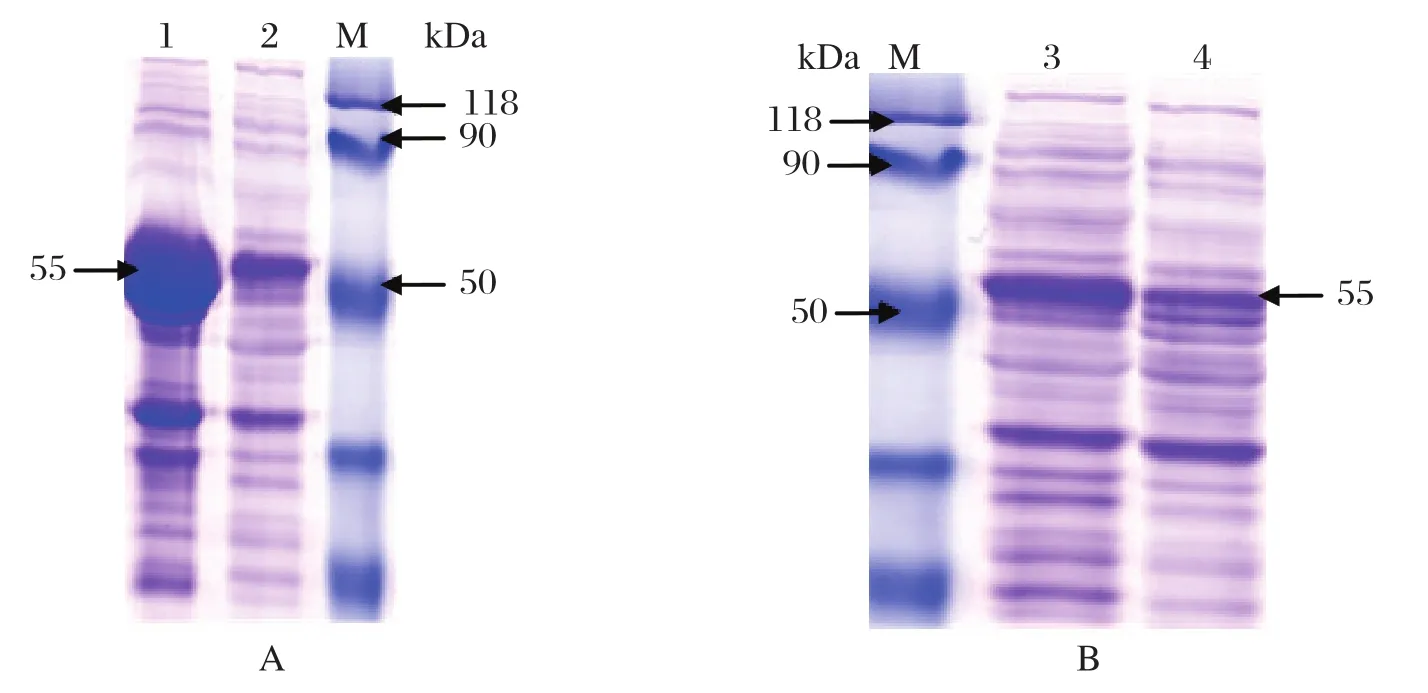
图1 UL14蛋白的SDS-PAGE电泳图Fig.1 SDS-PAGE graph of recombinant UL14
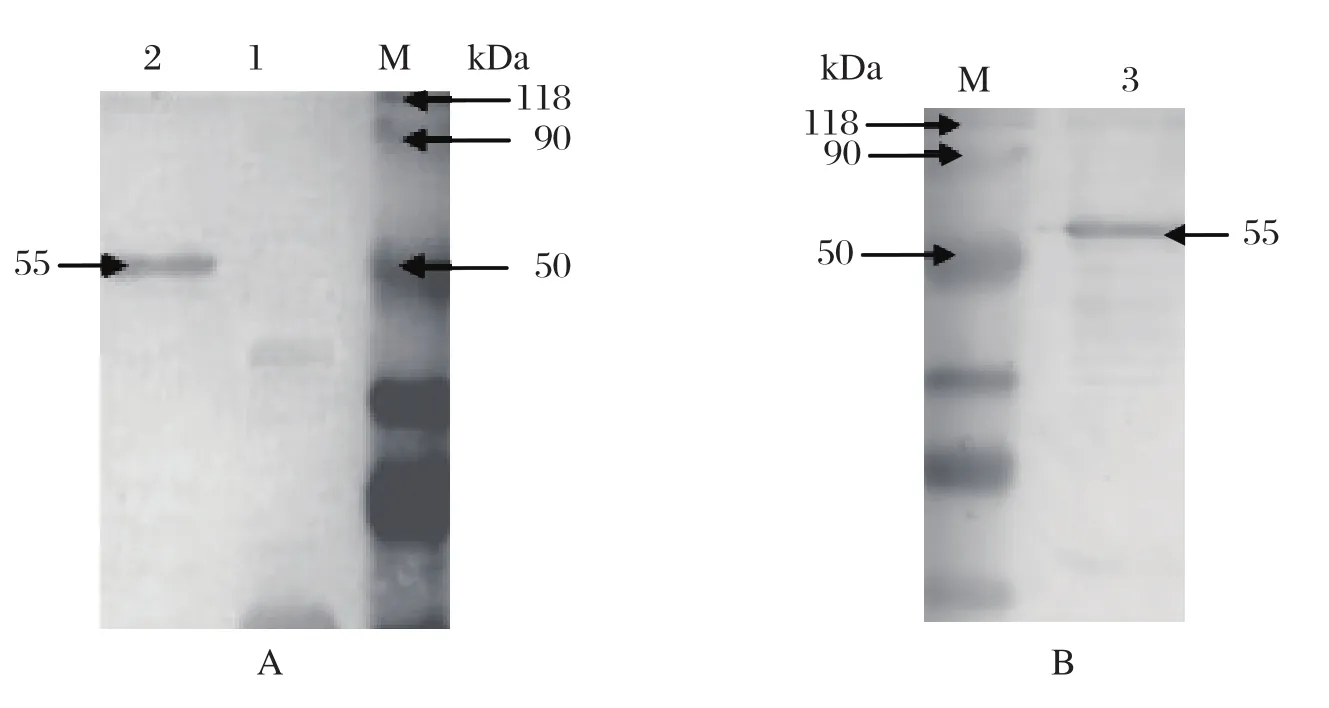
图2 表达产物的Western blot分析Fig.2 Recombinant UL14 protein identifi ed by Western blot
2.3 免疫荧光分析用 RB1B 感染 CEF 细胞 5~6 d,然后以抗UL14多抗血清作1:200稀释后进行间接免疫荧光试验,结果在感染MDV的细胞中出现特异性荧光(图3A),而对照正常细胞则没有出现特异性荧光(图3B),结果证实用此融合蛋白免疫BALB/c小鼠后获得的多抗血清能与MDV RB1B感染的CEF细胞发生特异性反应。
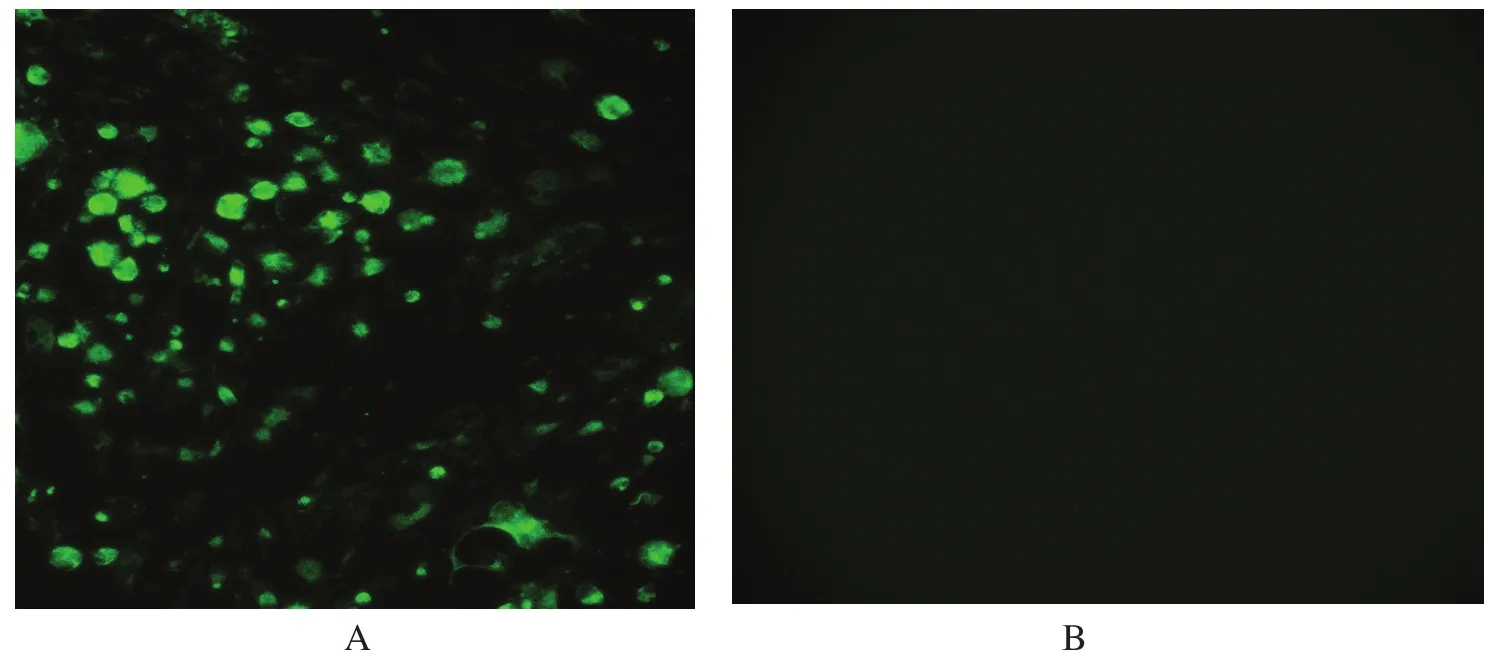
图3 RB1B感染CEF细胞后的免疫荧光分析Fig.3 Immunofl uorescence analysis of CEF cells infected with MDV strain RBIB
3 讨论
UL14蛋白在人单纯疱疹病毒方面研究较多,而在MDV方面则没有相关报道。本研究对MDV UL14蛋白进行了原核表达,并成功制备了抗UL14多抗血清,该抗血清与MDV天然的UL14有良好反应性,研究结果对进一步研究MDV致病机理提供了可靠的生物材料。
被膜蛋白是MDV病毒粒子的重要组成。通过对被膜蛋白功能及其相互作用关系的了解,可以使我们更好地了解MDV装配途径,并为寻找新的抗病毒靶序列标提供了思路[9]。UL14蛋白是疱疹病毒编码的一种被膜蛋白。MDV UL14蛋白与HSV UL14蛋白同源。HSV UL14蛋白能够集中衣壳蛋白VP26和组装蛋白UL33进入到细胞核内[10]。在感染细胞中,尤其在感染的后期,UL14蛋白对HSV的复制起到非常重要的作用[4],因此,MDV UL14蛋白在MDV致病过程中也可能扮演着重要作用。通过Real-Time PCR检测发现,在MDV感染后d 7、d 14、d 21、d 28 胸腺组织中,Meq 与 UL14 的表达趋势是一致的[6],二者之间是否存在相互作用协同致肿瘤有待进一步试验证实。
[1]Davison F, Nair V.Use of Marek's disease vaccines:could they be driving the virus to increasing virulence?[J].Expert Rev Vaccines, 2005, 4(1): 77-88.
[2]Osterrieder N, Kamil J P, Schumacher D,et al.Marek's disease virus: from miasma to model[J].Nat Rev Microbiol, 2006, 4(4): 283-294.
[3]Yamauchi Y, Daikoku T, Goshima F,et al.Herpes simplex virus UL14 protein blocks apoptosis[J].Microbiol Immunol, 2003, 47(9): 685-689.
[4]Yamauchi Y, Kiriyama K, Kubota N,et al.The UL14 tegument protein of herpes simplex virus type 1 is required for efficient nuclear transport of the alpha transinducing factor VP16 and viral capsids[J].J Virol,2008, 82(3): 1094-1106.
[5]Yamauchi Y, Wada K, Goshima F,et al.Herpes simplex virus type 2 UL14 gene product has heat shock protein(HSP)-like functions[J].J Cell Sci, 2002, 115(Pt 12):2517-2527.
[6]Hu X, Qin A, Miao J,et al.Transcriptional profile of Marek's disease virus genes in chicken thymus during different phases of MDV infection[J].Arch Virol, 2013.
[7]张晨飞, 秦爱建, 邓绪方, 等.马立克氏病病毒Ⅰ型CVI988/Rispens疫苗株UL13激酶结构域分析及其偏嗜密码子片段在大肠杆菌中的表达[J].微生物学报, 2009,(2): 161-167.
[8]秦爱建, 崔治中.应用亲和层析法提纯鸡马立克氏病病毒pp38基因重组产物[J].生物工程学报, 1994(3): 239-243.
[9]Vittone V, Diefenbach E, Triffett D,et al.Determination of interactions between tegument proteins of herpes simplex virus type 1[J].J Virol, 2005, 79(15): 9566-9571.
[10]Yamauchi Y, Wada K, Goshima F,et al.The UL14 protein of herpes simplex virus type 2 translocates the minor capsid protein VP26 and the DNA cleavage and packaging UL33 protein into the nucleus of coexpressing cells[J].J Gen Virol, 2001, 82(Pt 2): 321-330.

