番鸭细小病毒NS1基因的克隆与原核表达
董嘉文,孙敏华,李林林,袁建丰,邝瑞欢,胡奇林
(广东省农业科学院动物卫生研究所 广东省兽医公共卫生公共实验室,广州 510640)
番鸭细小病毒病多发生于1~3周龄的雏番鸭,又称为“三周病”,它是由番鸭细小病毒(Muscovy duck parvovirus,MPV)引起的以呼吸困难、腹泻、脚软以及进行性消瘦为主要症状的番鸭疫病[1,2]。番鸭细小病毒(MPV)属于细小病毒科细小病毒属,其基因组为单链线性 DNA,基因组全长为5132 bp,包含两个主要开放阅读框架(open reading frame, ORF),两个 ORF 位于同一读码框内[3]。左侧ORF编码非结构蛋白NS(NS1、NS2),编码二者基因的起始密码子的位置不同,但共用同一终止密码子。NS1基因含有1884个核苷酸,编码628个氨基酸,NS1蛋白参与病毒对细胞的毒性作用、病毒复制及基因表达[4]。NS2 蛋白能促进NS1蛋白对细胞的毒性作用[5]。现已证明NS1蛋白具有与ATP结合、ATPase活性、解旋酶活性等功能[6]。右侧 ORF 编码病毒3种结构蛋白分别是VP1、VP2 和VP3。目前关于番鸭细小病毒的研究主要集中在病毒的结构蛋白上,而对非结构蛋白的研究较少[7-9]。因此,本研究扩增了MPV NS1基因,进行了克隆和序列分析,并成功表达和纯化了具有生物学活性的NS1蛋白,为MPV诊断试剂盒、基因工程疫苗与NS1蛋白的结构、功能研究奠定了基础。
1 材料与方法
1.1 病毒 菌株 质粒和试剂MPV 佛山分离株(MPV FS)、MPV 多克隆抗体、大肠埃希菌工程菌株 DH5α、Rosseta 感受态细胞、pET32a ( + )质粒,均为广东省农业科学院动物卫生研究所保存。BamH Ⅰ、XhoI 、T4 DNA 连接酶和 MiniBest病毒RNA/DNA抽提试剂盒购于宝生物工程有限公司;DNA凝胶回收试剂盒购和小量质粒提取试剂盒购于天根生物科技有限公司;预染蛋白质Marker为Fmentas公司产品,兔抗鸭IgG为Nordic公司产品。
1.2 引物设计根据 MPV FM 株 NS1基因序列(GenBank:U22967), 利用 primer 5.0软 件 设计一对NS1基因的特异性引物,预扩增片段长大约1900 bp,由上海英潍捷基生物技术公司合成,NS1-P1:5'-GCGGGATCCATGGCATTTTCTAGGC-3' (BamH I),NS1-P2: 5'-GCGCTCGAG TTGTTCATTCTCCATATCA -3'(XhoI)。
1.3 MPV NS1基因的PCR扩增以提取的 MPV FS株DNA为模板进行 PCR,25 μL PCR反应体系:10×ExTaqbuffer 2.5 μL,dNTPs(2.5 mM)2.0 μL,P1(10 pmol/μL)1.0 μL ,P2(10 pmol/μL) 1.0 μL,ExTaqDNA 聚合酶(5 U/μL)0.125 μL,DNA 2 μL,加 ddH2O 至 25 μL。反应条件:94℃ 预变性 5 min;94℃变性 30 s,53℃退火30 s,72℃延伸 2 min,循环 30次;最后 72℃延伸10 min,10 g/L 琼脂糖凝胶电泳分析扩增产物,回收目的片段。
1.4 目的基因的克隆与鉴定将回收的PCR产物克隆入pMD18-T-Simple 载体上,连接反应体系:pMD18-T-Simple 1 μL、NS1 基因回收片段 4 μL和 Solution I 5 μL; 16℃连接过夜后转化 DH5α 感受态细胞,将培养液涂布于含 Amp(100 mg/ L)的平板上,37℃培养过夜,挑选单个菌落进行菌落PCR,提取质粒经过双酶切鉴定正确后,将阳性克隆送上海英潍捷基生物技术公司测序。运用DNAStar 软件对测序所得的序列与MPV FM株进行相似性比较。
1.5 重组原核表达载体的构建与鉴定将测序正确的pMD18-T-NS1阳性质粒和原核表达载体 pET32a(+)分别用BamH Ⅰ和XhoI 双酶切,分别回收酶切后的NS1片段与线性化后的pET32a (+),加入T4-DNA连接酶于16℃连接过夜,并将连接产物转化DH5α 感受态细胞,将培养液涂布于含 Amp (100 mg/ L) 的平板上,37℃培养过夜,挑选单个菌落进行菌落 PCR 和酶切鉴定。
1.6 重组菌在 Rosetta中的初步表达鉴定将pET32a-NS1阳性菌液按1:100比例加入5 mL含Amp 的LB液体培养基,37℃ 180 rpm振荡培养,等OD600值到0.5~0.8 时,取 1 mL 菌液于 1.5 mL 离心管中作为诱导前对照,加入 IPTG 至终浓度为 1.0 mmol/ L,诱导5 h 停止培养。将pET32a-NS1诱导菌、未诱导pET32a- NS1 菌液以及诱导的 pET32a (+)空载体 10 800×g离心 1 min,加入 50 μL PBS 重悬菌体,然后加入2×SDS 凝胶上样缓冲液50 μL,沸水中煮10 min,10 800×g离心 1 min,取 10 μL 上清上样进行SDS-PAGE,凝胶经考马斯亮蓝染色,脱色后分析。
1.7 重组蛋白的可溶性分析按照确定的最佳诱导表达条件对100 mL pET32a-NS1 阳性菌进行诱导表达。首先将菌液 9000×g、4℃离心 10 min 收集菌体,加入20 mL PBS 重悬菌体,置冰浴中超声破裂解菌。超声完毕后 10 800×g、4℃离心 10 min,分别收集上清和沉淀,经SDS-PAGE电泳检测和凝胶经考马斯亮蓝染色,脱色后分析蛋白的可溶性。
1.8 重组蛋白的提取及纯化参照Novagen 公司的Ni-NTA His.Bind 操作说明进行,离心收集 200 mL诱导宿主菌,加入20 mL PBS 重悬菌体,置冰浴超声使菌体裂解至溶液清亮,离心弃上清,用 10 mL Binding Buffer(含 8 M 尿素)重悬菌体,冰浴 1 h后,4℃、 10 000 ×g离心 20 min,收集上清,即为溶解的包涵体。将1 mL 50%的Ni-NTA 树脂悬浮液加到10 mL细胞裂解液中,轻柔混匀,室温结合30 min,将混合液装柱;然后分别用pH值为8.0、6.3、4.5的含8 M 尿素缓冲液洗脱柱子上的蛋白,并且每次都要收集流出液,用于SDS-PAGE电泳分析。
1.9 重组蛋白的Western blot检测按照上述处理重组蛋白样品并做SDS-PAGE,随后将电泳蛋白转移至NC膜上,5V 转印1 h后,NC 膜用5%脱脂奶粉4℃封闭过夜;PBST 洗膜 3次,每次 5 min;1:50 稀释MPV 多克隆抗体,37℃孵育1 h;PBST洗膜3次,每次 5 min;加入 1:2000 稀释的 HRP 标记的兔抗鸭IgG ,37℃孵育 1 h后洗膜 3次,每次 5 min;然后用DAB显色进行分析。
2 结果
2.1 PCR 扩增MPV NS1 基因的 PCR 扩增产物电泳后,可见一条约 1900 bp 特异性的条带,与预期片段大小相一致(见图1)。运用 DNAStar 软件对测序所得的序列与MPV FM 株进行相似性比较发现:MPV FS 株 NS1 基因核苷酸序列与 MPV FM 株(登录号:U22967)相似性为99.3%,仅有13个碱基的差异;NS1 基因推导所得的氨基酸序列与以上毒株的相似性为98.4%,有10个氨基酸差异。
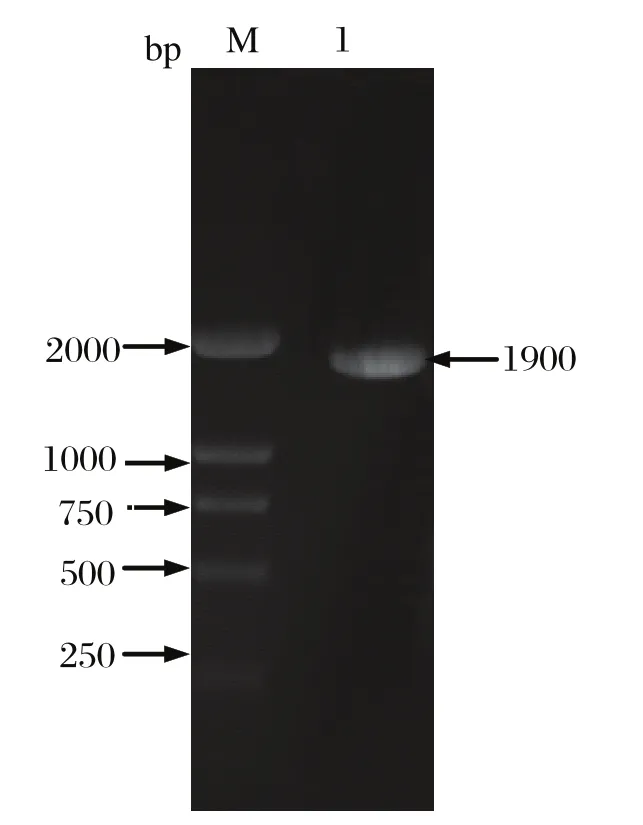
图 1 MPV-NS1 基因 PCR 扩增Fig.1 PCR-amplifi ed NS1 gene from MPV
2.2 重组表达载体的构建与鉴定将测序正确的NS1片段与表达载pET32a(+)连接,并转化至大肠杆菌Rosetta,挑取单菌落培养并提取质粒,经过BamHⅠ和XhoI 双酶切鉴定,电泳可见两条大小分别为 1900 bp 和5900 bp 清晰条带,前者为 NS1基因,后者为pET32a (+) 载体片段,说明NS1基因正确插入到表达载体中(见图2),将该重组质粒命名为pET32a-NS1。
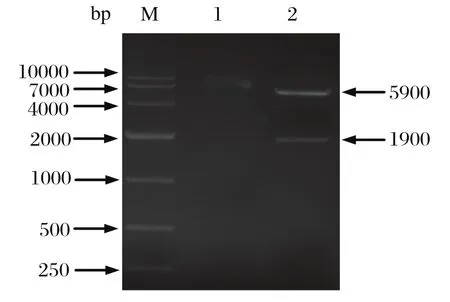
图2 pET32a-NS1 质粒酶切鉴定Fig.2 Identifi cation of recombinant plasmid pET32a-NS1 by restriction enzymes digestion
2.3 重组表达质粒的SDS-PAGE分析重组表达质粒pET32a-NS1转化大肠杆菌Rosetta,经 IPTG诱导获得高效表达。SDS-PAGE分析结果表明,大约在92 kDa处出现一条特异性蛋白条带,与预期的蛋白分子量大小一致,而对照泳道无该条带(见图3)。融合蛋白主要以包涵体形式存在于沉淀中,但上清中也有少量的融合蛋白(见图4)。
2.4 Western blot检测结果对pET32a-NS1重组蛋白进行Western blot分析,结果显示在92 kDa处出现一条特异条带,说明纯化重组蛋白在大肠杆菌中获得正确表达,并且能被 MPV多克隆抗体所识别,表明该蛋白具有良好的反应原性(见图5)。
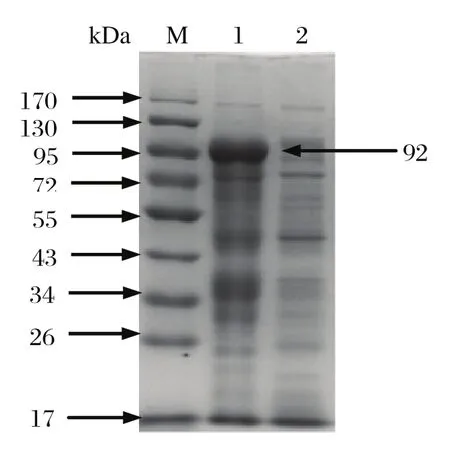
图4 pET32a-NS1表达产物的可溶性分析Fig.4 The analysis of solubility of pET32a-NS1 expression products
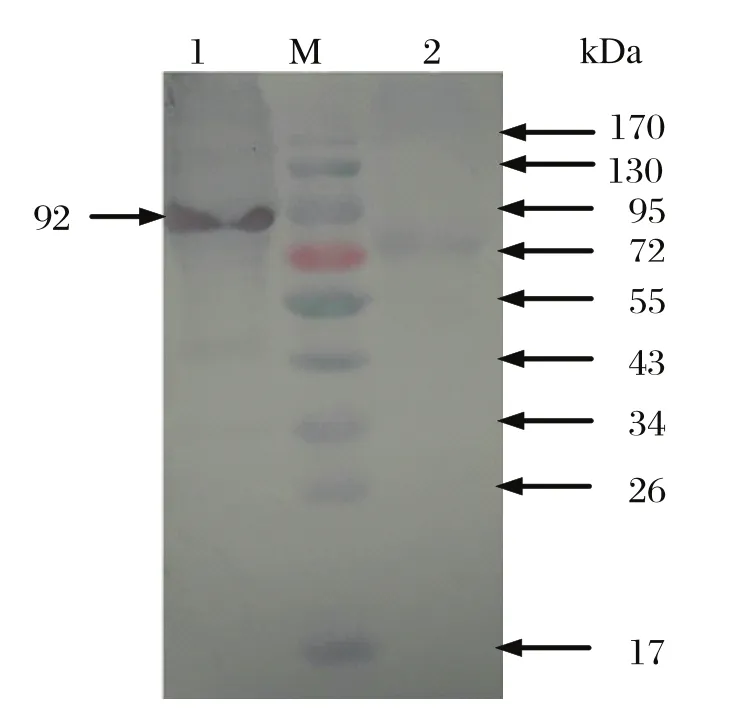
图5 pET32a-NS1表达产物的Western blot 分析Fig.5 Western blot analysis of pET32a-NS1
3 讨论
番鸭细小病毒病由林世堂等[10]学者首次报道,随后国内外学者对番鸭细小病毒的生物学特性及番鸭细小病毒病的诊断与防制进行了研究[3,11,12]。Zadori等[13]首次报道了 MPV的全基因组序列,比较分析发现MPV和GPV的基因组有81.9%同源性。张云等[14]对1株鹅细小病毒EP22和2株番鸭细小病毒DV2、J3D6株的全长基因进行测序分析,根据NS和VP1系统进化树分析表明:番鸭和鹅细小病毒来自共同的祖先,但随着宿主的不同而演化为不同的分支。MPV NS1基因编码MPV的非结构蛋白NS1蛋白,NS1蛋白是MPV基因组本身编码的一种反式激活蛋白,对于其基因组的早期和晚期的转录都具有重要作用[15]。另外,NS1蛋白参与病毒DNA的复制及调节基因表达[4]。
本研究利用PCR扩增了MPV的NS1基因片段,经过克隆和测序分析发现,MPV FS株 NS1基因核苷酸和氨基酸序列与国外的FM株的相似性高达99.3%和98.4%,表明NS1基因是高度保守的。为了分析原核表达的NS1蛋白的生物学特性,本实验构建了pET32a-NS1表达载体,并在大肠杆菌Rosetta中成功表达。本试验选择的Rosetta菌株,是携带氯霉素抗性质粒 BL21的衍生菌,能补充大肠杆菌缺乏的6种稀有密码子(AUA、AGG、AGA、CUA、CCC、GGA)对应的tRNA,从而提高了NS1基因在pET32a (+)中的表达水平。对原核表达产物的可溶性分析结果表明,表达的NS1蛋白主要以包涵体的形式存在于菌体裂解后的沉淀中。本研究中NS1蛋白在大量表达后用Ni柱进行纯化,获得的蛋白含有杂蛋白,经过改变纯化所用缓冲液的PH值,杂蛋白有所减少。今后仍需要对纯化条件进行优化,来获得高纯度的蛋白,这为MPV的诊断、抗原性分析以及蛋白的功能研究提供了基础。
[1]鲁国苗, 黄绍棠, 梁启平, 等.雏番鸭细小病毒的初步分离[J].浙江畜牧兽医, 1998, 23(3): 36-37.
[2]程由铨, 林天龙, 胡奇林, 等.雏番鸭细小病毒病的病毒分离和鉴定[J].病毒学报, 1993, 9 (3): 228-235.
[3]Le Gall-Recule G, Jestin V.Biochemical and genomic characterization of Muscovy duck parvovirus[J].Arch Virol, 1994, 139(1-2):121-131.
[4]Cotmore S F, Christensen J, Nuesch J P,et al.The NS1 Polypeptide of Murine Parvovirus Minute Virus of Mice binds to DNA Sequences Containing the Motif (ACCA)223[J].J Virol, 1995, 69(3): 1652-1660.
[5]Smith D H,Wand P, Linden R M.Comparative Characterization of REP Proteins from the Helper Dependent Adeno-Associated Virus Type 2 and the Artonomous Goose Parvovirusr[J].J Virol, 1999, 73(4):2930-2937.
[6]Pujol A, Deleu L, Nuesch J P,et al.Inhibitionof Parvovirus Minute Virus of Mice Replication by a Peptide Involved in the Oligomerzation of Nonstructural Protein NS1[J ].J Virol, 1997, 71(10): 7393-7403.
[7]娄华, 白挨泉, 顾万军, 等.番鸭细小病毒强、弱毒株VP2 基因的序列测定比较[J].病毒学报, 2001, 17(2):175-177.
[8]李雪梅, 章金刚, 向华, 等.鹅细小病毒和番鸭细小病毒核酸疫苗重组质粒的构建及表达[J].生物技术通讯,2002, 13(6): 433-435.
[9]季芳, 张毓金, 杨增岐, 等.番鸭细小病毒和鹅细小病毒广东株 VP1 基因的克隆与序列分析[J].中国预防兽医学报, 2004, 26(4): 245-247.
[10]林世棠, 郁晓岚, 陈炳钿, 等.一种新的雏番鸭病毒性传染病的诊断[J].中国畜禽传染病, 1991, (2): 26-27.
[11]吴国栋, 任祖伊, 王耐娟, 等.雏番鸭两种细小病毒病初探[J].养禽与禽病防治, 1994, (6): 910.
[12]程由铨, 胡奇林, 陈少莺, 等.番鸭细小病毒和鹅细小病毒生化及基因组特性的比较[J].中国兽医学报, 2001,21(5): 429-433
[13]Zadori Z , Stefaancsik R , Rauch T ,et al.Analysis of complete nucleotide sequence of goose and Muscovy duck parvovirus indicates common ancestral origin with adeno-associated virus [J].Virology, 1995, 212 (2): 562-573.
[14]张云, 耿宏伟, 郭东春, 等.鹅和番鸭细小病毒全基因克隆与序列分析[J].中国预防兽医学报, 2008, 30(6): 415-419.
[15]张彦鹏, 李静, 寇铮, 等.鸭细小病毒04 Nb 株的分离鉴定与rep 基因测序与分析[J].中国病毒学, 2006, 21(2):173-177.

