免疫后发病仔猪中伪狂犬病毒的分离和鉴定
童 武,张青占,郑 浩,刘 飞,姜一峰,单同领,周艳君,童光志
(中国农业科学院上海兽医研究所,上海 200241)
伪狂犬病是由伪狂犬病毒(Pseudorabies virus,PRV)引起的以发热、奇痒、脑脊髓炎为主要特征的一种烈性传染病[1]。猪是伪狂犬病毒的天然宿主、贮存者和传播者[1,2]。此病对养猪业危害极大,常在猪群中爆发流行。该病毒可感染各个年龄段的猪,主要引起妊娠母猪流产、死胎、木乃伊胎、哺乳仔猪高死亡率及种猪不育。除了使新生仔猪出现神经症状外,PRV还可以侵害免疫系统[3],使其容易继发其他疾病,如蓝耳病(porcine reproductive and respiratory syndrome,PRRS)[4]。伪狂犬最早在美国发生,我国于上世纪40年代末在猫中首次发现了伪狂犬病毒,60年代初在猪群中也出现了该病毒流行。目前,伪狂犬病毒在我国广泛流行,严重威胁着猪群的健康[5],并造成了严重经济损失[6]。
伪狂犬病毒属于疱疹病毒科甲型疱疹病毒亚科,能感染多种宿主。猪感染PRV后,有的呈隐性感染,但长期携带病毒;出现临床症状的耐过猪也能成为病毒的携带者,成为传染源,这增加了PRV防治的难度[7,8]。部分欧洲国家宣布通过接种基因缺失弱毒疫苗及相应的血清学诊断技术的监测根除了伪狂犬 (Decision 2011/648/EU, Annex I),而由于野生动物的感染与携带,欧洲大陆国家仍难以实现PRV根除[9-11]。我国也广泛使用PRV基因缺失弱毒疫苗来防控该病。但自2011年以来,许多使用gE基因缺失活疫苗免疫的规模化猪场出现了母猪产弱仔、死胎、流产,仔猪出现神经症状及死亡等疑似伪狂犬的临床症状。本实验室从江苏某疑似伪狂犬的发病猪场进行了PRV流行毒株的检测及分离鉴定,结果表明该猪场存在伪狂犬病毒野毒感染,且疫苗不能提供完全的保护。对该病毒的分离鉴定及生物特性分析,有利于进一步认清流行病毒的特征,为控制该病的传播和蔓延以及进一步研制新型疫苗打下基础。
1 材料与方法
1.1 病料病料来源于江苏省某发病猪场,该猪场接种PRV基因缺失弱毒疫苗,但出现疑似伪狂犬病症状。两头濒临死亡的7日龄新生仔猪,取其心、肝、脾、肺、肾、脑、腹股沟淋巴结、小肠及内容物和血液等病料进行反复冻融研磨离心,将上清液分装保存。
1.2 试剂 细胞 阳性血清及小鼠LATaqDNA聚合酶,dNTP mix,2×GC Buffer I,pMD18-T Vector,DL2000 DNA Marker等为宝生物工程(大连)有限公司生产;DNA提取试剂盒购自QIAGEN公司;胶回收试剂盒购自OMEGA公司;胎牛血清(fetal bovine serum, FBS) 和 DMEM 培养基为 Invitrogen公司产品;Vero细胞由上海兽医研究所猪病实验室保存,以含10% FBS的DMEM培养;PRV Barthak61疫苗株阳性猪血清、HeN1株阳性猪血清[12]及PRV经典强毒S株由中国农业科学院哈尔滨兽医研究所猪病研究室馈赠;BALB/c小鼠购自上海斯莱克实验动物有限责任公司。
1.3 引物参照 GenBank 中 PRV Becker株的全基因组序列(GenBank:JF797219),设计了分别针对gB基因和gE基因的两对引物:gB up/gB down和gE up/gE down,用于 PCR 检测 PRV。同时,设计一对引物gEF/gER,用于扩增gE全长基因序列,以作进化分析。引物均由上海捷瑞生物科技有限公司合成,引物序列如表1。
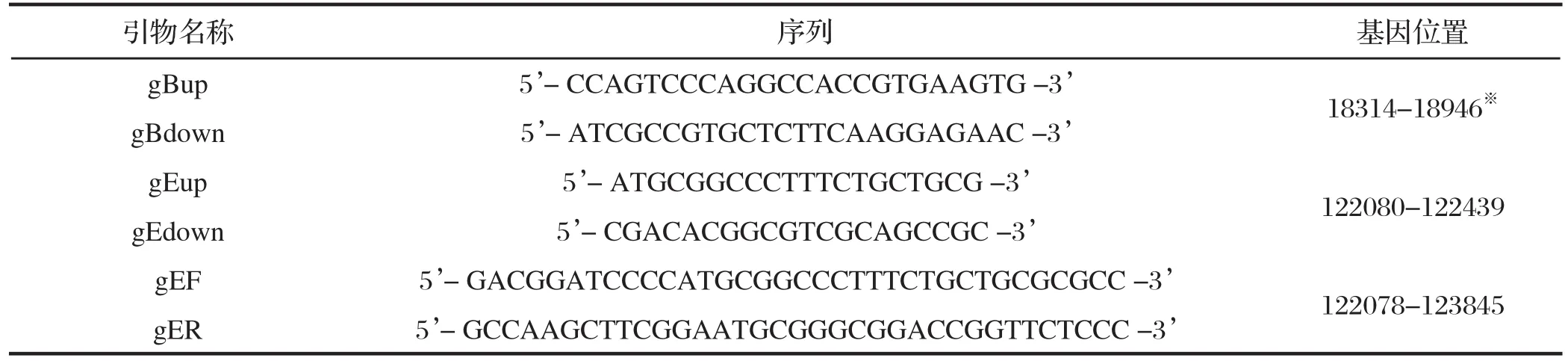
表1 用于PRV病毒鉴定和gE基因扩增的引物Table 1 The primers for detecting PRV and amplifi cation of gE gene
1.4 病毒核酸的提取及PCR参照说明书,以QIAGEN组织/细胞基因组DNA提取试剂盒提取核酸。PCR 反应体系:LATaqDNA 聚合酶(5 U/μL)0.5 μL,2×GC Buffer Ⅰ 25 μL,dNTP mixture(各 2.5 mM)8 μL,上下游引物各 1 μL,模版DNA 2μL,补水至50 μL。反应程序为:95℃预变性 5 min; 94℃ 1 min,退火 1 min,72℃延伸,35 个循环; 最后72℃延伸10 min。其中,检测gE和gB退火温度分别为64℃和68℃,延伸1 min;gE全基因扩增退火64℃,延伸2 min。用1% 琼脂糖凝胶电泳检测回收PCR 产物。
1.5 病毒的分离与纯化将PCR检测阳性病料组织研磨液经0.22 μm滤器过滤后,取0.5 mL接种单层Vero细胞,37℃孵育1 h后弃接种液,加入含2%FBS的DMEM培养液,置培养箱中培养并观察细胞病变。待70%左右的细胞发生病变时收毒,冻融后离心取上清,接种Vero细胞再传2次。提取收获液中的 DNA,以 gB up/ gB down 和 gE up/ gE down 两对引物进行PCR检测。
将收获的病毒液以DMEM作1:10稀释至10-6,稀释病毒以1 mL接种60 mm培养平皿中的融合单层Vero细胞,37℃孵育1 h后弃接种液,并以DMEM洗2次,每平皿加入12 mL覆盖培养层(含1%琼脂糖和2% FBS)。37℃培养48 h后,挑起单个空斑于0.5 mL DMEM中。空斑液反复冻融3次,以DMEM稀释并接种Vero细胞,作下一轮空斑纯化。将经过6轮空斑纯化的空斑液接种T25培养瓶中的Vero细胞,扩大培养。收获病毒液分装于1.5 mL离心管,冻存于-75℃。
1.6 IFA鉴定将分离病毒接种6孔板中的Vero细胞,36 h后,弃培养液,以预冷的80%乙醇4℃固定1 h,分别加1:500稀释的HeN1株阳性猪血清及1:200稀释的Barthak61株阳性猪血清各1 mL,37℃孵育1 h,PBS洗涤后用FITC标记兔抗猪抗体37℃孵育1 h。用DAPI(0.2 μg/mL)对细胞核进行染色后置荧光显微镜下观察。
1.7 电镜观察将病毒液以 130 000×g超速离心 2 h,以STE缓冲液重悬沉淀,用2%磷钨酸负染,在电镜下观察病毒粒子形态。
1.8 病毒滴度测定将病毒液稀释成 10-1~10-10,分别接种到96孔培养板中长成融合单层的Vero上,每个稀释度接种8孔,培养板最后两列孔接种稀释液作对照,置于37℃、5%CO2的细胞培养箱中培养,96 h后观察细胞病变,按照Reed-Muench法计算病毒的TCID50[12]。
1.9 动物试验6周龄BALB/c小鼠70只,分为两组。第一组 35只,分别接种含101.0~106.0TCID50的分离病毒稀释液,每个稀释度5只,每只腹股沟皮下注射0.1 mL。同时以5只小鼠注射DMEM培养液作为阴性对照。第二组35只小鼠,接种PRV S株,按照第一组方法进行。接种后每天观察小鼠临床症状及死亡情况,按照Reed和Muench法计算病毒的半数致死量(LD50)[13]。
1.10 病毒的遗传变异性分析提取纯化分离病毒的基因组DNA,以gEF/gER为引物,PCR扩增完整的gE基因编码区。胶回收目的片段,连接pMD18-T载体后选择阳性质粒测序,并用生物学软件进行进化分析。
2 结果
2.1 病料检测对仔猪组织匀浆液进行反复冻融,提取总DNA,用gB和gE的特异性引物进行PCR检测,结果如图1所示。在检测的8个组织中,仅脑组织样品中能扩增出与阳性对照大小相一致片段,分别为633 bp和366 bp。这显示,脑组织中可能存在PRV感染。由于该猪场使用的疫苗株缺失gE基因,gE基因阳性表明感染PRV为野毒株。
2.2 病毒的分离将PRV阳性病料组织研磨液经0.22 μm滤器过滤后,接种至单层Vero细胞,36 h后观察到了典型的细胞病变,细胞聚集、变圆、脱落,有的形成合胞体(图2)。提取DNA做PCR检测,gB up/ gB down 和 gE up/ gE down 两对引物均能扩增出特异性目的片段(图3,图4),这表明从病料中分离出的PRV为野毒株,并命名为JS-2012株。

图1 组织样品伪狂犬病毒PCR检测结果Fig.1 The results of PCR detecting samples for PRV

图2 病料脑组织匀浆上清液感染Vero细胞引起的细胞病变Fig.2 Cytopathogenic effects of Vero cells inoculated with homogenated brain tissue supernatant

图3 gB up/ down的PCR鉴定病毒结果Fig.3 PCR detecting the isolated virus with gB up/ down

图4 gE up/ down的PCR鉴定病毒结果Fig.4 PCR detecting the isolated virus with gE up/ down
2.3 病毒的IFA鉴定分离病毒感染Vero后,用PRV Barthak61株和HeN1株阳性血清做IFA检测。如图5所示,病毒感染能产生典型合胞体病变,合胞体能与PRV阳性血清作用,显示强烈荧光,这证实分离病毒确为PRV。两种血清均能和分离病毒作用,显示特异性荧光,但使用HeN1株阳性血清的荧光亮度强于Bartha k61毒株。

图5 病毒的间接免疫荧光检测结果Fig.5 IFA identifi cation of the isolated virus
2.4 病毒粒子形态将分离病毒超速离心并负染,在电镜下观察,可发现典型的伪狂犬病毒粒子形态(图6)。病毒粒子呈球形,直径在160 nm左右,有明显的核芯和正二十面体的核衣壳结构,囊膜表面有明显的放射状纤突。这进一步证实分离的病毒是伪狂犬病毒。
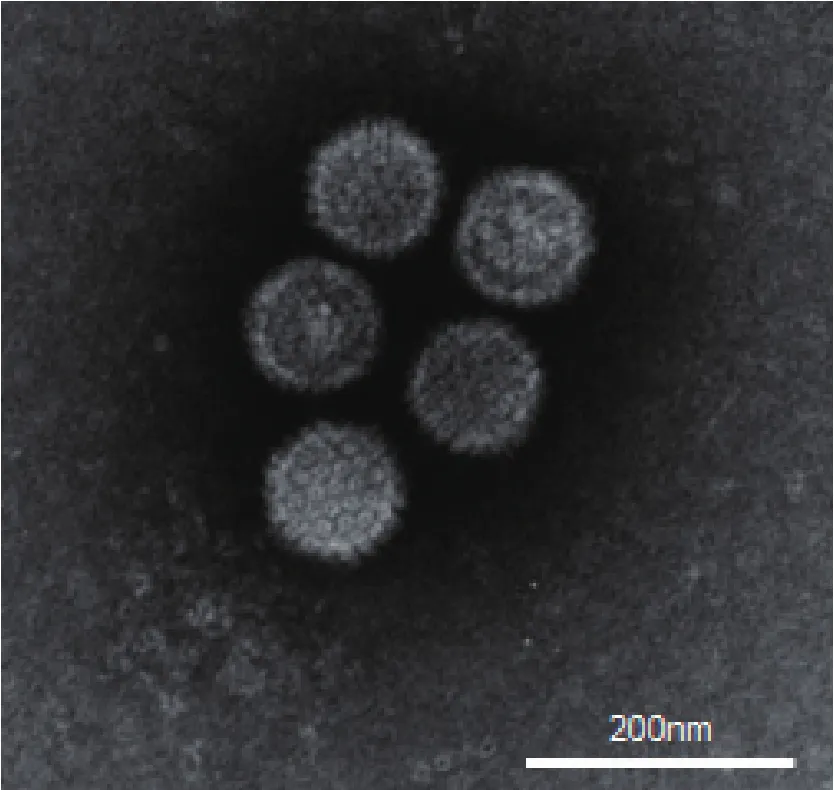
图6 病毒粒子的电镜观察Fig.6 The morphology of virions
2.5病毒滴度将纯化后的JS-2012株接种Vero细胞进行病毒扩增,以96孔板中的Vero细胞测定了病毒滴度。JS-2012株感染Vero细胞,病毒滴度可达107.43TCID50/ mL。
2.6小鼠感染试验将PRV S株和分离株JS-2012接种BALB/c小鼠,分别在d 3和d 4出现典型的伪狂犬病症状;注射部位奇痒、不断啃咬、导致皮肤出血、毛发蓬乱、脱落,并开始出现死亡。接种JS-2012 103.0~106.0TCID50的小鼠和 PRV S 104.0~106.0TCID50的都在接种后5 d内出现死亡,其后不再发病与死亡。计算两者对BALB/c小鼠的半数致死量(LD50),PRV JS-2012 株 为 102.37TCID50,PRV S 株 为 103.37TCID50。注射同等剂量DMEM培养液的对照小鼠没有异常表现。结果表明,PRV JS-2012株的半数致死量要低于PRV S经典强毒株。
2.7 病毒gE基因的扩增及其进化分析以gEF/gER为引物,扩增出了包含完整gE基因序列的约1700 bp片段(图7)。测序并分析发现gE基因全长为1740 bp。利用生物学软件DNAStar对JS-2012gE核苷酸序列与其他毒株序列进行比对,结果发现不同毒株之间同源性很高,但JS-2012和2012年新分离的毒株位于一个相对独立的分支中,而与以前分离的毒株亲缘关系相对较远(图8)。核酸序列比对发现,除Ea株外,JS-2012和其他毒株相比,存在2个位点上3个连续碱基的插入。与Ea株相比,JS-2012只在1个位置存在3个连续碱基的插入,导致在编码的氨基酸序列上增加1个冬氨酸残基,其他位置上存在不同程度的碱基替换。

图7 gE全长基因的PCR扩增结果Fig.7 PCR products of gE gene
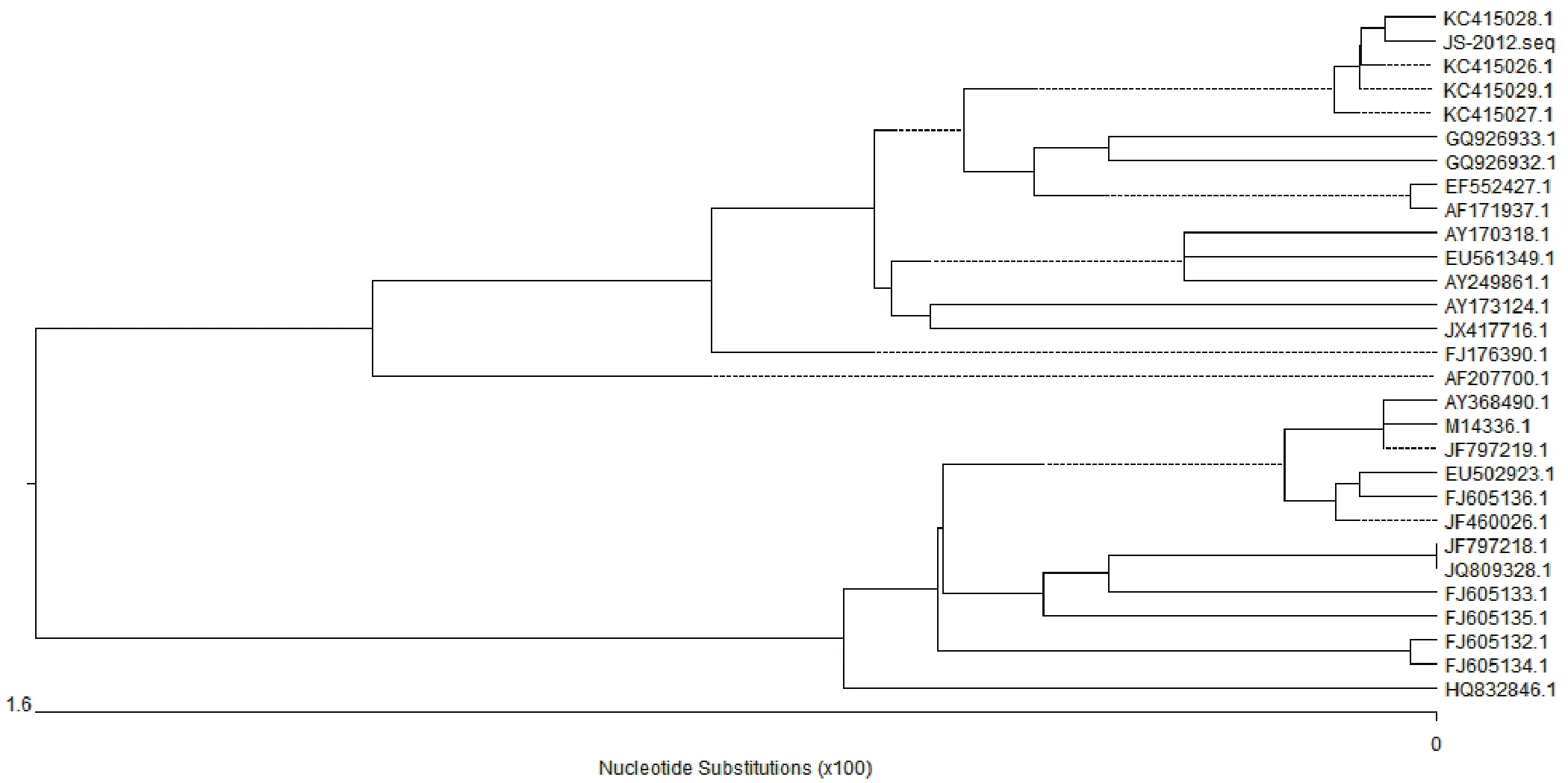
图8 PRV gE基因的进化树分析Fig.8 Phylogenetic analysis of PRV gE sequence
3 讨论
本研究通过采集PRV弱毒疫苗免疫猪场疑似伪狂犬发病仔猪病料,将PCR检测阳性病料接种细胞,并通过免疫荧光和电镜形态观察,证实从发病仔猪脑组织中分离出1株PRV野毒株,且该野毒株比PRV经典株S株对小鼠的LD50低。对gE基因的进化分析发现,该野毒株与新近分离的毒株遗传关系近,与以前分离的毒株遗传关系较远。
由于PRV基因缺失弱毒疫苗的推广应用,该病在我国猪场显著降低,也有一些国家通过接种基因缺失弱毒疫苗及相应的血清学诊断技术的监测,实现了伪狂犬根除。然而,2011年开始,我国不同省份多个猪场出现接种PRV弱毒疫苗仍发生伪狂犬的现象。2012年下半年,江苏省某猪场也发生接种基因缺失弱毒疫苗后仔猪出现疑似伪狂犬症状。我们采取了该猪场发病仔猪病料,对伪狂犬病毒、猪瘟病毒、猪繁殖与呼吸综合征病毒等常见病原进行了PCR检测,结果仅伪狂犬病毒阳性。从病料中,我们也成功分离出1株PRV野毒株JS-2012。这显示,该猪场存在PRV野毒感染而导致仔猪发病,而使用的疫苗不能提供有效保护。我们扩增了野毒株JS-2012的gE基因全序列,进化分析显示,JS-2012株与新近分离株处于一个相对独立的分支中,遗传关系近,而与以前分离株遗传关系远。这表明,与以前分离株相比,当前流行株发生一定程度变异。因此,猪场中变异株的出现,可能导致了疫苗免疫失败的发生。我们测定了JS-2012株和PRV经典毒株S株对BALB/c小鼠的LD50,结果显示,接种后JS-2012株接种组小鼠比S株组发病时间和死亡时间要晚,但JS-2012株的LD50比S株的低。这表明JS-2012株与S株对小鼠的致病特征不同,单从致死率来看,JS-2012株比S株毒力强。是否因流行株变异导致毒力增强而突破现有疫苗的保护呢?这尚不能确定。如果流行株发生重要抗原变异,也可能导致疫苗免疫失败。因此,还需要对流行株作更广泛和深入的研究,寻找病毒基因组的变异区域,研究变异给病毒毒力和抗原带来的影响,从而确定导致现有疫苗免疫失败的原因,为猪场防控PRV提供理论和技术支持。
[1]殷震, 刘景华.动物病毒学[M].2版.北京: 科学出版社,1997: 700-713.
[2]斯特劳B E, 阿莱尔S D, 蒙加林W L, 等.猪病学[M].8版.北京: 中国农业大学出版社, 2000: 195-196.
[3]冯敏燕.伪狂犬病防制的最新进展[J].国外兽医学-畜禽传染病 , 1990, (1): 7-8.
[4]Lglesias G, Trujano M, Lokensgard J,et al.Study of the potential involvement of pseudorabies virus inswine respiratory disease[J].Can J Vet Res, 1992, 56(1): 74-77.
[5]邓仕伟, 汪勇, 薛春芳.我国伪狂犬病流行现状及新特点[J].动物医学进展, 2006, 27(9): 105-107.
[6]Tamba M, Calabrese R, Finelli E,et al.Risk factors for Aujeszky's-disease seropositivity of swine herds of a region of northern Italy[J].Prev Vet Med, 2002, 54(3):203-212.
[7]Pomeranz L E, Reynolds A E, Hengartner C J.Molecular biology of pseudorabies virus: impact on neurovirology and veterinary medicine[J].Microbiol Mol Biol Rev,2005, 69: 462-500.
[8]Schoenbaum M A, Beran G W, Murphy D P.Pseudorabies virus latency and reactivation in vaccinated swine[J].Am J Vet Res, 1990, 51(3): 334-338.
[9]Pannwitz G, Freuling C, Denzin N,et al.A longterm serological survey on Aujeszky's disease virus infections in wild boar in East Germany[J].Epidemiol Infect, 2012,140(2): 348-358.
[10]Vengust G, Valencak Z, Bidovec A.Presence of antibodies against Aujeszky's disease virus in wild boar(Sus scrofa) in Slovenia[J].J Wildl Dis, 2005, 41(4):800-802.
[11]Sedlak K, Bartova E, Machova J.Antibodies to selected viral disease agents in wild boar from the Czech Republic[J].J Wildl Dis, 2008, 44(3): 777-780.
[12]彭金美, 安同庆, 赵鸿远, 等.猪伪狂犬病病毒新流行株的分离鉴定及抗原差异性分析[J].中国预防兽医学报,2013, 35(1): 1-4.
[13]Reed L J, Muench H.A simple method of estimating fifty percent endpoints[J].Am J Hyg, 1938, 27(3): 493-497.

