上海市闵行区猪场中大肠杆菌O157:H7的分离鉴定及生物学特性研究
赵秋华,王少辉,刘萍萍,姚建楠,李颖利,李蓓蓓,邵东华,史子学,魏建超,马志永
(1.上海市闵行区动物疫病预防控制中心,上海 201109;2.中国农业科学院上海兽医研究所,上海 200241)
肠出血性大肠杆菌(Enterohemorrhagic Escherichia coli,EHEC)感染可引起出血性肠炎(hemorrhagic colitis,HC)、溶血性尿毒综合征(hemolytic uremic syndrome,HUS)、 血 小 板 减少 性 紫 癜(thrombotic thrombocytopenic purpura,TTP),其中,HUS和TTP的病情严重,病死率高。EHEC引起人类致病的最常见血清型为 O157:H7,该病原菌严重威胁人类健康,已成为世界性的重要的公共卫生和食品安全问题[1,2]。1982年,该病首次在美国爆发流行,随后在加拿大、英国、意大利、日本、爱尔兰、比利时、德国、澳大利亚、阿根廷、南非、以色列等国家爆发和流行[3-6]。我国1986年首次报告大肠杆菌O157:H7感染的病例,主要在江苏省、山东省、河南省、安徽省、广西省、福建省等十几个省市发生大肠杆菌O157:H7感染的散发病例[7]。
大肠杆菌O157:H7作为一种人兽共患病原菌,可以在畜禽中流行和传播,并通过动物源性食品传染给人。调查和监测结果表明,牛、羊、猪等家畜是大肠杆菌O157:H7的天然宿主,且牛和猪是大肠杆菌O157:H7的主要宿主,阳性率高于其他动物[8]。虽然猪是大肠杆菌O157:H7的宿主,但该菌引起猪发病并不多见,多为阴性感染,但可向环境中排毒,具有潜在的食品安全隐患[9]。对上海地区猪场中大肠杆菌O157:H7进行流行病学调查,了解其毒力因子和耐药情况,有助于控制大肠杆菌O157:H7在猪场中的流行和传播,防止其经动物源性食品在人间传播。因此,本研究对采集上海地区某3个猪场猪280份样品进行大肠杆菌O157:H7分离鉴定和生物学特性研究,将对预防和控制大肠杆菌O157:H7在猪场中的流行和传播具有重要的兽医公共卫生意义。
1 材料和方法
1.1 材料
1.1.1 试剂与仪器 营养肉汤(NB)为上海科技公司产品;大肠杆菌O157显色培养基为青岛海博生物技术有限公司产品;大肠杆菌O157和H7诊断血清为宁波天润生物药业有限公司产品;细菌微量发酵管、药敏试纸均购自杭州天和微生物试剂有限公司;2×TaqPCR Master Mix 购自天根生化科技有限公司;Veriti 96 Well Thermal Cycler PCR 扩增仪购自Applied Biosystem公司;DYY-GC型电泳仪购自北京市六一仪器厂;凝胶成像仪购自Bio-Rad公司。
1.1.2 病料 2012年4~12月份分别采集上海市某三个猪场的猪粪便样品和肛拭子样品共280份。
1.2 方法
1.2.1 细菌的分离培养 将粪便样品和肛拭子样品混于 500 μL NB 培养基中,37℃培养增菌 6~8 h,划线接种于O157显色培养基上,37℃培养16~20 h,挑取疑似单菌落划线在平板上划线纯化,挑取疑似单菌落接种于LB培养基中,37℃培养6~8 h,进行下一步鉴定。
1.2.2 血清学鉴定 分别应用O157和H7单因子诊断血清与待检细菌在玻片上进行凝集反应,测定细菌的血清型。凝集试验以生理盐水作为阴性对照,以大肠杆菌O157:H7标准菌株ATCC35150作为阳性对照。
1.2.3 PCR鉴定 根据O157抗原和H7抗原编码基因(rfbE和fliC)进行双重PCR鉴定大肠杆菌O157:H7[10,11]。移取 1 mL 增菌液至灭菌 EP 管中,10 000×g离心 5 min,弃上清,然后加入 100 μL灭菌去离子水重悬沉淀,于沸水中加热10~15 min,再次10 000×g离心5 min,收集上清液,作为PCR反应模板。PCR 反应体系如下:2×PCR Master Mix 12.5 μL,引物O157-F、O157-R、H7-F、H7-R(表1)各取0.8 μL,模板(粗提DNA)2.0 μL,最后加灭菌ddH20至25 μL。同时设立阳性对照,阴性对照。PCR反应条件如下:95℃预变性5 min;95℃变性 30 s,55℃ 退火 30 s,72℃ 延伸 40 s,35 个循环;72℃ 延伸10 min。1.0%琼脂糖凝胶上电泳各样品5 μL,紫外灯下拍照,记录PCR结果。
1.2.4 生化试验 将细菌分别接种于肠杆菌微量生化管中,37℃倒置培养24 h,观察并记录结果,确定菌株的各项生化特性。
1.2.5 药敏试验 采用纸片扩散法进行药敏试验。将所保存的纯化菌株分别在37℃营养肉汤中培养18~24 h,致密划线于琼脂平板表面,用无菌镊子将药敏片贴于培养基表面,37℃培养24 h后测抑菌圈直径,根据美国临床检验标准委员(CLSI)标准判定大肠杆菌O157:H7对药敏纸片的敏感性(表2)。
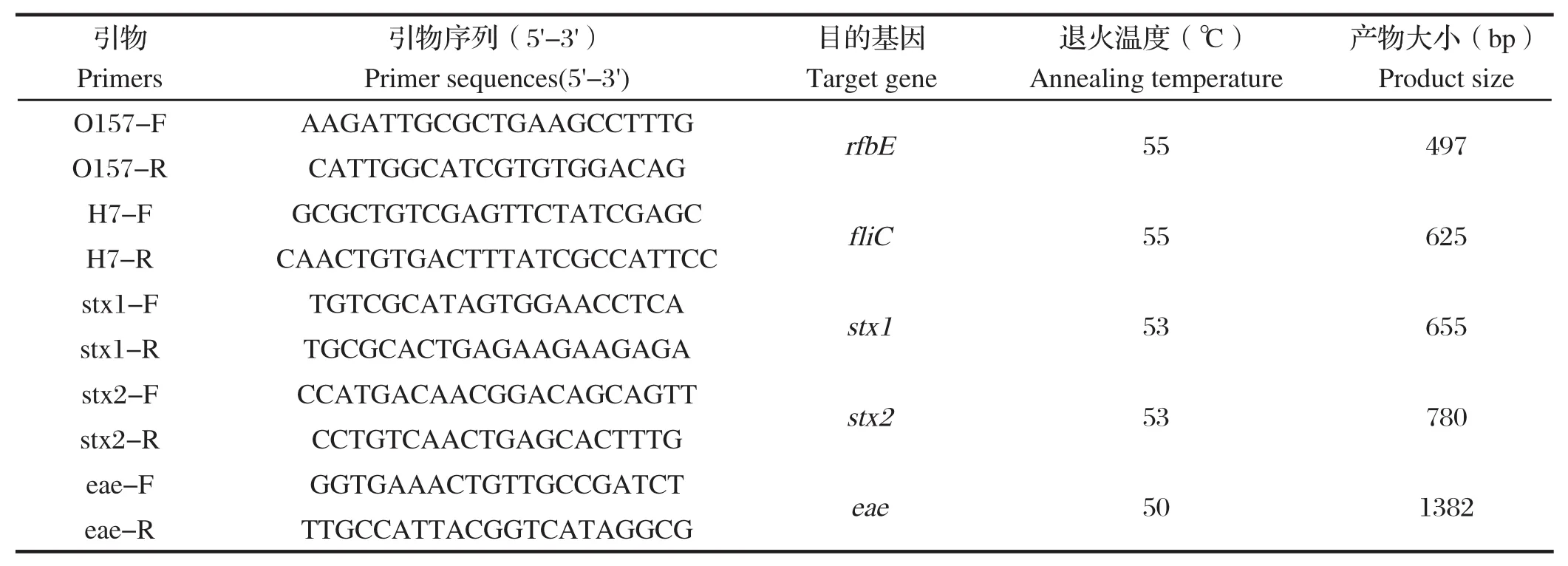
表1 大肠杆菌O157: H7特异性基因检测引物Table 1 Primers for detection of E.coli O157:H7
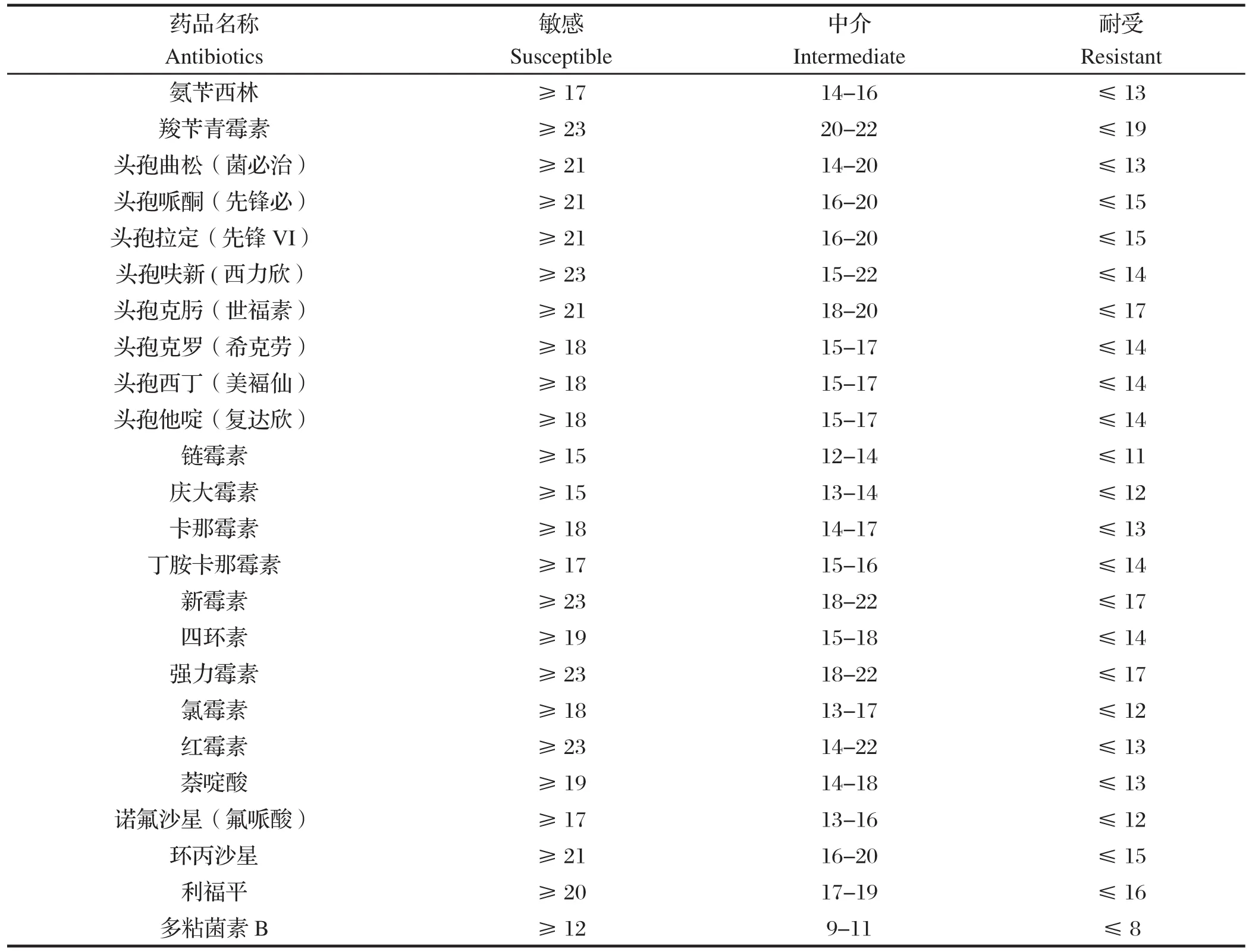
表2 药物敏感性判断标准Table 2 Primers for detection of E.coli O157:H7
1.2.6 毒力基因检测 根据大肠杆菌O157毒力基因序列分别设计并合成引物(表 1),采用PCR检测这些毒力基因在大肠杆菌中的分布。PCR反应体系:2×PCR Master Mix 12.5 μL,Primer F、R 各取1.0 μL,模板(粗提 DNA)2.0 μL,最后加灭菌ddH2O至25 μL。PCR反应参数:95℃5 min;95℃ 30 s,56℃ 30s,72℃ 30~50s,30 个循环;72℃10 min。1.0% 琼脂糖凝胶上电泳各样品 5 μL,紫外灯下拍照,记录PCR结果。
2 结果
2.1 细菌的分离培养大肠杆菌 O157:H7 在 O157 选择性培养基上呈红色、淡红色或红色菌落,菌落周围没有蓝色晕圈,其他大肠杆菌显暗蓝色、蓝色或紫色,菌落周围有蓝色晕圈;而其他细菌显蓝色、黄色或无色。280个样品经过O157选择性培养基筛选,挑取17个疑似单菌落。
2.2 大肠杆菌O157:H7的PCR鉴定采用PCR方法检测17株疑似菌株是否为大肠杆菌O157:H7,以ATCC35150菌株为阳性对照。结果表明来自于15和17号疑似菌株出现特异性条带(图1),表明该菌株为大肠杆菌O157:H7,分别命名为EHEC01和EHEC02。在检测的280个样品中,有2份细菌经PCR鉴定为大肠杆菌O157:H7,样本细菌分离率为0.71%。
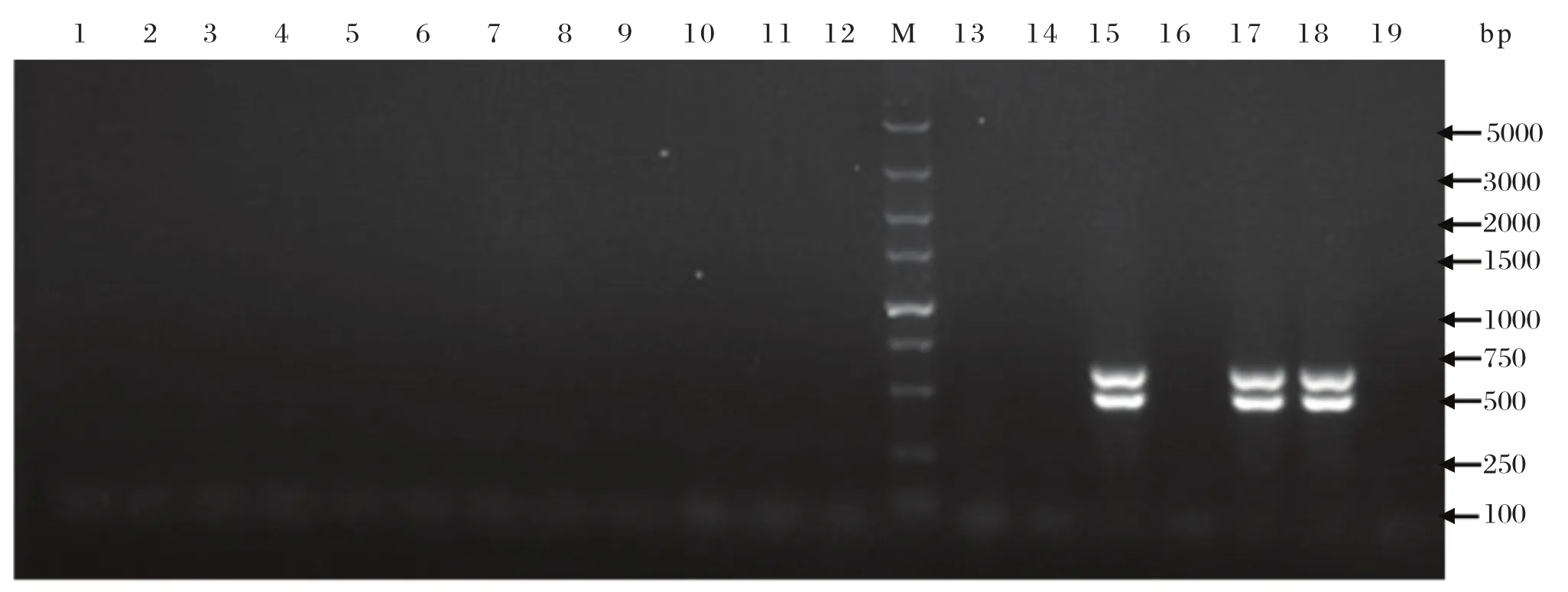
图1 大肠杆菌O157:H7 PCR检测结果Fig.1 The PCR detection of E.coli O157:H7
2.2 血清学鉴定结果对PCR呈阳性的菌株进行血清学鉴定,分别将其与O157和H7诊断血清做玻片凝集试验,结果表明该菌株与O157和H7诊断血清均出现凝集现象,而与阴性对照血清和生理盐水则均无凝集现象。凝集试验结果表明分离所得的2株细菌为大肠杆菌O157:H7,与PCR结果一致。
2.3 生化试验结果将大肠杆菌O157:H7菌株分别接种于微量生化管,培养后观察。结果表明,该细菌能够发酵葡萄糖、乳糖、麦芽糖和甘露醇;发酵蔗糖,产酸不产气;M-R试验、吲哚试验阳性;VP试验、柠檬酸盐利用试验阴性;不产生硫化氢(H2S)。以上生化结果与大肠杆菌O157:H7的生化特性相符合。
2.4 药敏试验结果选用β-内酰胺类抗生素、氨基糖苷类抗生素、四环素类抗生素、氯霉素类抗生素、大环内酯类抗生素、多肽类抗生素、氟喹诺酮类药物和利福霉素类抗菌药共24种抗菌药物对分离得到的大肠杆菌O157:H7进行药敏试验,药敏结果见表3。药敏结果表明大肠杆菌O157:H7的耐药性程度都较高,两者对24种药物的耐药性均为62.5%。而敏感药物仅有头孢西丁(美褔仙)、头孢他啶(复达欣)和丁胺卡那霉素3种。
2.5 毒力因子分布采用PCR方法对大肠杆菌O157:H7分离株的主要毒力基因(stx1、stx2和eae)进行检测,结果显示两株大肠杆菌O157:H7均含有eae基因。EHEC01分离株含有stx1基因,提示其只携带1型志贺毒素;而EHEC02分离株不携带志贺毒素基因(图2)。
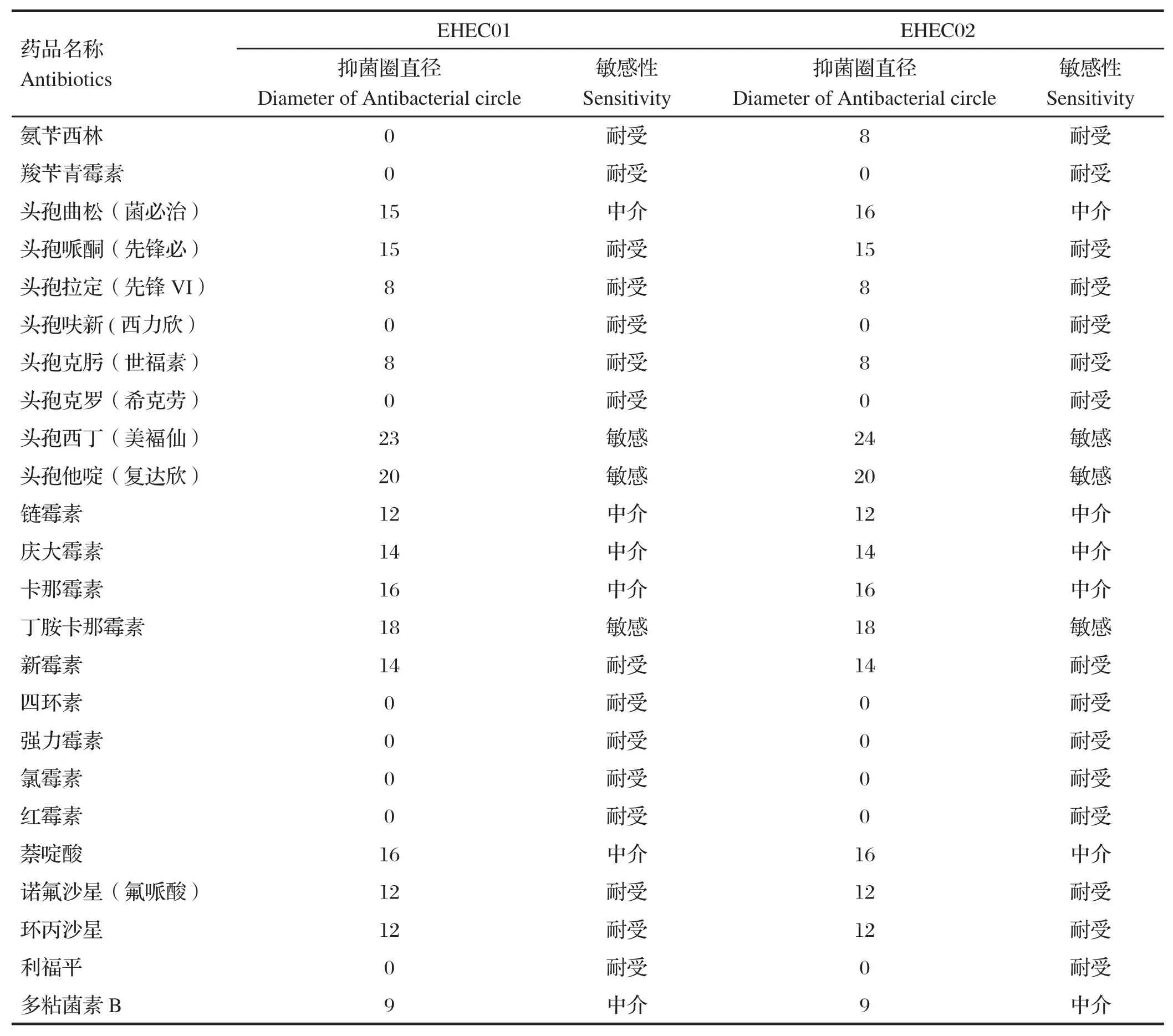
表3 大肠杆菌O157:H7的药敏试验结果Table 3 Results of antibiotic sensitivity test of E.coli O157:H7
3 讨论
近年来,由EHEC引起的食源性疾病在世界范围内许多国家都时有报道,如最近发生在德国由豆苗污染引起的EHECO104:H4暴发事件,导致2000多人感染,约数十人死亡,这次疫情对整个欧洲都造成了一定的影响[12]。EHEC主要包括O157:H7、O26:H11和 O111等血清型,其中 O157:H7是最重要的一种血清型。研究表明,家畜家禽是大肠杆菌O157:H7的主要动物宿主和传染源,其中最主要的宿主为牛,其次为羊、猪、禽类[8]。因此,本文对上海地区猪场中大肠杆菌O157:H7的分布及生物学特性进行研究,有助于控制大肠杆菌O157:H7在畜禽中的流行和传播,防止其经动物源性食品传染给人。
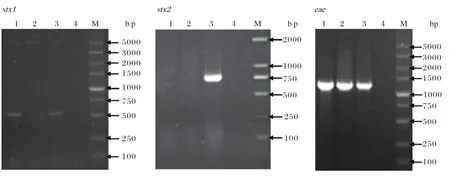
图2 毒力基因检测结果Fig.2 The results of PCR for detection of virulence genes
本文采用增菌、选择性培养基筛选、PCR鉴定的方法分析大肠杆菌O157:H7在280份猪场样品中的分布。结果从不同猪场的2份断奶腹泻仔猪的粪便样本中分离鉴定出大肠杆菌O157:H7,分离率为 0.71%(2/280)。Yan等[13]对 2005-2006年 上海奉贤区不同猪场的粪便样品中大肠杆菌O157进行流行病学调查,结果表明1.1%的样品含有大肠杆菌O157,其于分离率高的原因在于仅检测大肠杆菌 O157(包括 O157:H7 和 O157:NM)。王建等[14]检测2003-2004年上海地区动物及其产品中大肠杆菌O157:H7带菌情况,结果表明5.71%的猪粪便样品携带大肠杆菌O157:H7。顾宝柯等[15]的检测结果表明,2000-2001年上海地区猪粪便中大肠杆菌O157:H7的检出率为3.4%,其中2000年和2001年的检出率分别为1.4%和5.67%。杨丽华等[16]检测了上海市闵行区家禽畜大肠杆菌O157:H7带菌状况,猪粪中大肠杆菌O157:H7的阳性率高达9.76%。造成大肠杆菌O157:H7不同的检出率的原因可能为不同时间、不同猪场、不同采样方法。
志贺毒素(Stx1、Stx2)和紧密素(Intimin)是EHECO157的主要致病因子,其分别由stx1、stx2和eae基因编码,是判断EHEC O157菌株致病力强弱的重要因素[17]。自然界中存在的大肠杆菌O157有的产毒,而有的不产毒,它们对人的致病性有很大差异,但是表型几乎相同,用传统的血清学方法也难以分辨,本文采用简便、快速、特异的PCR方法检测分离菌株所携带的主要毒力基因进行检测,更加清楚的了解了每个菌株的毒力特性。志贺毒素是EHEC重要的毒力因子之一,具有细胞毒性、肠毒性和神经毒性,是导致感染者死亡或出现重型病症的主要原因。目前认为EHECO157:H7之所以能对人类引起如此大的危害,其主要都是志贺毒素的作用[17]。本次分离鉴定的EHECO157:H7菌株均不携带Stx2,而仅EHEC01含有Stx1,这与相关报道中的结果相比稍低[18],其原因可能由于不同来源的菌株具有不同的特性。LEE毒力岛上的重要毒力基因eae编码的紧密素是导致肠道出现典型粘附与消除损伤的主要致病因子,本次分离的两个菌株都含有eae基因,这一结果与“eae基因在EHEC菌株中广泛存在”的说法[18]是一致的。
本研究对分离的EHECO157:H7进行体外药敏试验,结果表明2株EHECO157:H7均具有很强的多重耐药性,仅对头孢西丁(美褔仙)、头孢他啶(复达欣)和丁胺卡那霉素3种药物敏感。滥用抗生素可导致细菌产生耐药性,给养猪业的疾病控制带来了极大的危害,并有可能通过食物链将耐药性基因传递给人类。由于EHEC致病机理的特殊性,滥用抗生素不仅难以控制病情,还会促进志贺毒素的释放,使其在体内发挥作用,增加了疾病的控制难度。因此,使用抗生素控制病情时,要在科学分析的基础上,选用合适的防控方法。
[1]Locking M, Cowden, J.Escherichia coli O157[J].BMJ,2009, 339: 4076.
[2]Gyles C L.Shiga toxin-producing Escherichia coli: an overview[J].J Anim Sci, 2007, 85(13 Suppl): 45-62.
[3]Day N P , Scotland S M, Cheasty T,et al.Escherichia coli O157:H7 associated with human infections in the United Kingdom[J].Lancet, 1983, 1(8328): 825.
[4]Watanabe H, Wada A, Inagaki Y,et al.Outbreaks of enterohaemorrhagic Escherichia coli O157:H7 infection by two different genotype strains in Japan, 1996[J].Lancet, 1996, 348(9030): 831-832.
[5]Albert M J, Bettelheim K A.Enterohaemorrhagic E.coli O157:H7 in central Australia[J].J Diarrhoeal Dis Res,1989, 7(3-4): 96-97.
[6]Hancock D D, Besser T E, Rice D H,et al.Multiple sources of Escherichia coli O157 in feedlots and dairy farms in the northwestern USA[J].Prev Vet Med, 1998,35(1): 11-19.
[7]王燕, 谢贵林, 杜琳.大肠杆菌O157:H7感染流行概况[J].微生物学免疫学进展, 2008, 36(1): 51-58.
[8]Ferens W A, Hovde C J.Escherichia coli O157:H7:animal reservoir and sources of human infection[J].Foodborne Pathog Dis, 2011, 8(4): 465-487.
[9]焦凤超, 李迎晓, 易本驰, 等.猪源大肠杆菌O157的分离鉴定及药敏试验[J].畜牧与兽医, 2010, 42(10): 72-73.
[10]Sanchez S, Martinez R, Garcia A,et al.Shiga toxinproducing Escherichia coli O157:H7 from extensive cattle of the fighting bulls breed[J].Res Vet Sci, 2010, 88(2):208-210.
[11]Garcia-Sanchez A, Sanchez S, Rubio R,et al.Presence of Shiga toxin-producing E.coli O157:H7 in a survey of wild artiodactyls[J].Vet Microbiol, 2007, 121(3-4): 373-377.
[12]Rohde H, Qin J, Cui Y,et al.Open-source genomic analysis of Shiga-toxin-producing E.coli O104:H4[J].N Engl J Med, 2011, 365(8): 718-724.
[13]Yan Y, Shi Y, Cao D,et al.Prevalence of Stx phages in environments of a pig farm and lysogenic infection of the field E.coli O157 isolates with a recombinant converting Phage[J].Curr Microbiol, 2011, 62(2): 458-464.
[14]王建, 沈莉萍, 刘佩红, 等.上海市动物及其产品中大肠埃希菌O157:H7带菌情况的调查[J].动物医学进展,2005, 26(4): 87-90.
[15]顾宝柯, 许学斌, 金汇明, 等.上海地区家畜、家禽及肉制品大肠杆菌O157:H7监测[J].疾病监测, 2003, 18(1):5-7.
[16]杨丽华, 许学斌, 刘继倩, 等.上海市闵行区家禽畜大肠杆菌O157:H7带菌状况监测.上海预防医学杂志[J].2004, 16(7): 309-310.
[17]Law D.Virulence factors of Escherichia coli O157 and other Shiga toxin-producing E.coli[J].J Appl Microbiol,2000, 88(5): 729-745.
[18]Seker E, Kuyucuoglu Y, Sareyyupoglu B,et al.PCR detection of Shiga toxins, enterohaemolysin and intimin virulence genes of Escherichia coli O157:H7 strains isolated from faeces of Anatolian water buffaloes in Turkey[J].Zoonoses Public Health, 2010, 57(7-8): 33-37.

