钙调神经磷酸酶信号通路在骨骼肌运动适应作用中的研究进展
郭兴武,滕育松
钙调神经磷酸酶信号通路在骨骼肌运动适应作用中的研究进展
郭兴武,滕育松
系统的运动训练能促使运动骨骼肌的形态结构产生一系列的变化。例如骨骼肌体积增大、增粗,肌纤维类型的转变等。导致这一系列变化的内源性机制有很多,钙调神经磷酸酶信号机制就是其中一种。目前对钙调神经磷酸酶信号调节机制的研究已经得到了广大学者的认可。进一步探讨钙调神经磷酸酶在运动骨骼肌适应变化中的作用,对于深刻了解钙调神经磷酸酶信号机制有重要意义。
钙调神经磷酸酶;骨骼肌;适应
骨骼肌不仅是调节人体物质代谢的重要器官,而且还可以对系统的运动训练产生适应性的改变。其中骨骼肌纤维类型变化和肌肥大是两个比较明显的适应性变化。骨骼肌由不同类型肌纤维组成,根据ATP酶染色法,可将肌纤维可分为Ⅰ型(慢肌)、Ⅱ型(快肌),Ⅱ型纤维又进一步分为A、B、C三种亚型。然而目前有关骨骼肌纤维类型之间转换的信号转导机制已经发现很多,钙调神经磷酸酶信号转导调节机制作为是骨骼肌纤维类型转换的重要途径之一,已经成为当前研究的热点。但是其具体的调节机制以及下游的调节因子的研究还不是很明确。而对于骨骼肌肥大的钙调神经磷酸酶信号机制的研究已有发现,但还尚未成熟。有待于更深层次的研究。
1 钙调神经磷酸酶
1.1 分子结构
钙调神经磷酸酶(Calcineurin,CaN)又称蛋白磷酸酶PP2B,是目前发现的唯一受Ca2+/钙调素 (Calmodulin, CaM)CaM调节的丝氨酸/苏氨酸蛋白磷酸酶,参与多种功能调节[1]。钙调神经磷酸酶作为一个异源二聚体,由61KD的催化亚基(CnA)和一个19KD的调节亚基(CnB)共同组成。其中CnB是一个由168个氨基酸组成与钙调素有30%~50%的序列同源性的多肽。CnA由521个氨基酸组成,遗传学研究发现CnA可分为5个不同的结构域:N端区域,催化域,CnB结合域,CaM结合域和自抑制域。其中,N端区域与CnB存在相互联系,有可能参与对其催化活性的调节。CnB 与CaM一样也有4个Ca2+结合位点。在没有Ca2+的情况下,CnB也能与CnA紧密结合,但只有CnB与Ca2+结合时才能增加其磷酸酶活性。钙调神经磷酸酶的晶体结构研究显示:由于CaM结合域构象的特殊性,抑制域封闭了其自身催化域的活性位点,从而抑制了其自身的酶活性。CnA构象可能因为Ca2+/CaM的结合而发生改变,自身抑制域构象产生一系列相应的变化而显露出活性位点,从而使钙调神经磷酸酶活化[3]。钙调神经磷酸酶在机体各组织中均有分布[2]。因此它在心肌肥大,肌纤维类型转变和骨骼肌肥大,线粒体生物合成、氧化磷酸化,糖代谢,脂肪酸氧化,神经元重塑,影响学习和记忆等过程中都有重要作用[4]。
1.2 催化特性
钙调神经磷酸酶催化底物种类很少,主要催化磷脂酰丝氨酸和磷脂酰苏氨酸。它能够催化的体外底物主要有抑制因子1和2、G蛋白、平滑肌肌球蛋白轻链、酪氨酸、组蛋白、肌钙蛋白Ⅰ、神经调节蛋白、tau蛋白、微管相关蛋白-2、N-天门冬氨酸受体和NFAT等。但是明确的体内底物很少,只有DAPP32、神经调节蛋白、NFAT等少数几种蛋白[5]。
CnA作为CaN催化的关键,它与CnB和CaM结合可以提高CaN的活性。CnA与CaM之间的相互作用对Ca2+有很高的依赖性和自身的可逆性。CnA与CaM只有在Ca2+存在时才产生高度的亲和力,并且二者等比例结合成形成复合物。CaN能够调节包括神经和肌肉组织的发育、神经递质的释放、脊椎动物心脏瓣膜的形态发生及心肌肥大、记忆和学习过程、淋巴细胞激活和Ca2+依赖性的细胞凋亡等一系列生理活动[6]。还参与离子通道如N-甲基-D-天门冬氨酸受体通道和L-型钙通道功能的调节[7-9]。
2 运动骨骼肌钙调神经磷酸酶的信号转导机制
Chin等[10]根据成肌细胞培养的研究结果提出:钙调神经磷酸酶信号通路可以调控骨骼肌纤维类型基因的表达。运动神经元引发肌纤维动作电位,激发肌细胞内钙离子浓度持续性升高,进而激活钙调神经磷酸酶,使活化的T细胞核转录因子( nuclear factor of activated t cells,NFAT )去磷酸化,去磷酸化的NFAT从胞浆转移至细胞核,结合到相应的核苷酸识别序列,从而引发目标基因的转录[11]。快慢肌各自所受的神经支配不同:在慢肌纤维中,神经冲动引起细胞质中钙离子长期持续的低振幅的变化,这种变化能够激活CaN,进而使NFAT去磷酸化入核,调节慢肌纤维基因的表达;在快肌纤维中,神经冲动引起细胞质中钙离子短期持续的高振幅的变化,而这种变化不足以使CaN处于激活状态,也就不能使NFAT去磷酸化入核,从而失去对快肌纤维基因表达的调控。Chin等[10]发现钙调神经磷酸酶不仅仅调控NFAT这一种转录调控因子,同时还调节其它因子,例如肌细胞提升因子-2(Myocyte Enhancer Factor -2,MEF-2)等。
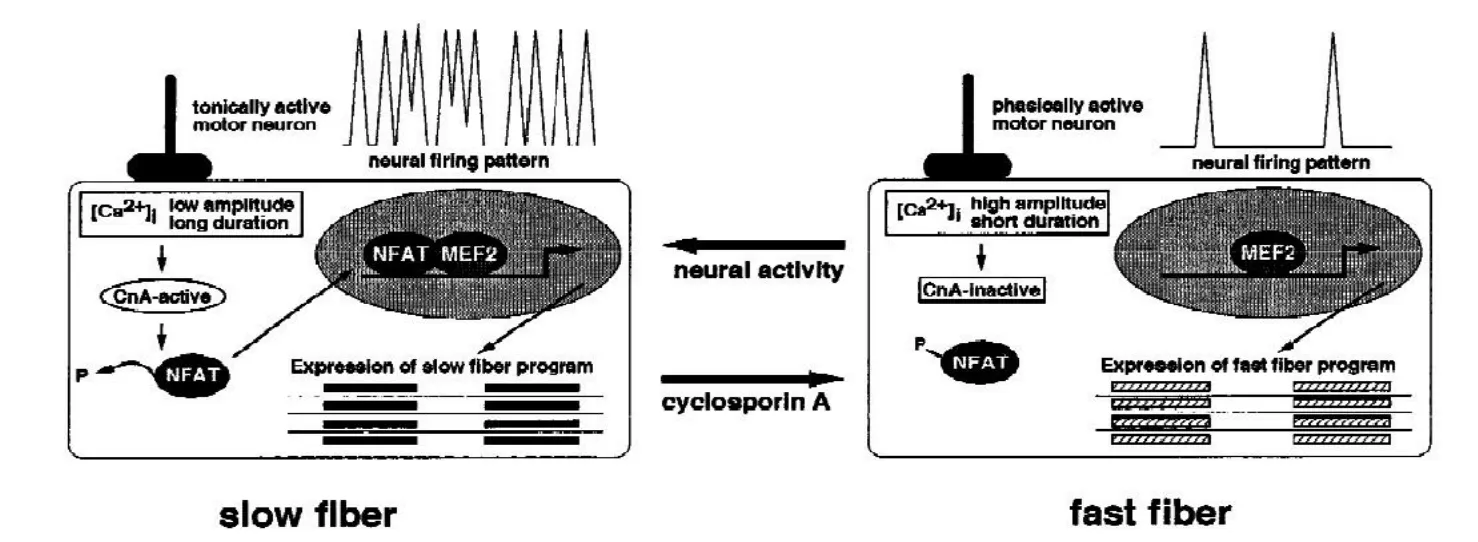
图-1钙调神经磷酸酶信号通路[10]
钙调神经磷酸酶的调节功能的认识很大程度上源于对免疫系统的研究。在淋巴细胞中,NFAT作为钙调神经磷酸酶的去磷酸化的一重要底物,在钙调神经磷酸酶去磷酸化作用下进入细胞核,从而引起特殊基因表达的增加,研究证明这一途径的激活来自于骨骼肌中胰岛素样生长因子(IGF-1)[6]。DunnSE[2]等人发现,在大鼠超负荷训练模型中,正常表达钙调神经磷酸酶活性的大鼠骨骼肌MHCI增加了20倍,而用药物抑制钙调神经磷酸酶活性的大鼠骨骼肌模型中则没有出现这种现象。
Parsons SA等[6]通过鼠基因丢失模型研究发现,钙调神经磷酸酶能通过激活转录因子:肌细胞提升因子-2 和MyoD,从而影响骨骼肌纤维类型的分化。另外,抑制钙调神经磷酸酶活性的表达,就能抑制肌细胞分化。在其建立的鼠超负荷模型下,通过CsA对钙调神经磷酸酶活性变化进行控制发现,用CsA抑制钙调神经磷酸酶活性的表达,跖肌在超负荷条件下的肥大现象下降;缺乏CnA的小鼠,钙调神经磷酸酶的活性降低50%,经过6周的超负荷刺训练后,跖肌体积增长下降了54%[6]。
3 钙调神经磷酸酶的信号转导机制在骨骼肌纤维转换中的作用
有研究显示钙调神经磷酸酶可以促使骨骼肌MHC-Ⅱ型纤维向MHCI纤维表达。在大鼠超负荷模型或注射毒素等不同条件下,用CsA抑制钙调神经磷酸酶活性,骨骼肌纤维类型都出现了由Ⅰ型(慢肌) 向 Ⅱ型(快肌) 的转化[2-3]。Parsons SA[5]等在正常、健康的动物体建立钙调神经磷酸酶Aα、Aβ变异模型发现,其Ⅰ型肌纤维比例下降。同样,过表达钙调神经磷酸酶可使肌纤维向慢型转化。另有研究表明,NFAT 能作用于多种表达Ⅰ 型骨骼肌肌纤维的基因,并使其表达水平增加[7]。钙调神经磷酸酶信号转导调节机制被认为是骨骼肌纤维类型转换的重要途径。
Serrano等[12]通过建立大白鼠骨骼肌再生模型,运用环孢素A(CsA)和免疫抑制剂FK506来抑制CaN活性以及转基因的方法,发现在比目鱼肌再生过程的初期,MHC-Ⅱa表达增加,MHC-Ⅱx 和MHC-Ⅱb表达减少。Delling[13]等通过肌肉组织培养以及细胞转染实验,证明了该信号通路确实参与了骨骼肌的分化和MHC-Ⅰ的表达。Parsons等[5]通过敲除鼠钙调神经磷酸酶基因的实验研究发现,钙调神经磷酸酶能通过激活转录因子MEF-2和MyoD,影响肌球蛋白生成和骨骼肌分化,并且在建立的小鼠超负荷模型中,用CsA抑制钙调神经磷酸酶,就能抑制或阻断慢肌纤维的转录。在国内,廖八根等[14]证明钙调神经磷酸酶参与了耐力运动骨骼肌纤维类型和大小的调控,具有肌肉特异性。
但是也有不少的研究人员并不认可这一学说,如Swoap等[15]通过细胞培养及转基因实验研究发现,在培养的成肌细胞C2C12中过度表达激活的CaN也诱导了一些快肌纤维基因的表达,其中包括MHC-Ⅱb。作者认为造成这种差异的原因可能是由于钙调神经磷酸酶的活性状态不同,而且钙调神经磷酸酶所调控的下游转录因子不止NFAT一种,MEF-2等因子也受其调控[15]。钙调神经磷酸酶信号通路对于骨骼肌纤维类型转换作用的研究已经受到广大研究者的高度关注,但是对于钙调神经磷酸酶下游的一些调节因子以及这些调节因子之间的联系目前还不清楚,待于进一步研究。
4 钙调神经磷酸酶的信号转导机制在骨骼肌肥大中的作用
骨骼肌肥大主要通过两种分子机制:一是蛋白质合成;二是卫星细胞增殖、分化和融合[16]。骨骼肌蛋白质合成主要通过 IGF-1、PI3k、mTOR等信号机制来实现[17]。有研究显示 CaN主要通过调控其下游信号通路进而调控骨骼肌肥大。utrophin A和肌生成抑制素(myostain, MSTN)作为CaN通路下游靶基因,可以通过环孢素A对CaN通路的特异性抑制,来控制运动大鼠骨骼肌纤维的增长。Utrophin和肌营养不良蛋白(dystrophin)属于同系蛋白,而且都是细胞骨架蛋白,有着相同的结合位点。Dystrophin位于肌原纤维附着点处,用以传递肌原纤维与细胞外基质、相邻肌纤维之间的作用力。被CaN活化了的NFAT能结合 utrophin A 基因的启动子,从而启动utrophin A的表达[18]。
MSTN也被认为是CaN信号通路的效应因子,同时它还是肌肉体积的负调节因子[19]。有研究显示,MSTN 基因敲除小鼠肌肉产生肥大。而MSTN转基高表达小鼠,则表现出明显的肌肉萎缩[20]。 通过转基因技术抑制CaN的活性,小鼠MSTN mRNA减少[21]。另外有研究显示[18],环孢素 A 可以逆转负重小鼠骨骼肌MSTN表达的降低。这表明 CaN 活性与 MSTN表达之间存在反馈式的相互作用,在运动诱导的骨骼肌肥大过程中,CaN 与 MSTN 之间的相互作用有助于维持骨骼肌形态的重塑与代谢功能之间的平衡。
5 小 结
对于运动训练能促使骨骼肌形态、结构发生适应性变化的研究主要在于肌纤维选择性肥大、肌纤维类型转化等,而且研究已经有一段时间。但是对于这些变化的分子机制的研究以及这些分子信号通路下游的调节因子的研究还不明朗。骨骼肌运动适应性变化的钙调神经磷酸酶信号机制作为个信号通路中的热点问题之一,无论是在体育领域还是在医学和生物学领域的研究已经逐步的深入。根据现有的研究结果已经可以证明钙调神经磷酸酶在骨骼肌运动适应变化中发挥这不可或缺的重要作用,尤其是在骨骼肌纤维类型转换过程中的调控作用。 另外,钙调神经磷酸酶信号通路调控心肌肥大的相关研究也已经跟进。但是钙调神经磷酸酶信号通路的下游因子的具体调节机制的相关研究还不是很多,具体研究结果还不是很明确,有待与进一步研究。
[1] 符民桂,唐朝枢. 钙调神经磷酸酶的研究进展[J] . 生物化学与生物物理进展,2000,27(2):157~161.
[2] Dunn SE, Bur ns JL, Michel RN. Calcineur in is r equired forskeletal muscle hypertrophy. J Biol Chem.1999,274:21908-21912.
[3] Bigard X, Sanchez H, Zoll J. et al. Calcineurin co-regulates con-tractile and metabolic components of slow muscle phenoty pe. JBio l Chem.2000,275:19653~19660.
[4] Mitchell PO, Mills ST , Pavlath GK. Calcineurin differ entiallyregulates maintenance and grow th of phenotypically distinctmuscles. Am J Physiol Cell Physiol.2002,282:984~992.
[5] Parsons SA, Wilkins BJ, Bueno OF, et al. Alter ed skeletal muscle phenoty pes in calcineurin Aαand Aβ gene-targ eted mice.Mol Cell Biol.2003,23:4331~4343.
[6] Parsons SA, Millay DP, Wilkins BJ, et al. Genetic loss of cal-cineurin blocks mechanical overload- induced skeletal musclefiber type switching but not hyper trophy. J Biol Chem. 2004,279: 26192~26200.
[7] Calv o S, Venepally P, Cheng J, et al. Fiber-type-specific transcription of the troponin Ⅰ slow gene is reg ulated by multipleelements. Mol Cell Biol. 1999, 19: 515~525.
[8] Perro ne CE, Fenwick-Smith D, Vandenburgh HH. Collagenand stretch modulate autocrine secretion of insulin-like grow thfactor- Ⅰand insulin-like g rowth factor binding proteins fr omdifferentiated skeletal muscle cells. J Biol Chem. 1995, 270:2099~2106.
[9] 袁建琴,徐 勇,潘同斌,等. 低氧、离心力竭运动对骨骼肌自由基代谢的影响[J]. 武汉体育学院学报,2005,39(5):40~43.
[10] Chin ER,Olson EN,Richardson JA,et al. A calcineurin-dependent transcriptional pathway controls skeletal muscle fiber type[J].Genes Dev,1998,12(16):2499~2509.
[11] Anjana Rao,Chun Luo,and Patrick G Hogan.Transcription factors of the NFAT family:regulation and function[J].Annu Rev Immunol, 1997,15:707~747.
[12] Antonio L Serrano, Marta Murgia, Giorgia Pallafacchina, et al. Calcineurin controls nerve activity dependent specification of slow skeletal muscle fibers but not muscle growth[J]. PNAS, 2001, 98(23):13108~13113.
[13] Delling U, Tureckova J, Lim HW, et al. A calcineurin-NFATc3-dependent pathway regulates skeletal muscle differentiation and slow myosin heavy-chain expression[J].Mol Cell Biol,2000,20(17):6600~6611.
[14] 廖八根,徐勇,薛耀明.钙调神经磷酸酶在耐力运动大鼠骨骼肌纤维类型和大小转变中的作用[J].中国运动医学杂志,2008,27(5):551~613.
[15] Swoap SJ,Hunter RB,Stevenson EJ, et al.The calcineurin-NFAT pathway and muscle fiber-type gene expression[J].Am J Physiol,2000,279(4):C915~C924.
[16] Snijders T, Verdijk LB, van Loon LJC. The impact of sarcopenia and exercise training on skeletal muscle satellite cells. Ageing Res Rev. 2009;8(4):328~338.
[17] Adams GR, Qin L, Zeng M, et al. The temporal relationship between changes in IGF-1 and p70 S6 kinase activation during compensatory skeletal muscle hypertrophy. FASEB J. 2000; 14(4):A317~317.
[18] Michel RN, Chin ER, Chakkalakal JV, et al. Ca2+/calmodulinbased signalling in the regulation of the muscle fibre phenotypeand its therapeutic potential via modulation of utrophin A and myostatin expression. Appl Physiol Nutr Metab. 2007;32(5): 921~929.
[19] McNally EM. Powerful genes-Myostatin regulation of human muscle mass. N Engl J Med. 2004;350(26):2642~2644.
[20] Zimmers TA, Davies MV, Koniaris LG, et al. Induction of cachexia in mice by systemically administered myostatin. Science. 2002;296(5572):1486~1488.
[21] Muthuri SK, Chin ER, Michel RN. Myostatin as a putative downstream gene target of calcineurin signaling associated with muscle growth remodeling. FASEB J 2007;21(6):A1207~1207.
Research Progress of Calcineurin’s Role in Skeletal Muscle Adaptation of Training
GUO Xing-wu,TENG Yu-song
Studies have proved that skeletal muscle could have adaptive changes induced by training, which include conversions among the types of skeletal muscle fibers.,skeletal muscle volume increased. There‘s a lot of endogenous mechanisms leading to this series of changes, the calcineurin signal mechanism is one of them. The calcineurin phosphatase signal adjustment mechanism has been recognized by the majority of scholars. It is important for a deep understanding of the calcineurin phosphatase signaling mechanisms, to further explore the role of calcineurin phosphatase in skeletal muscle fiber type transformation.
Calcineurin; Skeletal muscle; Adaptive
G804.47
A
1007―6891(2013)03―0040―03
2012-10-10
辽宁师范大学体育学院,辽宁 大连,116029。School of Physical Education,Liaoning Normal University, Liaoning Dalian, 116029, China.

