干细胞Nanog蛋白在食管癌组织中的表达及意义
苏 鹏,刘洪峰,石磊芝
(1辽阳市中心医院,辽宁辽阳111000;2辽宁医学院附属第一医院;3山东省临沂市人民医院)
食管癌的传统治疗手段较多,但患者的5年生存率并未明显提高,其主要原因是肿瘤的化疗耐药及侵袭转移。研究表明,肿瘤组织内有少数细胞具有干细胞特性,能促进肿瘤的生长、转移及诱导耐药性产生[1]。Nanog蛋白是多能干细胞的重要生物学标志物之一,其在肿瘤组织中的高表达与肿瘤转移、复发等生物学行为密切相关[2]。目前,关于Nanog蛋白在食管癌组织中的表达及临床意义的研究尚少,我们对此进行了研究。现报告如下。
1 资料与方法
1.1 临床资料 选择2008年1月~2011年12月在我们3家医院行手术切除的食管癌患者87例,男52例、女35例,年龄45~82(66±7.6)岁。按WHO组织学分型分级标准,高分化22例,中分化34例,低分化31例。无淋巴结转移37例,有淋巴结转移50例。TNM分期Ⅰ+Ⅱ期38例,Ⅲ期49例。患者均为初发,术前未行放、化疗。
1.2 方法
1.2.1 标本采集 取87例患者的食管癌组织(观察组)和距癌组织边缘>5 cm的癌旁组织(对照组)标本,用4%多聚甲醛固定,常规石蜡包埋。食管癌细胞系TE-1、Eca-109购自上海中科院细胞库。
1.2.2 食管癌组织中的Nanog蛋白检测 应用免疫组化PV二步法,用PBS代替一抗作阴性对照,用已知的Nanog阳性蛋白染色精原细胞瘤作阳性对照。常规脱蜡至水,柠檬酸抗原微波修复后自然冷却;依次滴加一抗(1∶400稀释)和二抗(1∶100稀释)孵育。DAB显色,常规脱水、透明、封片。在高倍镜下取4个不同视野各计数200个癌细胞,按阳性细胞所占百分率分为:阴性:无阳性细胞;弱阳性:阳性细胞<30%,呈浅黄色;中度阳性:阳性细胞30% ~50%,呈棕黄色;强阳性:阳性细胞>50%,呈棕褐色。
1.2.3 食管癌细胞系 TE-1、Eca-109中的Nanog蛋白检测 采用免疫荧光技术。食管癌细胞培养于RPMI-1640培养基中,培养基含有10%胎牛血清,细胞于5%CO2、37℃的细胞培养箱中培养,生长至80%融合时进行传代。胰酶消化后吹打均匀,接种于24孔板上,5%CO2孵箱培养过夜,4%多聚甲醛固定,Triton X-100作用15 min,5%BSA室温封闭1 h,一抗湿盒4℃孵育过夜,二抗室温避光孵育2 h,Herst室温避光复染15 min。除用5%BSA封闭后不用PBS清洗以外,其余步骤都用PBS洗3次,每次3 min;荧光照相,在200倍镜下观察,随机取10~20个视野,计数500个细胞中核表达阳性染色细胞数,计算核表达阳性细胞率。
1.2.4 统计学方法 采用 SPSS16.0统计软件,Nanog蛋白表达与临床病理特征的关系用χ2检验。P≤0.05为差异有统计学意义。
2 结果
2.1 食管癌组织中的Nanog蛋白表达 对照组Nanog蛋白呈低水平表达,阳性反应见于细胞质内。观察组Nanog蛋白主要定位于细胞质,为棕黄色颗粒,且随组织恶性程度增高而阳性率升高,在细胞核中的表达逐渐增多,特别是在低分化细胞核中的表达明显增多,其Nanog蛋白阳性表达率为44.83%(39/87),对照组仅为 12.64%(11/87),两组比较P <0.05。
2.2 食管癌组织中的Nanog蛋白表达与临床病理特征的关系 见表1。
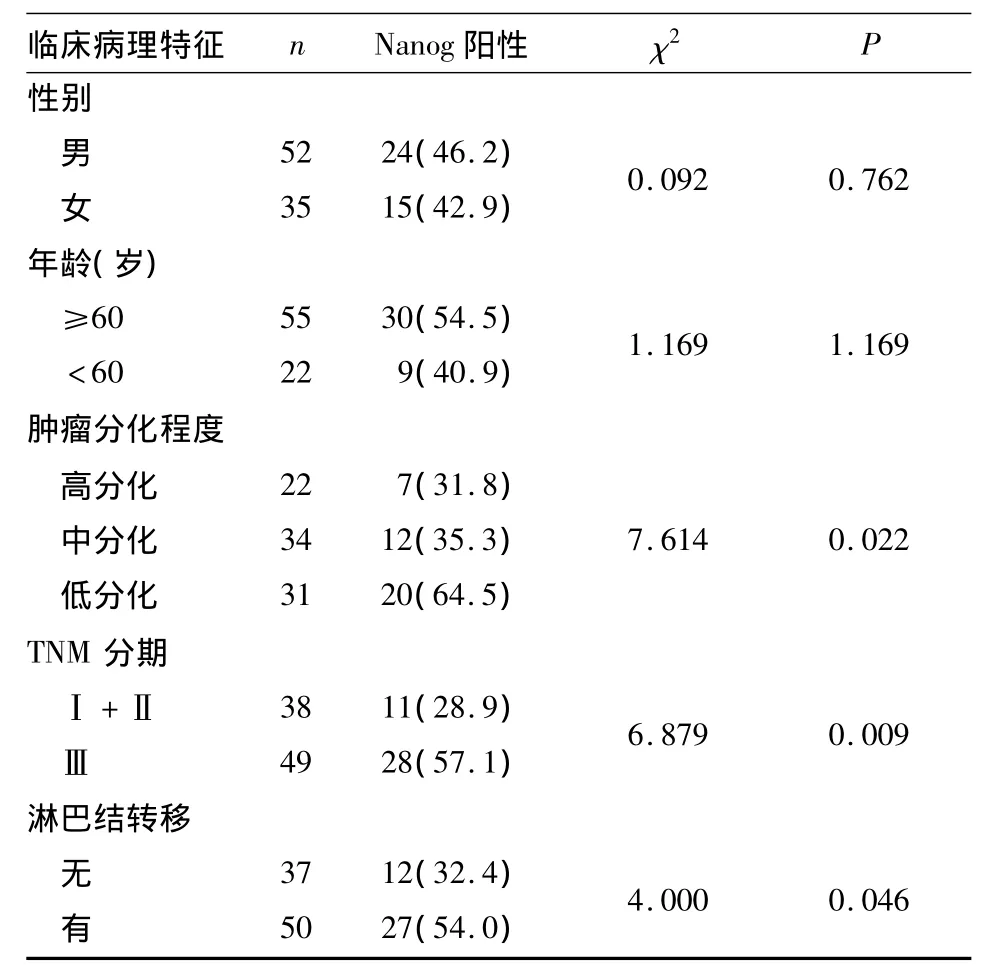
表1 食管癌组织Nanog蛋白表达与临床病理特征的关系[例(%)]
2.3 食管癌细胞系中的Nanog蛋白表达 Nanog蛋白在食管癌细胞系Eca109、TE-1中高表达,且表达存在异质性;多数细胞以细胞质表达为主,少数细胞以细胞核表达为主,细胞核表达阳性率为10%。
3 讨论
Nanog最初是在胚胎干细胞内发现的一种参与干细胞分化等功能的转录因子,近年来,其作为维持干细胞增殖和亚全能性的关键性基因及干细胞的标记物,引起了学者的广泛关注。有研究发现,Nanog蛋白在生殖细胞肿瘤(如睾丸原位癌、精原细胞瘤和胚胎性癌)细胞株NCCIT等,以及体细胞肿瘤(如乳腺癌、卵巢癌、结肠癌和前列腺癌等)[3~7]均呈过表达,且影响这些肿瘤的转移、复发、治疗及预后。Nanog蛋白过表达可能是导致肿瘤组织产生耐药性的原因[8]。
本研究采用免疫组化技术检测Nanog蛋白在食管癌组织和癌旁组织中的表达,结果显示,Nanog蛋白在癌旁正常组织中微量表达,主要在食管黏膜基底层细胞的细胞质表达。这可能是由于基底层细胞具有干细胞性质,是复层鳞状上皮的增生层,而Nanog具有控制细胞增殖的功能。在食管癌组织中Nanog蛋白呈高表达,且其阳性率随病理分期和淋巴转移增加而升高,随肿瘤分化程度降低而升高;与年龄、性别和肿瘤大小等临床特征无显著相关性。有研究发现,Nanog能通过抑制分化基因gata4和gata6的转录维持细胞的低/未分化状态[9];本研究结果与其一致,这可能是食管癌分化程度的分子机制之一。本研究还显示,大部分细胞Nanog蛋白表达主要在细胞质,部分核、质都表达,仅少量细胞有核表达,且在低分化细胞核中表达明显增加,与以往研究结果不一致[4,10]。David 等[11]研究发现,Nanog基因中的136YKQVKT141使Nanog蛋白定位在细胞核,而Nanog中富含色氨酸的W区控制着其出核转运。因此我们推测,Nanog蛋白表达变化是控制细胞分化的因素之一,干细胞Nanog蛋白定位于细胞核,随着细胞分化,Nanog蛋白从细胞核中转运到细胞质执行功能,随着分化程度升高,Nanog蛋白随之在细胞中消失。所以,核表达的细胞可能分化程度更低,可能就是癌组织中的肿瘤干细胞,在低分化的食管癌鳞状细胞癌中这种细胞数多,可以解释在细胞分子水平上低分化食管癌转移早、进展快、预后差等临床现象,因为低分化食管癌中可能含有更多的肿瘤干细胞。
本研究采用细胞免疫荧光技术检测到Nanog蛋白在食管癌细胞系Eca109和TE-1中均呈高表达,以细胞质表达为主,少量以细胞核表达为主,细胞核表达阳性率为10%。核表达阳性细胞较圆、较小,其特点与干细胞相似。Li等[12]认为,Nanog蛋白在肿瘤干细胞中表达,也在普通肿瘤细胞中表达,但Nanog蛋白表达与肿瘤干细胞的关系尚无定论。我们结合Nanog蛋白在食管癌组织中核表达的特点,推测食管癌的肿瘤干细胞包含以核表达为主的少部分细胞。
综上所述,Nanog蛋白在食管癌组织中呈高表达,且与食管癌的病理分期、淋巴结转移和分化程度密切相关,这也是食管癌中存在肿瘤样干细胞的间接证明。Nanog蛋白可在食管癌的发生、发展及转移中起重要作用,成为食管癌恶性程度的评价指标,或作为诱导食管癌分化成熟的理想靶点之一,为食管癌化疗耐药的研究提供新的思路。
[1]Jordan CT,Guzman ML,Noble M.Cancer stem cells[J].N Engl J Med,2006,355(12):1253-1261.
[2]Dalerba P,Cho RW,Clarke MF.Cancer stem cells:Models and concepts[J].Annu Rev Med,2007,58(9):267-284.
[3]Lapidot T,Sirard C,Vormoor J,et al.A cell initiating human acute myeloid leukaemia after transplantation into scid mice[J].Nature,1994,367(6464):645-648.
[4]Siu MK,Wong ES,Kong DS,et al.Stem cell transcription factor nanog controls cell migration and invasion via dysregulation of ecadherin and foxj1 and contributes to adverse clinical outcome in ovarian cancers[J].Oncogene,2012,363(9):1038-1048.
[5]Seigel GM,Hackam AS,Ganguly A,et al.Human embryonic and neuronal stem cell markers in retinoblastoma[J].Mol Vis,2007,13(6):823-832.
[6]Gu TT,Liu SY,Zheng PS.Cytoplasmic nanog-positive stromal cells promote human cervical cancer progression[J].Am JPathol,2012,181(2):652-661.
[7] Freberg CT,Dahl JA,Timoskainen S,et al.Epigenetic reprogramming of oct4 and nanog regulatory regions by embryonal carcinoma cell extract[J].Mol Biol Cell,2007,18(5):1543-1553.
[8]Fujii H,Honoki K,Tsujiuchi T,et al.Sphere-forming stem-like cell populations with drug resistance in human sarcoma cell lines[J].Int J Oncol,2009,34(5):1381-1386.
[9]Pan G,Thomson JA.Nanog and transcriptional networks in embryonic stem cell pluripotency[J].Cell Res,2007,17(1):42-49.
[10]Ye F,Zhou C,Cheng Q,Shen J,et al.Stem-cell-abundant proteins nanog,nucleostemin and musashi1 are highly expressed in malignant cervical epithelial cells[J].BMC Cancer,2008,8(4):1-5.
[11]Chang DF,Tsai SC,Wang XC,et al.Molecular characterization of the human nanog protein[J].Stem Cells,2009,27(4):812-821.
[12]Li H,Gao Q,Guo L,et al.The pten/pi3k/akt pathway regulates stem-like cells in primary esophageal carcinoma cells[J].Cancer Biol Ther,2011,11(11):950-958.

