人脑星形细胞瘤中Galectin-3、nm23和CyclinD1的表达及其临床意义
苏 赓,周志宇,李国成,莫秋荣,温 伟
(1.广西壮族自治区民族医院 病理科,广西 南宁530001;2.广西壮族自治区民族医院 神经外科,广西 南宁530001;3.广西脑科医院 神经外科,广西 柳州545005)
星形细胞瘤是最常见的神经上皮性肿瘤,占颅内肿 瘤 的 13%-26%,占 胶 质 瘤 的 21.2%-50.6%[1]。肿瘤较易复发,临床上预后较差,其主要的原因是星形细胞瘤大多呈侵袭性生长,手术难以彻底根治[2]。本文通过应用免疫组化方法对50例星形细胞瘤进行研究,以探讨Galectin-3、nm23和CyclinD1蛋白在星形细胞瘤组织中的表达及其与复发和预后关系,为临床提供参考研究。
1 材料与方法
1.1临床资料
取我院和广西脑科医院自2001年1月年至2008年12月经手术切除,病理确诊、临床资料较完整的50例星形细胞瘤进行免疫组化研究,病程为1月至1年不等,术前均未经放、化疗,无糖尿病及甲亢等疾病。患者年龄为15-65岁,中位年龄为39岁,其中男性29例,女性21例;按照2000年WHO中枢神经系统肿瘤分类标准,其中Ⅰ级11例,Ⅱ级20例,高度恶性的Ⅲ-Ⅳ级共19例,全部病例跟踪随访,并以3年内是否复发作为反映预后的指标。标本经10%福尔马林液固定,常规石蜡包埋,3μm连续切片。
1.2免疫组化染色
Galectin-3、nm23和CyclinD1单克隆即用型抗体和S-PKits均购自北京中杉生物技术公司产品,按 S-P 法 操 作,DAB 显 色。以 已 知 Galectin-3、nm23和CyclinD1阳性组织切片作为阳性对照,以PBS代替一抗作为阴性对照。
1.3结果判定
Galectin-3和nm23阳性表达定位于肿瘤细胞胞浆内,CyclinD1阳性表达定位于肿瘤细胞胞核内,均以出现棕褐色颗粒为阳性。每张切片随机选择10个高倍视野(10×40),计数1000个细胞,阳性细胞<10%为阴性,≥10%为阳性。
1.4统计学分析采用SPSS17.0统计软件对所得数据进行统计分析,组间数据用χ2检验,相关分析用Spearman等级相关分析,均以P<0.05为差异有统计学意义。
2 结果
2.1 星形细胞瘤患者临床病理特征与Galectin-3、nm23和CyclinD1蛋白表达的关系
50例星形细胞瘤中CyclinD1阳性表达者35例(70.00%)(见图1),Galectin-3阳性表达者28例 (56.00%)(见图2),nm23阳性表达者27例(54.00%)(见图3);Galectin-3、nm23和 CyclinD1蛋白表达均与星形细胞瘤的分化程度相关(P<0.05),Galectin-3蛋白和CyclinD1蛋白的表达率随着肿瘤分级升高表达率升高,nm23蛋白表达率随着肿瘤分级 升 高 表 达 率 下 降;Galectin-3、nm23 和 CyclinD1蛋白表达均与患者性别和年龄不相关(P>0.05),见表1。

表1 星形细胞瘤患者临床病理特征与Galectin-3、nm23和CyclinD1蛋白表达的关系
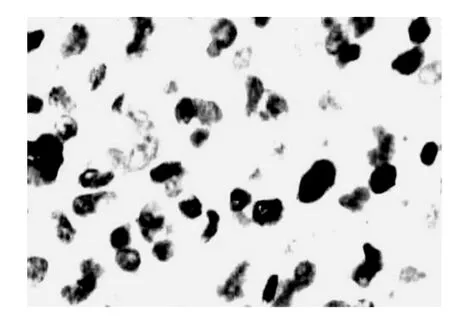
图1 Cyclin D1在IV型星形细胞瘤中的表达SP法X400倍

图2 Galectin-3在IV型星形细胞瘤中的表达SP法X400倍

图3 nm23在IV型星形细胞瘤中的表达SP法X400倍
2.2 星形细胞瘤中 CyclinD1、Galectin-3和 nm23蛋白表达的相关性
在35例CyclinD1阳性表达的星形细胞瘤中nm23阳性15例(42.86%),而CyclinD1阴性表达的15星形细胞瘤中nm23阳性12例(80.00%)(r=0.342,P=0.015);在28例 Galectin-3阳性表达的星形细胞瘤中nm23阳性11例(39.29%),而Galectin-3阴性表达的22例星形细胞瘤中nm23阳性16例(72.73%)(r=-0.333,P=0.018),nm23与CyclinD1、Galectin-3在星形细胞瘤中的表达呈负相关系,见表2。
2.3 星形细胞瘤患者 Galectin-3、nm23kip2和 CyclinD1蛋白表达与肿瘤复发关系
50例星形细胞瘤患者随访调查发现,其中3年内复发者31例,无复发者19例。CyclinD1蛋白阳性表达组复发率为83.87%,明显高于阴性表达组(47.37%),P<0.05;Galectin-3蛋白阳性表达组复发率为70.97%,明显高于阴性表达组(31.58%),P<0.05;nm23蛋白阳性表达组复发率为38.71%,明显低于阴性表达组(78.95%),P<0.05,见表3。

表2 星形细胞瘤中Galectin-3、CyclinD1和nm23蛋白表达的相关性

表3 星形细胞瘤患者Galectin-3、nm23和CyclinD1蛋白表达与肿瘤复发关系
3 讨论
细胞周期蛋白最早是通过35S-Met标记法在早期分裂的海胆卵中发现的,因为其浓度含量有周期性的波动,在有丝分裂前增加,在有丝分裂后消失,故称周期蛋白[3]。其中Cyclin D1是细胞周期蛋白家族中的重要成员,其定位于11区13染色体,是G1期细胞增殖信号感受的关键蛋白,在蛋白质G1-S期转化中发挥正性调节作用[4]。有研究表明,Cyclin D1过度表达可使细胞G1期缩短,体积变小,对分裂原的依赖性减弱。其过度表达是多种人类原发性肿瘤的特征[5],Cyclin D1已经被证明在人类多种恶性肿瘤的发生发展中起重要作用,如生殖系统肿瘤、头颈部肿瘤等[6,7]。本实验研究结果显示Cyclin D1蛋白在人脑星形细胞瘤中的表达从低级别组到高级别组表达水平依次增高,分别为45.45%,60.00%,94.74%,并且Cyclin D1阳性表达组复发率(83.87%)明显高于Cyclin D1阴性性表达组复发率(47.37%),经统计学检验,具有显著性(P<0.05)。说明Cyclin D1的表达随着星形细胞瘤恶性程度升高而升高,提示其表达可作为评价星形细胞瘤恶性程度的一个客观指标。
Galectin-3是一个31kD的β半乳糖蛋白,是一种细胞内和细胞外的凝集素,主要与细胞内的糖蛋白、细胞表面分子和细胞外基质蛋白作用,参与前提mRNA剪切,调节细胞增殖、粘附、侵袭和凋亡[8]。许多研究报道Galectin-3表达与人脑星形胶质细胞瘤的侵袭、恶性程度分级及预后等生物学行为方面有不同的观点。Bresalier(1997年)研究表明Galectin-3的表达水平与 WHO的分级呈正相关,即随着恶性程度增加而增加[9]。然而,Gordower却认为星形细胞瘤中Galectin-3的表达水平是从低级到高级逐步降低,即Galectin-3的表达水平与 WHO的分级呈负相关[10]。Camby等研究表明 Galectin-3调节胶质母细胞瘤迁移的潜能大,而迁移又与侵袭密切相关[11];对 H4、U373等细胞的裸鼠移植瘤实验也证实:脑实质侵袭部分的Galectin-3表达显著性高于非侵袭部分;不过Debray等应用Galectin-3反义质粒转染胶质母细胞瘤株U373细胞,结果侵袭性和粘附性均无显著性改变[12]。在本研究中,我们发现星形细胞瘤Galectin-3的表达与肿瘤的 WHO分级呈正相关,即高级别星形细胞瘤中Galectin-3表达阳性率比低级别星形细胞瘤明显增加,另外Galectin-3阳性表达率高的星形细胞瘤患者与阳性率低者相比,术后肿瘤复发率较高,分析原因可能是Galectin-3水平高的肿瘤侵袭性较强。我们的观点与Bresalier类似,他研究发现星形细胞胶质瘤浸润带内有超过5%以上的细胞表达Galectin-3,而相邻的正常脑组织内细胞不表达Galectin-3,由此推测Galectin-3可能在肿瘤对周围组织侵袭过程中起重要作用,我们可以推测Galectin-3是重要的脑星形细胞瘤预后相关因子。
Nm23基因是Steeg等[13]于1988年首次从小鼠黑色素瘤K-1735细胞株中用消减杂交法分离出来的能抑制肺癌转移的相关基因,是一种肿瘤抑制基因,人类nm23基因定位于17号染色体的q22区。nm23基因编码的蛋白产物通过信号传导影响肿瘤细胞微管的组合,从而影响细胞微管、微丝等细胞骨架蛋白的活动,通过参与调节细胞内微管系统的状态抑制肿瘤的转移[14]。nm23基因在恶性肿瘤细胞内具有等位基因缺失及基因突变的遗传学特征[15],其缺失与表达降低与多种恶性肿瘤的浸润和转移有关[16]。研究认为,nm23与肿瘤的分化程度具有相关性[17]。本实验也表明nm23蛋白在人脑星形细胞瘤中的表达从低级别组到高级别组表达水平依次降低,分别为81.82%,60.00%,31.58%,nm23蛋白的表达率随着星形细胞瘤恶性程度升高而降低;nm23蛋白阳性表达组复发率为38.71%,明显低于阴性表达组(78.95%),差别有显著性(P<0.05),说明nm23蛋白在抑制星形细胞瘤复发机制中发挥着负性调控的作用。
另外本研究发现在星形细胞瘤中nm23与CyclinD1、Galectin-3在星形细胞瘤中的表达呈负相关系(r= -0.342,P=0.015;r= -0.333,P=0.018),说明nm23与 CyclinD1、Galectin-3可能共同参与了星形细胞瘤的发生与发展。可能情况是,nm23作为肿瘤抑制基因与CyclinD1及Galectin-3相互制约,处于一种动态平衡状态,当某种信号刺激下,肿瘤抑制基因nm23表达降低,CyclinD1及Galectin-3表达增强,促进了肿瘤的发生发展及增殖侵袭作用。
本研究结果表明,本实验中CyclinD1、Galectin-3和nm23蛋白表达水平均显示与星形细胞瘤生物学行为和预后相关,CyclinD1、Galectin-3蛋白高表达、nm23蛋白低表达或阴性者,肿瘤恶性程度程度高,进展快,复发率高,预后差。笔者认为联合检测人脑星形细胞瘤中CyclinD1、Galectin-3和nm23蛋白表达水平对判断人脑星形细胞瘤恶性程度及预后的有指导意义。至于能否根据CyclinD1、Galectin-3和nm23蛋白的异常表达为星形细胞瘤患者提供有效的、个体化的治疗方案还有待于进一步的临床实践研究。
[1]王忠诚.王忠诚神经外科学[M].武汉:湖北科学技术出版社,2005:541-545.
[2]岳伟英,陈忠平.胶质瘤治疗的新靶点[J].中国肿瘤,2006,15(3):155.
[3]Ho A,Dowdy SF.Regulation of G1cell-cycle progression by oncogenes and tumor suppressor genes[J].Curr Opin Genet Dev,2002,12(1):47.
[4]Moghaddam SJ,Haghighi EN,Samiee S,et al.Immunohistonchemical analysis of P53,CyclinD1,RB1,c-fos and N-ras gene expression in hepatocellular carcinoma in Iran[J].World J Gastroenterol,2007,13(4):588.
[5]Liao DJ,T hakur A,Wu J,et al.Perspectives on c-myc,cyclin D1 and their interaction in cancer formation,progression,and response to chemotherapy[J].Crit Rev Oncog,2007,13(2):93.
[6]Dimova I,Zaharieva B,Raicheva S,et al.Association of CyclinD1 copy number changes with histological type in ovarian tumors[J].Acta Oncol,2004,43(7):675.
[7]Perez ordonez B,Beauchemin M,Jordan R C.Molecular biology of squamous cell carcinoma of the head and neck[J].J Clin Pathol,2006,59(5):445.
[8]De Oliveira J T,De Matos A J,Gomes J,et al.Coordinated expression of galectin-3and galectin-3-binding sites in malignant mammary tumors:implications for tumor metastasis[J].Glycobiology,2010,20(11):1341.
[9]Bresalier RS,Yan PS,Byrd JC,et al.Expression of the endogenous galactose-binding protein galectin-3correlates with the malignant potential of tumors in the central nerous system [J].Cancer,1997,80(4):776.
[10]Gordower L,Decaestecker C,Kacem Y,et al.Galectin-3and galectin-3-binding site expression in human adult astrocytic tumours and related angiogenesis[J].Neuropathol Appl Neurobiol,1999,25(4):319.
[11]Camby I,Belot N,Rorive S,et al.Galectins are differentially expressed in supratentorial pilocytic astrocytomas,astrocytomas,anaplastic astrocytomas and glioblastomas,and significantly modulate tumor astrocyte migration[J].Brain Pathol,2001;11(1):12.
[12]Debray C,Vereecken P,Belot N,et al.Multifaceted role of galectin-3on human glioblastoma cell motility [J].Biochem Biophys Res Commun,2004;325(4):1393.
[13]Steeg PS,Cohn KH,Leone A.Tumor metastasis and nm23current concepts[J].Cancer Cells,1991,3(7):257.
[14]Paupe M.Tumour associated E-cadherin mutations after cellular morphology,decrease cellular adhesion and increase cellular motility.Oncogene,1999,18(30):4301.
[15]Dursun A,Akyürek N,Günel N,et al.Prognostic implication of nm23-H1expression in colorectal carcinomas [J].Pathology,2002,34(5):427.
[16]Suzuki E,Ota T,Tsukuda K,et al.nm23-H1reduces in vitro cell migration and the liver metastatic potential of colon cancer cells by regulating myosin light chain phosphorylation[J].Int J Cancer,2004,108(2):207.
[17]Crause FS,Feil G,Bichler KH,et al.Immunohistochemical examinations(Ki-67,p53,nm23)and cytophotometry in bladder cancer[J].Anticancer Res,2000,20(6):5023.

