AQP-5基因沉默对结肠癌细胞增殖及信号转导通路的影响
石晓明吴胜春董军杰唐雷杨永宾吕柏楠
1.河北省人民医院普外二科,河北 石家庄 050051;
2.河北省医学情报研究所,河北 石家庄 050071
AQP-5基因沉默对结肠癌细胞增殖及信号转导通路的影响
石晓明1吴胜春1董军杰2唐雷1杨永宾1吕柏楠1
1.河北省人民医院普外二科,河北 石家庄 050051;
2.河北省医学情报研究所,河北 石家庄 050071
背景与目的:水通道蛋白-5(aquaporin 5,AQP-5)在人结肠癌组织中表达增高,与结肠癌的发生、发展及转移过程有关。但AQP-5影响的信号转导通路及对结肠癌细胞的具体影响尚不明确。本研究通过抑制结肠癌细胞株HT-29内源性AQP-5的表达,探讨AQP-5对HT-29细胞丝氨酸/苏氨酸蛋白激酶(AKT)、细胞外调节激酶细胞外调节激酶(ERK)、c-jun氨基末端激酶(JNK)和p38丝裂原活化蛋白激酶(p38MAPK)信号转导通路的影响。方法:体外常规培养人结肠癌HT-29细胞,取对数生长期的细胞用于实验。蛋白质印迹法(Western blot)检测AQP-5-siRNA转染效率;采用噻唑蓝(MTT)法检测各组细胞增殖抑制率;流式细胞术检测细胞凋亡率;Western blot检测转染AQP-5 siRNA的HT-29细胞AKT、ERK、JNK和p38蛋白的磷酸化形式及总蛋白的表达水平。结果:AQP-5-siRNA转染使HT-29细胞AQP-5基因表达下调的效率达90%。MTT分析结果显示,转染了AQP-5-siRNA的HT-29细胞增殖抑制率显著增高(P<0.05),流式细胞术发现转染了AQP-5-siRNA的HT-29细胞凋亡率显著增加(P<0.05)。Western blot结果显示,与转染NS-siRNA的阴性对照组相比较,转染了AQP-5-siRNA的HT-29细胞磷酸化的AKT、ERK和JNK蛋白磷酸化形式表达量与总蛋白表达量的改变两者差异无统计学意义(P>0.05)。而转染了AQP-5-siRNA的HT-29细胞磷酸化p38与总的p38蛋白比值下降(P<0.05)。结论:针对AQP-5的si-RNA具有促进HT-29细胞凋亡、抑制细胞增殖的作用,该作用可能与抑制p38MAPK蛋白的磷酸化活化有关。
水通道蛋白5;结肠肿瘤;信号转导通路
结肠癌是严重威胁人类健康的恶性肿瘤,其发病率呈不断上升的趋势。p38MAPK是细胞内重要的信号转导通路之一,属于丝裂素活化蛋白激酶(MAPK)家族中的一员,参与细胞增殖、分化、死亡等多种生理和病理过程的调节[1]。肿瘤细胞异常增殖需要更多水分子的快速转运,水通道蛋白(aquaporins,AQPs)是一类广泛存在于细胞膜上的、具有高选择性的、特异转运水分子的通道蛋白[2]。最近发现AQP-5在结肠癌组织中表达增高[3],但AQP-5与结肠癌细胞生长及信号通路之间的关系尚不清楚。本研究选用针对AQP-5的siRNA,观察其对结肠癌细胞生长相关的通路蛋白表达的影响,探讨AQP-5在结肠癌治疗过程中的可能作用及其调节机制。
1 材料和方法
1.1 材料
噻唑蓝(MTT),美国Sigma公司;DMEM/ F12培养液、胰蛋白酶,Gibco公司;AQP-5、丝氨酸/苏氨酸蛋白激酶(AKT)、磷酸化AKT(p-AKT)、细胞外调节激酶细胞外调节激酶(ERK)、磷酸化ERK(p-ERK)、c-jun氨基末端激酶(JNK)、磷酸化JNK(p-JNK)、p38丝裂素活化蛋白激酶(p38MAPK)、磷酸化p38MAPK (p-p38MAPK)及GAPDH抗体,美国Santa Cruz公司;FASCalibur流式细胞仪,美国BD公司。
1.2 细胞培养
HT-29细胞:人结肠中分化腺癌细胞株,购自中国科学院上海生命科学研究院细胞资源中心。细胞于含有10%胎牛血清、100 U/mL青霉素和100 g/mL链霉素的DMEM/F12培养基中培养,于37 ℃、CO2体积分数为5%的饱和湿度的恒温培养箱中温育。用0.25%胰蛋白酶(含0.02% EDTA)溶液消化传代。取对数生长期的细胞用于实验。
1.3 AQP-5-siRNA转染和实验分组
[4]设计合成AQP-5特异性小干扰RNA(AQP-5-siRNA)序列,siRNA #1顺义链:5’-AAAACTCTGCGAACACGGCCCCTGT CTC-3’,反义链:5’-AAGGCCGTGTTCGCA GAGTTCCTGTCTC-3’;siRNA #2顺义链:5’-AAGAGCAGCCAGTGAAGTAGACCTGTCT C-3’,反义链:5’-AATCTACTTCACTGGCTGC TCCCTGTCTC-3’。无关对照siRNA(nonspecific control siRNA,NS-siRNA)序列为:5’-GGUCUCACUCCCCAUAGAGTT-3’。转染前24 h于6孔板中接种HT-29细胞,密度为4×105个/mL。转染前用无血清无抗生素的DMEM/F12清洗细胞,经脂质体介导法,按照试剂说明书用无血清无抗生素的DMEM/F12培养基稀释AQP-5-siRNA混合物或对照NS-siRNA和相应比例转染试剂LipofectamineTM2000,两种稀释液混合形成复合物后,将其转染HT-29细胞。转染24 h后,检测转染效率及其他分子表达的情况。实验分组为:正常培养的HT-29细胞(对照组)、转染NS-siRNA的HT-29细胞(NS-siRNA组)和转染AQP-5-siRNA的HT-29细胞(AQP-5-siRNA组)。
1.4 MTT法检测细胞增殖率
对数生长期的HT-29细胞用0.25%胰蛋白酶(含0.02% EDTA)溶液消化并接种于96孔板,接种密度为5×104个/mL,每组设6个复孔。各组细胞于实验结束前4 h加入5 g/L的MTT 20 μL,继续培养4 h后,弃去培养液,每孔加入二甲基亚砜150 μL,室温振荡15 min至结晶完全溶解,用酶标仪于波长490 nm测吸光度A值。以上实验重复3次。生长抑制率(%)=(1-A实验组/ A对照组)×100%。
1.5 流式细胞术检测细胞凋亡率
细胞用0.25%胰蛋白酶(含0.02% EDTA)溶液消化,4 ℃,500×g离心10 min后收集细胞,沉淀中加入预冷的70%乙醇1 mL,轻轻吹打,4 ℃固定过夜。4 ℃,500×g,离心10 min,去上清液,用1×PBS清洗2次。然后加入1 mL PI染液将细胞重悬,4 ℃避光染色30 min后,流式细胞仪检测。以上实验重复3次。
1.6 蛋白质印迹法(Western blot)检测AKT、ERK、JNK、p38及磷酸化AKT、ERK、JNK和p38蛋白表达
收集细胞,用预冷的1×PBS洗涤3次,于细胞裂解液中重悬细胞,冰上裂解间断涡旋30 min后,4 ℃,6 200×g离心10 min,将上清液收集到新的EP管中,用改良的Lowry法进行蛋白定量。各组取等量的细胞总蛋白依次经聚丙烯酰胺凝胶电泳分离、电转移至PVDF膜、5%脱脂奶粉室温封闭后,用稀释后的各个目标蛋白的一抗4 ℃温育过夜,TTBS于室温摇床振摇漂洗3次后加入相应二抗,室温温育2 h,化学发光法进行显色,对条带进行吸光度积分扫描。GAPDH作为内参照。用各蛋白吸光度值/内参照吸光度值的比值进行比较。
1.7 统计学处理
2 结 果
2.1 针对AQP-5的siRNA对HT-29细胞表达AQP-5的影响
参考文献[3]人工合成AQP-5小干扰RNA(AQP-5-siRNA)转染HT-29细胞,同时转染NS-siRNA的细胞作为阴性对照。Western blot结果显示,NS-siRNA组细胞中AQP-5高表达,而AQP-5-siRNA组HT-29细胞AQP-5的表达显著下降(P<0.05),其下降幅度达90%,表明本研究所用的AQP-5-siRNA能高效抑制HT-29细胞中AQP-5的表达。NS-siRNA组与对照组相比,AQP-5的表达差异没有统计学意义(P>0.05,图1)。
2.2 针对AQP-5的siRNA对HT-29细胞增殖的影响
MTT检测转染AQP-5-siRNA和NS-siRNA的HT-29细胞增殖活力改变,与NS-siRNA组相比,AQP-5-siRNA组的HT-29细胞增殖抑制率显著增加(P<0.05),提示抑制AQP-5的表达可抑制HT-29细胞增殖。NS-siRNA组与对照组相比,增殖抑制率差异没有统计学意义(P>0.05,表1)。

表 1 HT-29细胞增殖抑制率和细胞凋亡率的变化Tab. 1 Change of growth inhibition rate and apoptosis rate in HT-29 cells
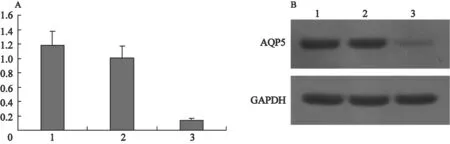
图 1 各组AQP-5蛋白表达的变化Fig. 1 Expression of AQP-5 in colon cancer cells
2.3 针对AQP-5的siRNA对HT-29细胞凋亡的影响
通过流式细胞术检测转染了AQP-5-siRNA的HT-29细胞凋亡率的改变。与NS-siRNA组相比,AQP-5-siRNA组的HT-29细胞凋亡率显著增加(P<0.05),提示抑制AQP-5的表达可促进HT-29细胞凋亡。NS-siRNA组与对照组相比,细胞凋亡率差异没有统计学意义(P>0.05,表1、图2)。
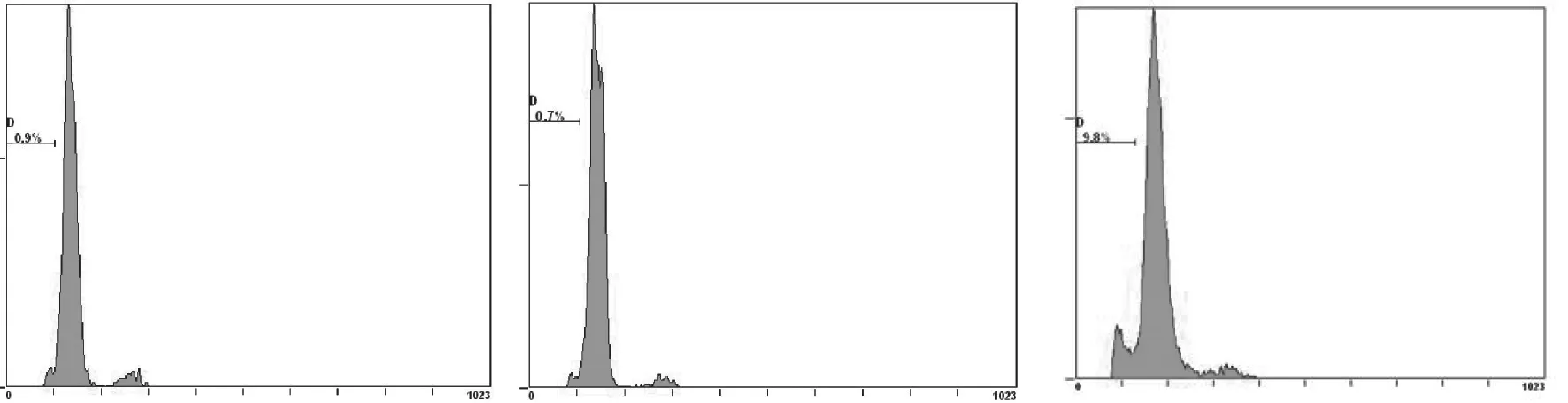
图 2 各组细胞凋亡率的变化Fig. 2 Change of the apoptosis rate in HT-29 cells
2.4 针对AQP-5的siRNA对HT-29细胞生长相关通路蛋白表达的影响
通过Western blot检测转染了AQP-5-siRNA的HT-29细胞磷酸化的AKT、ERK、JNK和p38蛋白磷酸化形式表达量与总蛋白表达量的改变,结果显示,与NS-siRNA组相比,AQP-5-siRNA组的HT-29细胞磷酸化的AKT、ERK和JNK蛋白磷酸化形式表达量与总蛋白表达量的改变两者差异无统计学意义(P>0.05),AQP-5-siRNA组的HT-29细胞磷酸化p38与总的p38蛋白表达下降,两者差异有统计学意义(P<0.05),NS-siRNA组与对照组相比,差异无统计学意义(P>0.05),表明抑制内源性AQP-5表达抑制了p38通路(图3、4)。
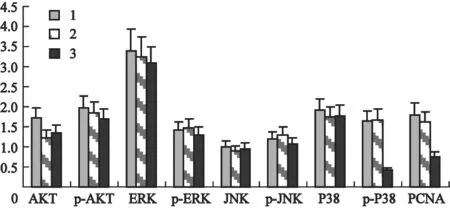
图 3 各组AKT、ERK、JNK、p38及磷酸化蛋白表达的变化Fig. 3 Expression of AKT, ERK, JNK, p38 and phosphorylation protein in every group
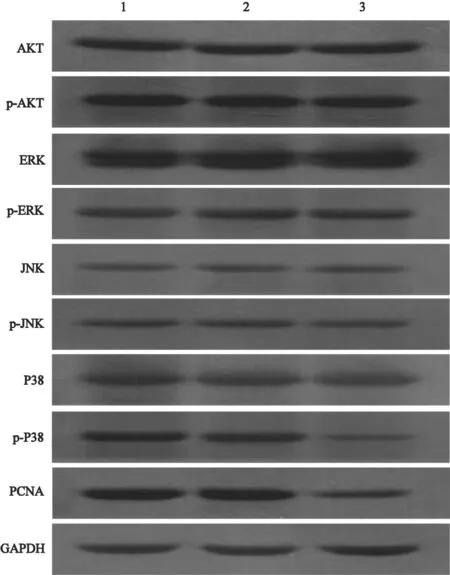
图 4 各组AKT、ERK、JNK、p38及磷酸化蛋白的表达Fig. 4 Expression of AKT, ERK, JNK, p38 and phosphorylation protein in every group
3 讨 论
结肠癌的发生发展是涉及多基因、多信号、多步骤的复杂过程,在致癌因素的不断刺激下,相关信号转导通路激活,主要表现为通路中关键效应分子活性发生改变,从而引起下游基因的表达失调,最终引起肠上皮细胞永生化,具有无限增殖、逃避生理性凋亡点的监控、侵袭性等特点。因此,通过对细胞信号转导通路调控改变肿瘤细胞增殖和凋亡能力是治疗结肠癌的一种新途径。
AQPs是近年发现的广泛分布于人体多种组织的跨膜蛋白,主要功能为选择性转运水进出细胞[2],许多研究表明,AQPs参与人体多种生理和病理过程,最近的研究发现AQPs与人类许多肿瘤关系密切[5-6]。其中AQP-5与结肠癌发生、发展相关。研究表明,与正常组织相比,AQP-5在结肠癌组织中高表达,且其表达量与结肠癌分化程度、浸润深度、淋巴结转移及TNM分期相关[7-8]。提示AQP-5在人结肠癌的发生、发展及转移的过程中可能起重要作用。因此,揭示AQP-5在人结肠癌发展中的作用机制对结肠癌靶向性治疗意义重大。本研究主要观察抑制AQP-5的表达对HT-29细胞增殖、凋亡及细胞信号转导通路的影响。
本研究结果显示,结肠癌HT-29细胞中AQP-5表达水平较高,转染AQP-5-siRNA后表达明显减弱,与转染NS-siRNA的阴性对照组相比,其下降幅度可达90%,表明AQP-5-siRNA能有效抑制内源性AQP-5的表达。在此基础上,本研究进一步观察了抑制AQP-5表达对细胞增殖凋亡的影响。MTT分析结果显示,转染了AQP-5-siRNA的HT-29细胞增殖抑制率显著增加。流式细胞分析发现,转染了AQP-5-siRNA的HT-29细胞凋亡率显著增加。以上结果提示,抑制AQP-5具有促进细胞凋亡抑制细胞增殖的作用。
MAPK是一类丝氨酸/苏氨酸蛋白激酶,作为真核细胞内主要的信号系统,可将胞外刺激信号转导至胞内引起细胞内基本生理过程的反应[9]。已经鉴定出真核细胞中存在3条MAPK信号转导通路,分别是ERK通路、JNK/ SPAK通路、p38 MAPK通路[10-11]。此外,PI3K/Akt信号通路也是近年来发现的真核细胞内调控细胞生长的一条重要信号通路,Akt是此通路的关键分子之一[12]。这些信号分子与结肠癌Dukes 分期、肿瘤浸润深度、淋巴结转移等密切相关。因而,许多药物通过作用于这些通路发挥抑制结肠癌的作用。如Park等[13]的研究发现,视黄醇可通过抑制PI3K 的活性诱导人结肠癌细胞HCT116 和SW620 的凋亡;卡马拉素则可通过ERK和 p38通路诱导HT29细胞的凋亡[14];P38MAPK 抑制剂则可提高肿瘤细胞对5-FU 抗有丝分裂效应的敏感性[15]。可见,药物可以作用于一条或多条通路发挥抗肿瘤的作用。为了明确抑制AQP-5通过哪条信号通路对HT-29细胞生长发挥抑制作用,检测了上述与细胞生长相关的几条信号通路的关键分子。Western blot检测结果显示,转染了AQP-5-siRNA的HT-29细胞磷酸化的AKT、ERK和JNK蛋白磷酸化形式表达量与总蛋白表达量的改变两者差异无统计学意义,p38蛋白磷酸化形式表达量与总蛋白表达量的比例明显下降,这表明抑制内源性AQP-5表达可能通过抑制p38通路促进HT-29细胞生长。
已有研究已经证明,p38 MAPK信号通路不仅在细胞增殖、分化、死亡及细胞间功能同步等多种生理过程中发挥作用,而且与炎症和应激反应的调控关系密切。因此,p38 MAPK被认为是细胞信息传递的纽带[16-17]。P38MAPK信号通路有4个基因编码P38MAPK,分别是MAPK14 (编码P38α)、MAPK11(编码P38β)、MAPK12(编码P38γ)和MAPK13(编码P38δ),大多数文献中P38MAPK是指P38α。本研究仅检测了几个通路的个别分子,通路的其他分子及下游分子的表达仍需进一步深入分析。如P38能通过两条途径影响细胞存活,其一是调节自吞噬,其二是激活/失活糖原合成酶激酶3β(GSK3β),导致转录因子β-catenin蓄积[18],这些通路中那些环节受AQP-5影响也需要进一步证明。本研究虽仅利用体外实验证实了AQP-5对p38 MAPK途径的作用,其具体作用机制需结合体内试验深入研究,但相信随着研究的不断深入,AQP-5会成为结肠癌治疗的新靶点。
[参 考 文 献]
[1] LAWRENCE M C, JIVAN A, SHAO C, et al. The roles of MAPKs in disease[J]. Cell Res, 2008, 18(4): 436-442.
[2] MAQNI F, SARTO C, TICOZZI D, et al. Proteomic knowledge of human aquaporins[J]. Proteomics, 2006, 6 (20): 5637-5649.
[3] KANG S K, CHAE Y K, WOO J, et al. Role of human aquaporin 5 in colorectal carcinogenesis[J]. Am J Pathol, 2008, 173(2):518-525.
[4] WOO J, LEE J, CHAE Y K, et al. Overexpression of AQP5, a putative oncogene, promotes cell growth and transformation[J]. Cancer Lett, 2008, 264 (1): 54-62.
李金枝的话把我弄糊涂了,我赶紧顺着李金枝手指的方向看去。我脑袋里嗡了一下。即使没戴眼镜,我也知道自己是光着身子的。为了确认事实,我又用手摸了摸自己。坏了,真坏了,不仅光着身子,而且光得非常彻底,真正的一丝不挂。
[5] JUNG H J, PARK J Y, JEON H S, et al. Aquaporin-5: a marker protein for proliferation and migration of human breast cancer cells[J]. PLoS One, 2011, 6 (12): e28492.
[6] ISHIMOTO S, WADA K, USAMI Y, et al. Differential expression of aquaporin 5 and aquaporin 3 in squamous cell carcinoma and adenoid cystic carcinoma[J]. Int J Oncol, 2012, 41 (1): 67-75.
[7] 张洪志, 周士福, 康厚纯, 等. 水通道蛋白5在人大肠癌组织中的表达及其临床意义[J]. 苏州大学学报(医学版), 2009, 29 (5): 945-947.
[8] 肖广发, 汤恢焕, 李宜雄. AQP-1和AQP-5在结直肠癌中的表达及其临床意义[J]. 细胞与分子免疫学杂志, 2012, 28 (2): 186-187.
[9] RUBY J, REHANI K, MARTIN M. Treponema denticola activates mitogen-activated protein kinase signal pathways through Toll-like receptor 2[J]. Infect I mmun, 2007, 75 (12): 5763-5768.
[10] ZHANG W, LIU H T. MAPK signal pathways in the regulation of cell proliferation in mammalian cells[J]. Cell Res, 2002, 12 (1): 9-18.
[11] 杨柳松, 胡锦, 周良辅, 等. 酪氨酸激酶受体通路相关基因在原发胶质母细胞瘤中的表达及其意义[J]. 中国癌症杂志, 2008, 18(4): 254-257.
[12] HAMADA K, SASAKI T, KONI P A, et al. The PTEN/PI3K pathway governs normal vascular development and tumor angiogenesis[J]. Genes Dev, 2005, 19 (17): 2054-2065.
[13] PARK E Y, WILDER E T, CHIPUK J E, et al. Retinol decreases hosphatidylinositol 3-kinase activity in colon cancer cells[J]. Mol Carcinog, 2008, 47 (4): 264-274.
[14] LIM J H, WOO S M, MIN K J, et al. Rottlerin induces apoptosis of HT29 colon carcinoma cells through NAG-1 upregulation via an ERK and p38 MAPK-dependent and PKC δ-independent mechanism[J]. Chem Biol Interact, 2012, 197 (1): 1-7.
[15] VAIDYA A A, SHARMA M B, KALE V P. Suppression of p38-stress kinase sensitizes quiescent leukemic cells to antimitotic drugs by inducing proliferative responses in them[J]. Cancer Biol Ther, 2008, 7 (8): 1232-1240.
[16] ALISI A, SPAZIANI A, ANTICOLI S, et al. PKR is a novel functional direct player that coordinates skeletal muscle differentiation via p38 MAPK/AKT pathways[J]. Cell Signal, 2008, 20 (3): 534-542.
[17] MARKOVIC D, PUNN A, LEHNERT H, et al. Intracellular mechanisms regulating corticotropin-releasing hormone receptor-2beta endocytosis and interaction with extracellularly regulated kinase 1/2 and p38 mitogen-activated protein kinase signaling cascades[J]. Mol Endocrinol, 2008, 22 (3): 689-706.
[18] THORNTON T M, PEDRAZA-ALVA G, DENG B, et al. Phosphorylation by p38 MAPK as an alternative pathway for GSK3beta inactivation[J]. Science, 2008, 320 (5876): 667-670.
《抗癌》杂志2013年征订启事
《抗癌》杂志于1988年创刊,主管单位为上海市科学技术协会,主办单位为上海市抗癌协会。《抗癌》杂志是供癌症患者及其家属阅读的公益性科普期刊,树立了为科研服务的思想意识,坚持以读者为导向,架起读者和医院之间的桥梁。杂志刊号:CN31-1664/R ISSN 1008-3065。欢迎广大读者订阅。
杂志为季刊,每期48页。本刊季末出版,每期5元,全年共20元整。征订方式请通过邮局汇款。
通讯地址:上海市东安路270号6号楼3楼《抗癌》杂志社收。
邮 编:200032
电 话:021-64043766
传 真:021-64043766
电子邮件:anti-cancer@163.com
Effect of AQP-5-siRNA on the signaling pathway of human colon cancer HT-29 cells
SHI Xiao-ming, WU Sheng-chun, DONG Jun-jie, TANG Lei, YANG Yong-bin, LV Bo-nan (1.Department of General Surgery, Hebei General Hospital, Shijiazhuang Hebei 050051, China; 2. Medical Information Institute of Hebei Province, Shijiazhuang Hebei 050071, China)
LV Bo-nan E-mail: shixm99@163.com
Background and purpose: Aquaporin 5 (AQP-5) was overexpressed in colon cancer tissues, and AQP-5 was related to occurrence, progress of colon cancer. But the relationship between AQP-5, signaling pathway in colon cancer cells is still not clear. The purpose of this study was to investigate the effects of AQP-5 on the signaling pathway of human colon cancer HT-29 cells by inhibiting the expression of endogenous AQP-5 in colon cancer cell line HT-29 via AQP-5-siRNA transfection. Methods: Human colon cancer HT-29 cells were cultured in vitro and the cells in logarithm growth period were used. RNA interference (siRNA) technology was used to inhibit the expression of endogenous AQP-5 and Western blot was used to detect the inhibition efficiency of AQP-5-siRNA in HT-29 cells. MTT assay were used to detect the cell growth inhibition rate; Flow cytometry (FCM) was used to measure the cell apoptosis rate; To observe the effects of AQP-5-siRNA transfection on AKT, ERK, JNK and P38 pathway of HT-29 cells, the levels of the expression of AKT, ERK, JNK and P38 phosphorylation protein and total protein were measured by Western blot. Results: The results of Western blot showed that AQP-5 expression was suppressed by over 90% in HT-29 cells after AQP-5-siRNA transfection. MTT showed that the proliferation inhibition rate was increased significantly in HT-29 cells after AQP-5-siRNA transfection rather than NS-siRNA transfection (P<0.05); FCM analysis showed that AQP-5-siRNA transfection induced HT-29 cell apoptosis (P<0.05). Western blot showed that compared with NS-siRNA negative control group, AQP-5-siRNA transfection decreased the rates of p-p38 and p38. However, the level of the expression of AKT, ERK, JNK phosphorylation protein was not different between AQP-5-siRNA transfection group and NS-siRNA negative control group (P>0.05). Conclusion: The RNA interference (siRNA) technology targeting to AQP-5 inhibited the expression of endogenous AQP-5 in HT-29 cells, inhibited the cell proliferation, and induced the cell apoptosis, and the effect may be related with its decreasing the rate of p-p38 and p38.
Aquaporin 5; Colonic neoplasms; Signaling pathway
10.3969/j.issn.1007-3969.2013.04.007
R735.3+5
:A
:1007-3639(2013)04-0279-06
2012-10-10
2013-02-10)
吕柏楠 E-mail:shixm99@163.com

