CYP2E1 DraⅠ基因遗传多态性与青海省胃癌人群易感性的相关性研究
燕速白振忠赵健信谢大伟吴俊麒马新福王海洁
1.青海大学附属医院胃肠肿瘤外科,青海 西宁 810001;
2.青海大学高原医学教育部重点实验室,青海 西宁 810001
CYP2E1 DraⅠ基因遗传多态性与青海省胃癌人群易感性的相关性研究
燕速1白振忠2赵健信1谢大伟1吴俊麒1马新福1王海洁2
1.青海大学附属医院胃肠肿瘤外科,青海 西宁 810001;
2.青海大学高原医学教育部重点实验室,青海 西宁 810001
背景与目的:胃癌是青海省最常见的恶性肿瘤和致死病因之一,生活环境中的前致癌物质需要经过体内代谢酶代谢并转化为致癌物质,CYP2E1是人体内重要的Ⅰ相代谢酶,已知CYP2E1在不同人种、不同地区存在基因多态性,本研究旨在探讨CYP2E1 DraⅠ基因遗传多态性与青海地区人群胃癌易感性的相关性。方法:采用病例对照分子流行病的研究方法,并用数字表法随机选取世居青海的胃癌患者120例(胃癌组)和与之匹配的同期世居青海的健康体检者120例(对照组),应用PCR-RFLP技术对两组人群CYP2E1 DraⅠ位点的不同基因型及等位基因进行检测,分析其在两组间的分布特征。结果:CYP2E1基因DraⅠ位点各不同基因型(包括C/C、C/D、D/D)在胃癌组和对照组中的分布频率分别为58.33%、35.00%、6.67%和58.33%、38.34%、3.33%,两组差异无统计学意义(P分别=1.00、0.59、0.24);CYP2E1基因DraⅠ位点的等位基因(C和D)在胃癌组和对照组中的分布频率为75.83%、24.17%和77.50%、22.50%,两组差异无统计学意义(χ2=0.19,P=0.67);CYP2E1基因DraⅠ多态性位点突变基因型(C/D、D/D)与高/高中分化胃腺癌的发生相关(χ2=4.49,P=0.03,OR=3.5,95%CI:1.04~11.80),是青海地区发生高/高中分化胃腺癌的危险因素;CYP2E1 DraⅠ野生纯合子(C/C)与低分化胃腺癌的发生相关(χ2=3.97,P=0.049,OR=0.54,95%CI:0.29~1.00),是发生低分化胃腺癌的危险因素。结论:CYP2E1 DraⅠ基因遗传多态性与青海地区人群不同分化程度胃腺癌易感性存在一定相关性,携带CYP2E1 DraⅠ野生型纯合子(C/C)者易发生低分化胃腺癌,携带突变纯合子(D/D)和突变杂合子(C/D)者易发生高分化及高中分化胃腺癌。
青海;胃癌;CYP2E1 DraⅠ;基因多态性
胃癌的发生是外界环境因素与内在遗传因素相互作用的结果,而代谢酶遗传多态性与个体肿瘤易感性的关系是胃癌病因学研究的重要内容之一[1]。青海是我国胃癌高发和高病死率地区之一,究其原因,可能与久居青藏高原或亚高原有关。该地区世居着藏族、回族及汉族等多民族,各民族具有独特的生活习惯及饮食习惯。生活环境中存在的某些可能导致胃癌发生的物质,如亚硝胺类、多环芳羟类化合物、3,4苯并芘及黄曲霉毒素等物质[2],这些物质需要经过细胞色素CYP2E1代谢酶活化并最终转化为致癌物。CPY2E1基因位于人第10号染色体上,含11 413个碱基对,翻译产物为由497个氨基酸组成的功能蛋白质,该蛋白能够活化大部分前致癌物和前毒物,是人体内重要的Ⅰ相代谢酶。研究发现CYP2E1在不同地区、不同人种中存在基因多态性[2-4]。本研究通过检测CYP2E1 DraⅠ不同基因型和等位基因在世居青海的胃癌患者及健康体检者中的分布特征,探讨CYP2E1基因遗传多态性是否与青海地区胃癌易感性存在某种关联。
1 材料和方法
1.1 研究对象
分组严格遵循随机、均衡及盲法原则,1名研究生专门负责登记住院胃癌患者及门诊健康体检人群临床病例资料并输入电脑,排序后存档。然后,由另1名研究生负责抽样,严格遵循规定的诊断标准、入组标准及剔除标准,并采用计算机随机数字表法随机抽取胃癌病例入胃癌组及健康体检者入对照组,按照性别、年龄及民族进行均衡性检验,保证胃癌组和对照组具有可比性。
1.1.1 胃癌组
抽取2010年1月—2012年4月在青海大学附属医院胃肠肿瘤外科住院的胃癌新发病例,共计120例入组。患者年龄31~81岁,平均年龄55.96岁;男性98例,女性22例;回族32例,藏族10例,汉族70例,其他民族8例。所有入组胃癌患者均世居青海地区。
1.1.2 对照组
抽取同期在青海大学附属医院门诊体检中心的健康体检者,共计120例配对入组。年龄32~80岁,平均年龄55.79岁;男性102例,女性18例;回族29例,藏族12例,汉族71例,其他民族8例。所有入组健康体检者均世居青海地区。
1.2 方法
1.2.1 主要试剂及材料
基因组DNA的提取:采用德国Qiagen公司全血DNA试剂盒(QIAamp DNA Blood Mini Kit),按试剂盒操作说明从抗凝全血中提取人基因组DNA。Taq DNA多聚酶及DNA分子量对照由北京天恩泽基因科技有限公司提供,扩增包括DraⅠ限制性内切酶酶切位点的片段所需的引物由北京擎科生物技术有限公司提供,限制性内切酶DraⅠ由纽英伦生物技术(北京)有限公司提供。溴化乙锭(EB)工作液浓度为0.5 μg/mL,PCR Magic Mix预配液及氯化镁液(25 mmol/L)购自北京天恩泽基因科技有限公司。
1.2.2 主要仪器设备
48孔梯度PCR仪由美国Bio-Rad公司提供,小型台式离心机及移液器由德国Eppendorf公司提供,恒温培养振动器(ZHWY-20013)由上海智诚分析仪器制造有限公司提供,格兰仕微波炉产自广州省佛山市,DYY-8C型电泳仪产自北京市六一仪器厂,凝胶成像分析系统(UVP800)产自美国,电子秤(BL-220H)及Centrifuge(PMC-860)产自日本,-80 ℃海尔冰箱产自中国青岛,智能型电热恒温鼓风干燥箱由上海琅玕实验设备有限公司提供。
1.2.3 外周血基因组DNA提取
采用含EDTA抗凝真空采血管抽取清晨空腹外周静脉血5 mL,立即离心分离出血浆和血细胞,置-20 ℃冰箱保存,批量(每20个血样为一批次)进行白细胞基因组DNA的提取。血细胞阶梯式解冻置室温后,EP管中加入20 μL 的QIAGEN Protease,再加入200 μL的血样及200 μL的Buffer AL缓冲液,振荡器上振荡15 min后,在56 ℃的温育器中温育10 min,移去EP管中的沉淀,加入200 μL的Ethanol (96%~100%)离心1 min,将20个EP管中的上层液体分别移至20个QIAamp Mini spin Colum,8 000 r/min离心1 min,将盛有离心过滤物的20个收集试管弃去,再分别向20个QIAamp Mini spin column 加入500 μL的Buffer AW1,8 000 r/min离心1 min,再次将盛有离心过滤物的20个收集试管弃去,加入500 μL的Buffer AW2,14 000 r/min离心3 min,将盛有离心过滤物的20个收集试管弃去,加入200 μL的Buffer AE,在室温下静置5 min,再将上述20个QIAamp Mini spin column (联同容积为1.5 mL的微量离心管) 8 000 r/min离心1 min,DNA便存在于EP管,置于-20 ℃冰箱保存。
1.2.4 引物设计与合成
根据参考文献及Primer premier 5.0软件设计所需引物,引物由北京擎科生物技术有限公司合成,CYP2E1 DraⅠ上游引物为5’-CTGCTGCTAATGGTCACTTG-3’;下游引物为5’-GGAGTTCAAGACCAGCCTAC-3’。
1.2.5 PCR扩增
PCR反应总体积为25 μL,包括预配液MasterMix12.5 μL,上、下游引物各0.5 μL,模板DNA 1.0 μL,无菌去离子水8.25 μL,Mg2+液2.0 μL。用美国Bio-Rad公司提供的48孔梯度Mini PCR仪进行扩增。PCR反应条件:95 ℃预变性3 min,95 ℃变性20 s,65 ℃退火30 s,72 ℃延伸40 s,共35个循环,于72 ℃下延伸10 min,最后4 ℃延伸16 h后结束反应。用2%琼脂糖凝胶电泳检测扩增产物,9.0 μLDNA样本与3.0 μL Loading Buffer反复吹打混匀加样至混有溴乙啶(0.5 mg/mL)的胶上,于盛有l×TBE缓冲液的电泳槽内电泳30 min,电压100 V,于凝胶成像分析系统仪下观察结果并记录保存,PCR扩增产物为686 bp。
1.2.6 RFLP酶切
CYP 2E1基因DraⅠ酶切体系酶切的总体积为20.0 μL;其中内切核酸酶DraⅠ为1.0 μL,4×缓冲液2.0 μL,PCR扩增产物17.0 μL。
混匀后,放入37 ℃恒温温育箱中温育15~18 h。酶切产物15.0 μL用2%琼脂糖凝胶电泳分析,加样至混有溴乙啶(0.5 mg/mL)的胶上,于盛有1×TBE缓冲液的电泳槽内电泳100 min,电压60 V,于凝胶成像分析系统仪下观察结果并记录保存。
1.2.7 基因型判定
DNA样品经PCR扩增后产生686 bp片段;CYP2E1 C/C基因型者经内切酶DraⅠ消化,可见酶切图谱:335、351 bp;CYP2E1 D/D基因型者相应基因序列发生T→A突变,失去DraⅠ酶切位点,酶切图谱只见686 bp条带;CYP2E1 C/D杂合基因型者可见686 bp、335 bp、351 bp 3条带,以此判断基因型(图1、图2)。
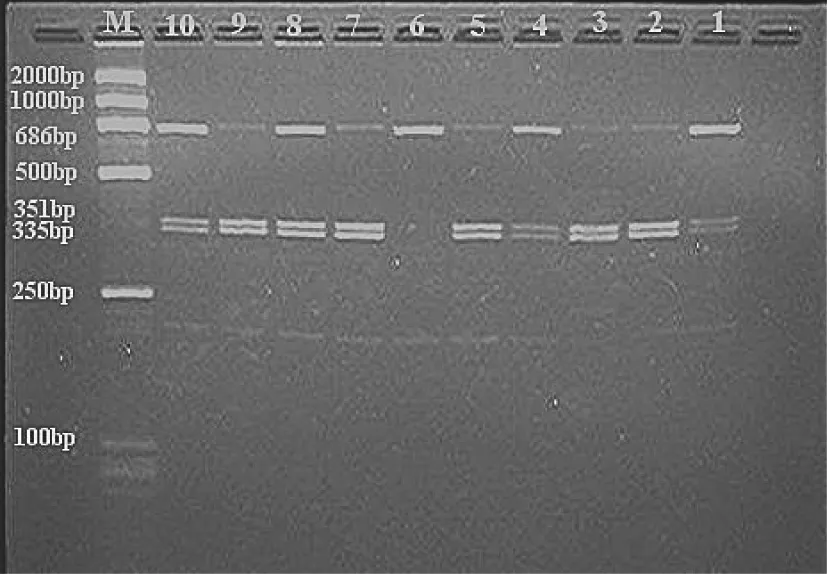
图 1 CYP2E1 DraⅠ酶切电泳图(胃癌组)Fig. 1 The electrophoretogram of CYP2E1 DraⅠ after PCRRFLP in the gastric cancer group

图 2 CYP2E1 DraⅠ酶切电泳图(对照组)Fig. 2 The electrophoretogram of CYP2E1 DraⅠ after PCRRFLP in the control group
1.3 统计学处理
采用SPSS 13.0统计软件包对数据进行统计学处理。胃癌组和对照组一般临床资料中计量资料采用t检验,计数资料采用χ2检验;Hardy-Weinberg遗传平衡检验两组基因型分布频率是否达到遗传平衡;CYP2E1 DraⅠ各基因型和等位基因在两组间分布频率采用χ2检验;以比值比(OR)和95%可信区间(95%CI)为相对危险度指标,评估CYP2E1 DraⅠ不同基因型与胃癌易感性和胃腺癌分化程度的相关性。规定检验水准为α=0.05,P<0.05为差异有统计学意义。
2 结 果
2.1 遗传平衡检验
Hardy-Weinberg遗传平衡检验结果表明,胃癌组和对照组CYP2E1 DraⅠ各基因型观察值和预期值差异无统计学意义(P>0.05),符合遗传平衡定律,表明CYP2E1 DraⅠ基因型频率已达到遗传平衡,具有群体代表性。
2.2 CYP2E1 DraⅠ基因多态性与胃癌易感性的相关性分析
在检测的240例中,CYP2E1 DraⅠ基因C/C型140例(58.33%),杂合子C/D型88例(36.67%),突变纯合子D/D型12例(5.00%),两组间的基因型构成比差异无统计学意义(χ2=1.52,P=0.47,表1);CYP2E1 DraⅠ多态性位点等位基因C和D在胃癌组和对照组中的构成比(表2),两组间等位基因分布平率差异无统计学意义(χ2=0.19,P=0.67)。CYP2E1 DraⅠ与不同分化程度胃腺癌的相关性进行分层分析,结果发现CYP2E1基因Dra I多态性位点突变基因型(C/D、D/D)与高/高中分化胃腺癌的发生相关(χ2=4.49,P=0.03,OR=3.5,95%CI:1.04~11.80),是青海地区发生高/高中分化胃腺癌的危险因素;CYP2E1 DraⅠ野生纯合子(C/C)与低分化胃腺癌的发生相关(χ2=3.97,P=0.049,OR=0.54,95%CI:0.29~1.00),是发生低分化胃腺癌的危险因素(表3)。

表 1 CYP2E1基因DraⅠ位点不同基因型在胃癌组和对照组中构成比Tab. 1 Distribution frequency of different genotypes of CYP2E1 DraⅠ gene polymorphism in the gastric cancer group and the control group
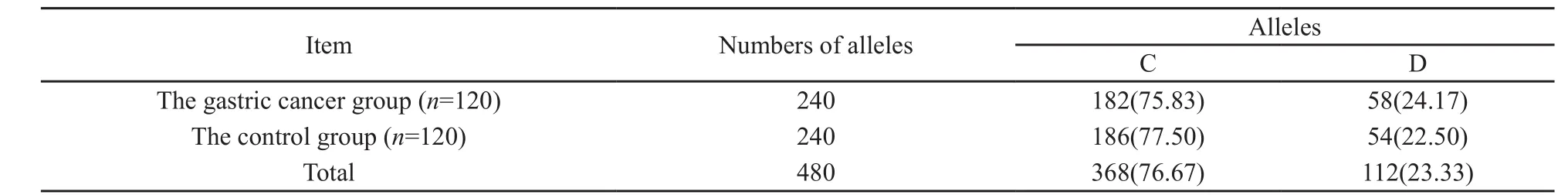
表 2 CYP2E1基因DraⅠ位点等位基因在胃癌组和对照组中的构成比Tab. 2 Distribution frequency of the alleles of CYP2E1 DraⅠ in the gastric cancer group and the control group
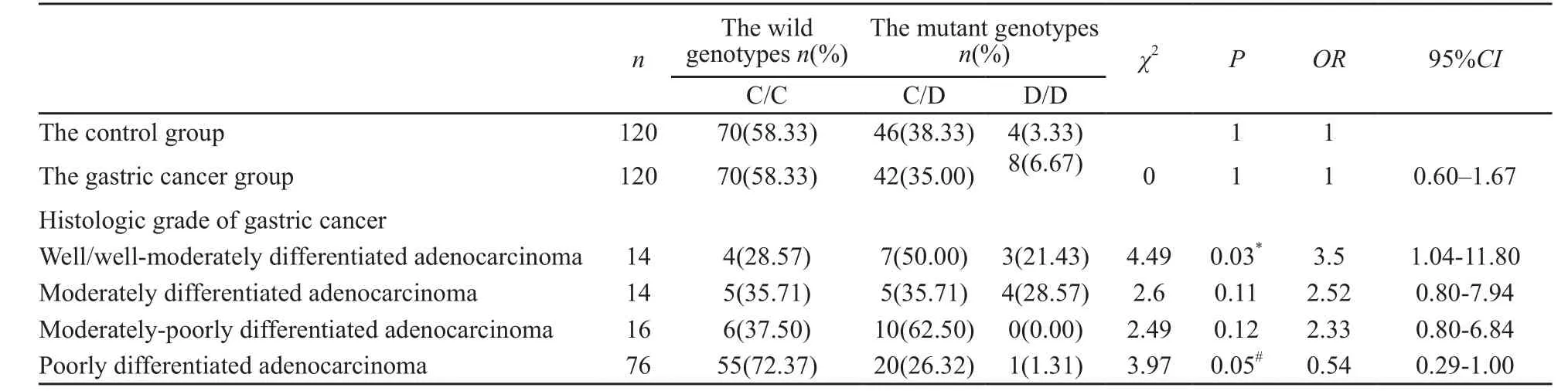
表 3 胃癌组与对照组CYP2E1 DraⅠ基因多态与胃腺癌分化程度的相关性Tab. 3 Correlation between the differentiated grade of gastric adenocarcinoma and CYP2E1 DraⅠ gene polymorphism among the gastric cancer group and the control group
3 讨 论
青海是一个多民族聚居区,世居人群以藏、回、汉等民族为主,藏族多分布在青藏高原海拔3 000米以上的牧业区,回族、土族及撒拉族以东部农业区(河湟谷地)分布为主,为适应青海的自然环境,长期以来形成了特有的生活习性,且饮食结构单一,饮水来源多样。如喜食牛羊肉、酥油糌粑等高脂、高热量食物,少食新鲜蔬菜及水果。食物中盐的摄入量较高,易损坏胃黏膜屏障,使其对致癌物质的易感性增加。加之高寒可导致人体血管收缩,长期缺氧引起的血液粘稠度增高而加重组织缺血缺氧,胃黏膜亦处于低氧状态,可能导致胃黏膜屏障受损和幽门螺杆菌在胃黏膜定植,并最终导致幽门螺杆菌感染率增高。世居青海的人群生活环境中存在的可能导致胃癌发生的物质,如亚硝胺类、多环芳羟类化合物、3,4苯并芘及黄曲霉毒素等物质,这些物质多存在于腌菜、烟熏或煎炸食物、烧烤的肉类食品及霉变食物(如青海地区储存条件较差的隔年菜籽油、农牧区食用不新鲜的肉类等食物)中,这些物质摄入体内首先经过CYP2E1等Ⅰ相代谢酶代谢后转化为致癌物[5]。国内外学者对CYP2E1基因多态性与胃癌发生的相关性研究结果有所不同[6-8],究其原因,可能与CYP2E1多态性位点,在不同民族、不同地区、不同人群中的分布频率不同,以及不同学者所采用的入组标准不同等因素有关。
本研究以世居青海地区的新发胃癌患者及同期世居青海的健康体检者为研究对象,经过Hardy-Weinberg遗传平衡检验结果表明,两组研究对象基因型分布频率达到遗传平衡,符合遗传平衡定律,具有群体代表性。虽然研究发现CYP2E1 DraⅠ的3个不同基因型(C/C、C/D、D/D)以及等位基因(C和D)在胃癌患者和健康体检者中的分布频率差异无统计学意义,但是CYP2E1 DraⅠ各基因型与不同分化程度的胃腺癌的相关性分析中发现,CYP2E1基因DraI多态性位点携带突变基因型(C/D、D/D)者与高/高中分化胃腺癌的发生相关,是青海地区发生高/高中分化胃腺癌的危险因素;携带CYP2E1 DraⅠ野生纯合子(C/C)者与低分化胃腺癌的发生相关,是发生低分化胃腺癌的危险因素。据此得出CYP2E1 DraⅠ基因遗传多态性与青海地区人群胃癌易感性存在一定相关性,携带CYP2E1 DraⅠ野生型纯合子(C/C)者易发生低分化胃腺癌,携带突变纯合子(D/D)和突变杂合子(C/D)者易发生高分化及高中分化胃腺癌。因此,检测世居青海人群CYP2E1基因DraI位点多态性,进而了解CYP2E1基因DraⅠ多态性位点基因型携带情况,有助于早期筛查胃癌高危人群及制订个体化治疗方案。
[1] SHEN X, ZHANG J, YAN Y, et al. Analysis and estimates of the attributable risk for environmental and genetic risk factors in gastric cancer in a Chinese population [J]. J Toxicol Environ Health A, 2009, 72(11-12): 759-766.
[2] TSUKINO H, KURODA Y, QIU D, et al. Effects of cytochrome P450 (CYP) 2A6 gene deletion and CYP2E1 genotypes on gastric adenocarcinoma [J]. Int J Cancer, 2002, 100(4): 425-428.
[3] PARK G T, LEE O Y, KWON S J, et al. Analysis of CYP2E1 polymorphism for the determination of genetic susceptibility to gastric cancer in Koreans [J]. J Gastroenterol Hepatol, 2003, 18(11): 1257-1263.
[4] BOCCIA S, DE LAURETIS A, GIANFAGNA F, et al. CYP2E1PstI/RsaI polymorphism and interaction with tobacco, alcohol and GSTs in gastric cancer susceptibility: A metaanalysis of the literature [J]. Carcinogenesis, 2007, 28(1): 101-106.
[5] CAI L, YU S Z, ZHAN Z F. Cytochrome P450 2E1 genetic polymorphism and gastric cancer in Changle, Fujian Province[J]. World J Gastroenterol, 2001, 7(6): 792-795.
[6] BOCCIA S, DE LAURETIS A, GIANFAGNA F, et al. CYP2E1PstI/RsaI polymorphism and interaction with tobacco, alcohol and GSTs in gastric cancer susceptibility: A metaanalysis of the literature [J]. Carcinogenesis, 2007, 28(1): 101-106.
[7] COLOMBO J, ROSSIT A R, CAETANO A, et al. GSTT1, GSTM1 and CYP2E1 genetic polymorphisms in gastric cancer and chronic gastritis in a Brazilian population [J]. World J Gastroenterol, 2004, 10(9): 1240-1245.
[8] NISHIMOTO I N, HANAOKA T, SUGIMURA H, et al. Cytochrome P450 2E1 polymorphism in gastric cancer in Brazil: case-control studies of Japanese Brazilians and non-Japanese Brazilians [J]. Cancer Epidemiol Biomarkers Prev, 2000, 9(7): 675-680.
Correlation between genetic polymorphisms of CYP2E1 DraⅠ and susceptibility of gastric cancer in Qinghai province
YAN Su1, BAI Zhen-zhong2, ZHAO Jian-xin1, XIE Da-wei1, WU Jun-qi1, WANG Haijie2(1.Department of Gastrointestinal Surgical Oncology, Affiliated Hospital of Qinghai University, Xining Qinghai 810001, China; 2.Key Laboratory of High Altitude Medicine of Ministry of Education, Qinghai University, Xining Qinghai 810001, China)
YAN Su E-mail: yansuqinghai@163.com
Background and purpose: Gastric cancer is the most common malignant tumor and the leading cause of death in Qinghai province. The possible chemical procarcinogens in our living environment must be activated and transformed ultimately into carcinogens by CYP2E1 of cytochrome, one of the most important Ⅰ phase metabolic enzymes in human body, and also the genetic polymorphisms of CYP2E1 are reportedly in different ethnic groups and in different regions. The aim of this study was to investigate the correlation between genetic polymorphisms of CYP2E1 DraⅠ and the susceptibility of gastric cancer in Qinghai province. Methods: A case control study was performed with the molecular epidemiological methods. A total of 120 gastric cancer cases (as the gastric cancer group) and 120 healthy people (as the control group) were randomly selected from affiliated hospital of Qinghai University from Jan. 2010 to Apr. 2012, and all of the individuals were living in Qinghai province. The genotypes and alleles ofCYP2E1 DraⅠ in both of the above groups were detected by polymerase chain reaction-restriction fragment length polymorphism (PCR-RFLP), and then the outcome was analyzed statistically. Results: The distribution frequency of CYP2E1 DraⅠ genotypes (including C/C, C/D, D/D) was 58.33%, 35.00% and 6.67% in the patient group respectively, 58.33%, 38.34% and 3.33% in the control group respectively, which showed no significant differences between the two groups (the value of P were 1.00, 0.59 and 0.24, respectively). The distribution frequency of CYP2E1 DraⅠ alleles (including C and D) was 75.83% and 24.17% in the patient group respectively, meanwhile, 77.50% and 22.50% in the control group respectively, which also showed no significant difference between the two groups (χ2=0.19, P=0.67). Interestingly, the mutant genotypes (C/D, D/D) of CYP2E1 DraⅠ were associated with the well and well-moderately differentiated gastric adenocarcinoma in a way (χ2=4.49 and P=0.03; OR=3.5 and 95%CI: 1.04-11.80), and it was also demonstrated that the mutant genotypes (C/D, D/D) were the risk factors for the oncogenesis of well and wellmoderately differentiated gastric adenocarcinoma; The wild homozygote (C/C) of CYP2E1 DraⅠ was related to poorly differentiated gastric adenocarcinoma (χ2=3.97 and P=0.049; OR=0.54 and 95%CI: 0.29-1.00 ), and it was still revealed that the wild homozygote (C/C) of CYP2E1 DraⅠ was the risk factor for the tumorigenesis of poorly differentiated gastric adenocarcinoma. Conclusion: The genetic polymorphisms of CYP2E1 DraⅠ are to some extent associated with the susceptibility of different differentiated gastric adenocarcinoma in Qinghai province, furthermore, carriers of wild homozygote (C/C) of CYP2E1 DraⅠ are relatively prone to the risk factor to the occurrence of poorly differentiated gastric adenocarcinoma, and carriers of mutant homozygote (D/D) and mutant heterozygote (C/D) are also liable to occur the well/well-moderated differentiated gastric adenocarcinoma in Qinghai province.
Qinghai; Gastric cancer; CYP2E1 DraⅠ; Genetic polymorphisms
10.3969/j.issn.1007-3969.2013.04.006
R735.2
:A
:1007-3639(2013)04-0273-06
2013-01-14
2013-03-20)
青海省应用基础研究项目(No:2011-Z-730);青海大学中青年科研基金(No:2010-QY-08)。
燕速 E-mail:yansuqinghai@163.com

