CD14稳定沉默胃癌细胞系的建立及其侵袭能力研究
西藏自治区人民医院消化内科,西藏 拉萨 850000
CD14稳定沉默胃癌细胞系的建立及其侵袭能力研究
李康 旦增 王中华 德吉 陈晓红 刘明花
西藏自治区人民医院消化内科,西藏 拉萨 850000
背景与目的:白细胞分化抗原14(cluster of differentiation antigen 14,CD14)为脂多糖(lipopolysaccharide,LPS)的高亲和受体,能够识别革兰阴性菌、真菌以及结核杆菌并介导机体的炎性反应,为病菌引发多种细胞信号转导的第一步,在肿瘤组织以及癌细胞中常呈异常表达。近来有研究指出,CD14启动子区的功能性突变能够影响CD14的表达,并增加幽门螺杆菌感染后罹患胃癌的风险,据此推测CD14与胃癌的发生、发展密切相关。本研究拟构建CD14-shRNA干扰载体,建立CD14稳定沉默的胃癌细胞系,初步探讨CD14对胃癌细胞侵袭能力的影响,以期为胃癌发病机制的研究奠定实验基础。方法:根据shRNA引物设计原则设计并合成4条CD14-shRNA序列,构建sh-CD14表达载体,转染MGC-803细胞,G418筛选稳转细胞系;RT-PCR检测CD14 mRNA的表达;蛋白质印迹法(Western blot)检测CD14蛋白的表达;Transwell小室模型检测细胞的侵袭能力。结果:测序结果表明,CD14-shRNA表达载体构建成功并筛选得到了CD14稳定沉默的胃癌细胞系,其CD14 mRNA以及蛋白的表达分别降低了71.7%%和63.4%;与对照组相比CD14-shRNA组细胞侵袭能力显著降低,差异有显著统计学意义(P<0.01)。结论:成功构建了CD14-shRNA干扰载体并获得了CD14稳定沉默的胃癌细胞系,初步证实CD14的沉默能够影响胃癌细胞的侵袭能力。
白细胞分化抗原14;shRNA载体构建;胃癌细胞;侵袭
[Key words]CD14; Construction of shRNA vector; Gastric cancer cells; Invasion
胃癌起源于胃壁最表层的黏膜上皮细胞,是世界上最常见的恶性肿瘤之一,严重危害着人类的健康。幽门螺杆菌(H.pylori)为微需氧革兰氏染色阴性菌,被认为是胃癌及胃黏膜相关淋巴癌的第一类致癌原。机体内免疫因子的表达能够影响幽门螺杆菌感染后的炎性反应过程及其严重程度,最终决定细菌感染的结局。CD14为细菌内毒素脂多糖(lipopolysaccharide,LPS)的高亲和受体,主要表达于单核-巨噬细胞表面,参与LPS的识别、结合并介导下游一系列的炎性反应。近来有研究指出CD14启动子区的多态性与胃癌的易感性密切相关,推测其可能与CD14的表达改变进而影响机体对LPS的识别存在某种联系[1],本研究拟建立CD14稳定沉默的胃癌细胞株,并探讨其侵袭能力的变化,以期为CD14与胃癌发生、发展的关系研究奠定基础。
1 材料和方法
1.1 材料与试剂
胃癌细胞株MGC-803由中国科学院上海生命科学研究院生物化学与细胞生物学研究所细胞库提供;总RNA提取试剂盒、TIAN Script cDNA第一链合成试剂盒、2×Taq PCR Master Mix购自天根生化科技(北京)有限公司;CD14抗体购自santa cruz;GAPDH抗体购自Abcam公司;LipofectamineTM2000、G418购自Invitrogen;BamHⅠ、HindⅢ核酸内切酶购自宝生物工程(大连)有限公司;Transwell孔板购自Corning公司;Matrigel胶购自BD公司;大肠杆菌DH5α和pGCsi-H1/Neo/GFP载体均由本实验室保存;引物委托生工生物工程(上海)有限公司合成;其他药品为国产分析纯。
1.2 shRNA载体构建
根据shRNA引物设计原则[2],设计并合成4条shRNA序列以及1条阴性对照序列,序列结构为:BamHⅠ酶切位点+Sense+Loop+Antisense+ HindⅡ酶切位点(表1),委托生工生物工程(上海)股份有限公司合成。参考文献[3]和[4]的方法,取正反向寡核苷酸各1 μL,溶解于48 μL退火缓冲液中,90 ℃变性4 min后自然退火合成双链。BamH Ⅰ和HindⅢ双酶切线性化pGCsi-H1/Neo/GFP载体。取退火后的双链2 μL,线性化载体6 μL,加入T4DNA连接酶以及10×T4连接酶缓冲液各1 μL,4 ℃连接过夜。将连接产物转化大肠杆菌DH5α感受态细胞,经氨苄青霉素筛选后挑取阳性单菌落进行测序鉴定。

表 1 CD14干扰载体构建所用shRNA序列信息Tab. 1 Information of the shRNA sequences used in the CD14 interference vector construction
1.3 细胞转染及稳转细胞系的筛选
将MGC-803细胞接种至含10% FBS的RPMI-1640培养基的6孔板,待细胞长至80%~90%融合时进行转染。按照LipofectamineTM2000转染试剂说明书配置溶液1与溶液2,将混合好的转染试剂逐滴加入细胞中,将细胞置于37℃、CO2体积分数为5%的培养箱中培养5 h,换液为含20% RPMI-1640的培养液,48 h后于荧光显微镜下观察转染效率。胰蛋白酶消化阳性细胞并传代,换液为含800 μg/mL G418的完全培养液,每2~3 天更换1次培养液,2周后将G418浓度降至400 μg/mL维持筛选,至荧光显微镜下观察到细胞形态正常且表达较强绿色荧光蛋白时分离阳性克隆并扩大培养。
1.4 RT-PCR检测
TRIzol法提取各组细胞总RNA,采用cDNA第一链合成试剂盒反转录成cDNA。按照引物设计原则设计PCR引物,CD14的上、下游引物序列分别为:5’-TCAGAGG TTCGGAAGACTTATCG-3’,5’-CTTTAGAAA CGGCTCTAGGTTGAGA-3’,扩增片段长度239 bp,β-actin上、下游引物序列分别为:5’-CTTAGTTGCGTTACACCCTTTCT TG-3’,5’-CTGTCACCTTCACCGTTCCAGT TT-3’,扩增片段长度200 bp。PCR反应体系如下:cDNA模板1 μL,上、下游引物各1 μL,2×Taq PCR Master-mix 10 μL,ddH2O补足总体积至20 μL。PCR反应条件为:95 ℃ 5 min;95 ℃ 20 s,58 ℃ 20 s,72 ℃ 30 s,共30个循环;72 ℃ 5 min。PCR反应结束后于1.5%琼脂糖凝胶上进行电泳,凝胶成像系统拍照成像,以β-actin为内参进行灰度分析。
1.5 蛋白质印迹法(Western blot)检测
在细胞中加入RIPA裂解液提取总蛋白,BCA法定量蛋白。取4 μg蛋白进行SDS-PAGE,电泳结束后电转移至PVDF膜上,5%脱脂奶粉封闭5 min。加入稀释一抗(CD14按1∶500稀释,GAPDH按1∶1 000稀释),4 ℃温育过夜。加入1∶4 000倍稀释的二抗,37 ℃温育45 min。温育结束后,ECL底物发光法进行曝光。洗涤PVDF膜,剥脱后加入1∶10 000内参抗体,4 ℃温育过夜,曝光成像。
1.6 Transwell检测
选择对数生长期的细胞进行实验,调整细胞密度至1×106个/mL,接种100 μL细胞于已包被好Matrigel的Transwell小室的上室,下室加入500 μL完全培养液,置于37℃、CO2体积分数为5%的培养箱中培养。48 h后取出小室,擦去未侵袭的细胞,4%甲醛室温固定20 min,苏木素染色3 min,倒置显微镜下(200×)计数侵袭细胞数,每组选取5个视野,计算均数。
1.7 数据学处理
2 结 果
2.1 CD14-shRNA载体的鉴定
经测序鉴定,4个CD14-shRNA载体均含有相应的shRNA片段(图1),且序列未发生突变,表明已成功构建了CD14-shRNA载体。
2.2 干扰效率鉴定以及稳转细胞系的筛选
将CD14-shRNA-3干扰片段连接入带有GFP荧光标记的pGCsi-H1/Neo/GFP后转染细胞,转染48 h即可观察到发出绿色荧光的细胞(图2B),表明重组载体已得到了表达。G418筛选4周后,细胞大面积发出绿色荧光(图2C),表达率达90%以上,表明已得到CD14-shRNA稳定转染的细胞系。灰度分析结果表明,与未转染组相比CD14-shRNA稳定转染组CD14 mRNA的相对表达量降低了71.7%(图3),蛋白的相对表达量降低了63.4%(图4),差异均有统计学意义(P<0.05),表明此干扰载体有效抑制了MGC-803细胞中CD14的表达。
2.4 CD14对胃癌细胞侵袭能力的影响
Transwell检测细胞侵袭能力,每组选择5个视野,计数侵袭至膜下的细胞数目,取均数,结果CD14-shRNA组细胞侵袭数(107±9)个显著低于对照组的(131±8)个,差异有统计学意义(P<0.01),表明CD14影响了胃癌细胞的侵袭(图5)。
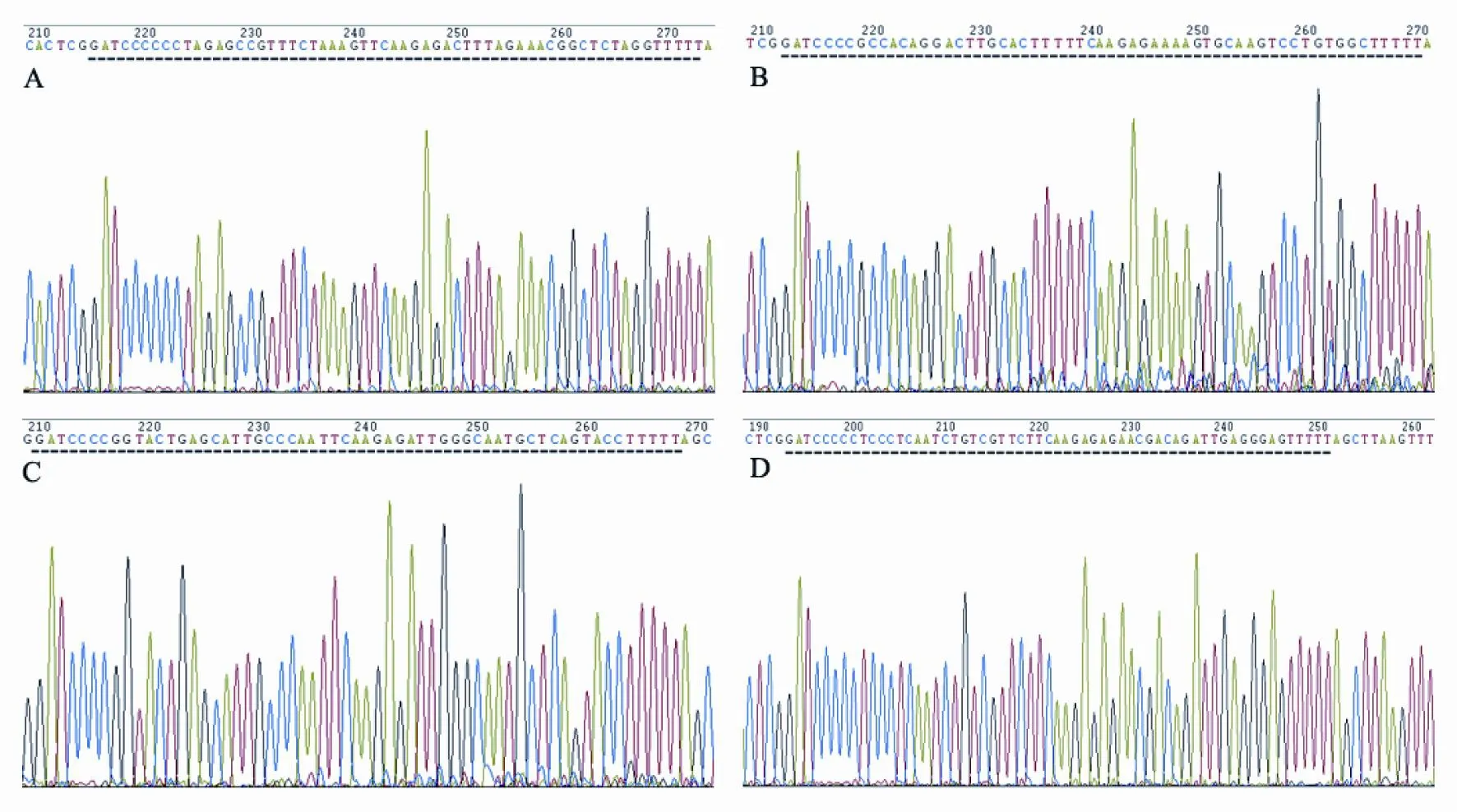
图 1 CD14-shRNA载体插入部分测序图Fig. 1 Sequencing map of the insert part of CD14-shRNA vectors
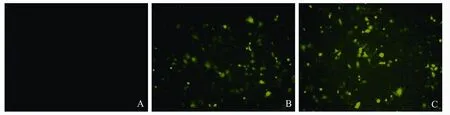
图 2 细胞转染后荧光显微镜观察Fig. 2 Transfected cells under fluorescent microscopy
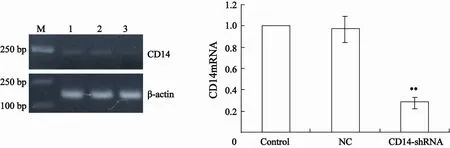
图 3 RT-PCR检测CD14 mRNA的表达Fig. 3 Expression of CD14 mRNA detected by RT-PCR (, n=3)
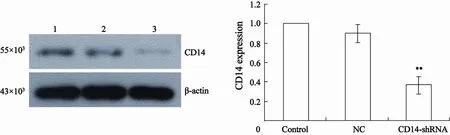
图 4 Western blot检测CD14蛋白的表达Fig. 4 Expression of CD14 protein detected by Western blot (, n=3)
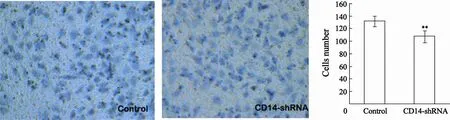
图 5 Transwell检测细胞侵袭能力Fig. 5 Cell invasion detected by Transwell (, n=3)
3 讨 论
CD14基因位于人5号染色体的长臂,编码一段含有375个氨基酸残基的多肽[5]。CD14具有两种存在形式,即膜结合型(mCD14)和可溶型(sCD14)。mCD14为单核-巨噬细胞的表面分化抗原,因能够与LPS-LBP结合而被认为是LPS的高亲和受体[6]。LPS为幽门螺杆菌等革兰阴性菌的主要毒性物质,能够与多种蛋白结合引发机体的炎性反应,因此,CD14在病菌感染及介导炎性反应中发挥了重要的作用。近年来有报道指出,CD14启动子区的多态性与胃癌的发生、发展密切相关[7],推测其原因可能是CD14启动子区的转录因子结合位点的改变影响了CD14的表达。
本实验室根据shRNA的设计原则分别位于转录起始位点后的第574、794和898 bp以及1 216 bp处设计了4条CD14-shRNA序列,并将其中1条序列打乱作为阴性对照,经NCBI的Blast检索以确保序列的特异性。将合成寡核苷酸退火合成双链后连接入带有GFP荧光标记的干扰载体pGCsi-H1/Neo/GFP,测序结果与预期一致,表明CD14干扰载体构建成功。pGCsi-H1/ Neo/GFP载体不仅具有新霉素筛选标记还带有绿色荧光蛋白标记,能够在细胞转染中通过观察发出绿色荧光细胞的数目检测转染效率。经过4周的筛选,镜下已可以观察到90%以上的细胞发出了绿色荧光,表明已得到了CD14-shRNA稳定转染的胃癌细胞系。经过检测位于898 bp处的CD14-shRNA-3转染组CD14 mRNA和蛋白的相对表达量分别降低了71.7%和63.4%,表明本研究已经成功筛选得到了CD14稳定低表达的胃癌细胞系,为研究CD14与胃癌发生、发展的关系提供了良好的细胞模型。
侵袭和转移是恶性肿瘤最普遍的生物学特征,也是影响患者生存和预后的关键因素,胃癌不仅发病率高且在中晚期极易发生转移,成为治疗失败的主要原因。目前,有关CD14与细胞侵袭及迁移有关的报道较少,Mina等[8]以CD14过表达细胞培养上清液作为趋化因子干预人脐静脉内皮细胞,发现内皮细胞的迁移能力显著增强,Dong等[9]在侵袭能力较强的前列腺癌细胞株PC3中发现TLR4以及CD14、MD等蛋白的表达升高,提示CD14/TLR4通路与癌细胞的侵袭能力呈正相关。本研究中CD14稳定沉默细胞株的侵袭能力显著低于对照组,进一步表明CD14在介导肿瘤细胞侵袭及转移中发挥着重要的作用,但其详细的作用机制还有待于进一步探讨。
[1] HUBACEK J A, ROTHE G, PITHA J, et al. C(-260)>T polymorphism in the promoter of the CD14 monocyte receptor gene as a risk factor for myocardial infarction[J]. Circulation, 1999, 99(25): 3218-3120.
[2] REYNOLDS A, LEAKE D, BOESE Q, et al. Rational siRNA design for RNA interference[J]. Nat Biotechnol, 2004, 22(3): 326-330.
[3] 王旭东, 丁伟峰, 鞠少卿, 等. 凋亡蛋白抑制因子livin基因siRNA表达载体的构建与转染[J]. 南通大学学报, 2007, 27(2): 92-94.
[4] 白莉, 祝蓉, 陈智鸿, 等. 靶向EGFR基因的siRNA表达载体构建及其生物学效应的研究[J]. 第三军医大学学报, 2005, 27(23): 2307-2310.
[5] BALBINI M, LOHMAN I C, HALONEN M, et al. A Polymorphism asterisk in the 5’-flanking-region of the CD14 gene is associated with circulating soluble CD14 levels and total serum immunoglobulin-E[J]. Ame J Resp Cell Mole Biol, 1999, 20(5): 976-983.
[6] ZANONI I, OSTUNI R, MAREK L R, et al. CD14 controls the LPS-induced endocytosis of Toll-like receptor 4[J]. Cell, 2011, 147(4): 868-880.
[7] ZHAO D, SUN T, ZHANG X, et al. Role of CD14 promoter polymorphisms in Helicobacter pylori infection-related gastric carcinoma[J]. Clin Cancer Res, 2007, 13(8): 2362-2368.
[8] MINA S, SAYEON C. CD14 acts as an angiogenic factor by inducing basic fibroblast growth factor(bFGF) [J]. Bull Korean Chem Soc, 2007, 28(9): 1613-1614.
[9] HUA D, LIU M Y, CHENG Z D, et al. Small interfering RNA-directed targeting of Toll-like receptor 4 inhibits human prostate cancer cell invasion, survival, and tumorigenicity[J]. Mol Immunol, 2009, 46: 2876-2884.
《上海医学影像》杂志2013年征订启事
《上海医学影像》杂志自1992年创刊以来深受医学界赞颂,1998年经国家科委、中央新闻出版总署批准为国内外公开发行正式期刊,刊号:ISSN 1008-617X,CN31-1793/R。杂志由优质铜版纸印制,大16开,80页,暂定为季刊。被中国学术期刊综合评价数据库、中国核心期刊(遴选)数据库、中国期刊全文数据库等收录。主要报道医学影像领域中科研成果、临床应用、综述、病例报告、讲座及与理工结合的有关论文等。
《上海医学影像》坚持学术性与科学性,信息量大具有临床实用价值。是医院图书馆、影像科室及高等院校的学术刊物,是临床医学影像医务人员晋升中、高级职称的重要论文发表园地。欢迎各医学院校、医学图书馆、影像科室及个人向当地邮局订阅。
本刊季末出版,邮发代号4-653,暂定价每期10元,每年共40元整。
单位全称:《上海医学影像》杂志编辑部
通讯地址:上海市东安路270号复旦大学附属肿瘤医院
邮编:200032
电话:(021)54244927 (021)64043766
传真:(021)54244927
E-mail:imaging109@163.com
The research on the construction of gastric cancer cells with CD14 silencing and it's invasion ability
LI Kang, DAN Zeng, WANG Zhong-hua, DE Ji, CHEN Xiao-hong, LIU Ming-hua (Department of Gastroenterology, People’s Hospital of Tibet Autonomous Region, Lhasa Tibet 850000, China)
LI Kang E-mail: likang820@yahoo.com.cn
Background and purpose: Cluster of differentiation antigen 14(CD14), a high-affinity receptor for the lipopolysaccharide (LPS), could identify the gram-negative bacteria, fungi and mycobacterium tuberculosis, and mediate the inflammatory response of infected body, which is the first step in bacteria induced signal transduction. Expression of CD14 often turned to be abnormal in the tumor tissue and cancer cells. Recent studies have observed that functional CD14 polymorphisms, especially in the promoter motifs, are associated with a higher risk of H.pylori-related gastric carcinoma, indicated that CD14 is closely associated with the development of gastric cancer. This study aimed to construct CD14-shRNA expression vector and gastric cancer cells with CD14 silencing and to discuss the influence of CD14 on the invasion ability of gastric cancer cells and to lay a experimental basis for the study of the pathogenesis of gastric cancer. Methods: Four CD14-shRNA sequences were synthesized and CD14-shRNA expression vector was constructed to transfect cells and gastric cancer cells with CD14 silencing were screened by G418. RT-PCR and Western blot was used to detect the CD14 mRNA and protein level. The invasion ability of gastric cancer cells was detected by Transwell chamber. Results: CD14-shRNA expression vector was successfully constructed and screened to obtain gastric cancer cells with CD14 silencing, of which the CD14 mRNA and protein silencing efficiency were 71.7% and 63.4% respectively. Compared with the control group, the invasion ability of CD14-shRNA group was decreased obviously with statistical differences (P<0.01). Conclusion: Gastric cancer cells with CD14 silencing are constructed successfully and the influence of CD14 on the invasion ability of gastric cancer cells is preliminarily confirmed.
10.3969/j.issn.1007-3969.2013.04.003
R735.2
:A
:1007-3639(2013)04-0254-06
2013-01-21
2013-04-04)
国家自然科学基金资助项目(No: 81060165)。
李康 E-mail:likang820@yahoo.com.cn

