白介素8的3种亚型对卵巢癌SKOV3细胞生物学活性的影响
广西医科大学肿瘤医院妇瘤科,广西区域高发肿瘤重点实验室,广西 南宁530021
白介素8的3种亚型对卵巢癌SKOV3细胞生物学活性的影响
王爱萍 王琪 张玮 尹巧云 李力
广西医科大学肿瘤医院妇瘤科,广西区域高发肿瘤重点实验室,广西 南宁530021
背景与目的:卵巢癌的进展是一种多因素、多环节、多阶段的过程,近来研究表明卵巢癌患者白介素8(IL-8)水平显著高于良性肿瘤患者及健康人群,卵巢癌的生长和转移可能与过度表达的IL-8有关,但尚无报道表明IL-8主要亚型在卵巢癌中的作用。本研究探讨IL-8的3种亚型IL-8(1-77)、IL-8(5-77)和IL-8(9-77)对卵巢癌SKOV3细胞的增殖、生长、迁移和侵袭能力的影响及其作用机理。方法:确认分别获得IL-8的3种亚型稳定转染的SKOV3细胞后,应用MTT比色测定法比较各细胞的生长曲线;采用流式细胞仪比较各细胞的细胞生长周期;采用集落形成实验比较各组细胞的克隆率;运用Transwell小室比较各细胞体外迁移和侵袭能力。结果:IL-8(1-77)-pwpi-SKOV3细胞和IL-8(5-77)-pwpi-SKOV3在G2期的比率明显高于SKOV3(P=0.017,P=0.020);IL-8(1-77)-pwpi-SKOV3和IL-8(5-77)-pwpi-SKOV3细胞克隆率明显高于SKOV3(P=0.000,P=0.001),IL-8(9-77)-pwpi-SKOV3细胞克隆率明显低于SKOV3(P=0.013);细胞体外迁移能力多组间差异无统计学意义(P>0.05),但细胞体外侵袭能力IL-8(1-77)-pwpi-SKOV3和IL-8(5-77)-pwpi-SKOV3明显强于SKOV3(P=0.000,P=0.002),IL-8(9-77)-pwpi-SKOV3明显弱于SKOV3(P=0.067)。结论:IL-8(1-77)和IL-8(5-77)可能促进卵巢癌SKOV3细胞的生长和增殖,并增强其侵袭能力,而IL-8(9-77)对卵巢癌SKOV3细胞增殖可能有抑制作用。
卵巢上皮癌;IL-8亚型;生物学功能
目前的研究认为,IL-8对肿瘤的发生具有双向性,一方面通过调节金属蛋白酶促进血管生成等刺激肿瘤生长[1-2]; 另一方面则趋化中性粒细胞和巨噬细胞到肿瘤部位抑制肿瘤生长[3]。这种看似矛盾的结果,提示在不同环境、诱导剂作用下产生的IL-8的亚型可能是不同的,而不同亚型的IL-8在肿瘤的发生发展中也可能发挥着不同的作用。本组前期研究采用免疫芯片PS20结合蛋白质芯片飞行质谱(SELDI-TOF-MS)技术检测卵巢癌患者与良性肿瘤患者及健康人群血清中不同亚型IL-8表达,结果发现,卵巢良性肿瘤患者的IL-8(1-77)亚型表达显著高于恶性肿瘤患者(P<0.01),恶性肿瘤患者血清中IL-8(9-77)和IL-8(5-77)亚型含量比良性肿瘤患者显著升高(P<0.01);早期肿瘤患者IL-8(1-77)亚型表达显著高于晚期肿瘤患者,IL-8(9-77)和IL-8(5-77)亚型却与之相反[4]。本实验先期已成功将IL-8 3种亚型IL-8(1-77)、IL-8(5-77)、IL-8(9-77)转染至无IL-8蛋白表达的卵巢癌SKOV3细胞株中[5]。因为体外培养的卵巢癌细胞不分泌IL-8[6],为了探讨IL-8亚型对卵巢癌的作用机理,我们选取无IL-8蛋白表达的卵巢癌SKOV3细胞作为转染对象,分别稳定转入IL-8(1-77)、IL-8(5-77)、IL-8(9-77)3种亚型,应用MTT法、流式细胞仪、Transwell小室法等方法比较IL-8的3种亚型对卵巢癌SKOV3细胞株的增殖、生长、迁移和侵袭能力的影响,为临床诊断和治疗提供理论和实验依据。
1 材料和方法
1.1 材料
卵巢癌SKOV3细胞购于中国科学院上海生命科学研究院生物化学与细胞生物学研究所,由本实验室保存。IL-8(1-77)-pwpi-SKOV3细胞、IL-8(5-77)-pwpi-SKOV3细胞、IL-8(9-77)-pwpi-SKOV3细胞和pwpi-SKOV3细胞为本实验室前期分别转染并过表达IL-8(1-77)、IL-8(5-77)、IL-8(9-77)和pwpi的SKOV3细胞。RPMI-1640培养基和胎牛血清、胰蛋白酶、二甲基亚砜(DMSO)、四甲基偶氮唑盐(MTT)、Matrigel胶购于北京大学生物中心,Tanswell小室购于美国Corning Costar公司。
1.2 方法
1.2.1 实验分组
每次实验分为实验组即IL-8(1-77)-pwpi-SKOV3细胞、IL-8(5-77)-pwpi-SKOV3细胞和IL-8(9-77)-pwpi-SKOV3,同时设SKOV3细胞和pwpi-SKOV3细胞为对照组,共5组细胞,每组平行设3组重复实验结果。
1.2.2 细胞生长曲线测定
采用MTT法,将5组细胞接种于48孔板中,每种细胞设21孔,24 h后每组细胞每天任意挑选3个孔加入MTT 20 μL温育4 h,弃上清液加入DMSO 150 μL,吹打混匀使甲臜充分溶解,将所有溶液移至另一96孔板;酶标仪比色(波长492 nm),连测7d吸光度值(A492),并绘制生长曲线。
1.2.3 细胞生长周期测定
采用流式细胞仪法测定细胞周期:培养好的细胞经胰酶消化,PBS洗涤细胞2次后加入2 mL预冷的70%乙醇,4 ℃固定过夜。次日将细胞取出再次用PBS洗涤2次,留取500 μL,细胞数约5×105,加Triton-X-100 10 μL,RNase 1 μL,混匀约30 min后加PI(浓度为50 μg/ mL)5 μL,避光染色30 min后300目筛网过滤后放入流式细胞仪检测。
1.2.4 细胞克隆率测定
采用集落形成实验,将5组细胞按照每孔100、200、400个细胞的密度接种于24孔板(每种密度做3个复孔),7d后姬姆萨染色照相,计数各组细胞的集落数,比较各组细胞的克隆率。
1.2.5 细胞体外迁移能力测定
采用Transwell小室法,具体操作参照Transwell说明书进行;20~20 h后用MTT法分别检测上、下室细胞的A值,计算迁移率:A迁移细胞=A下表面细胞/A上表面细胞。
1.2.6 细胞体外侵袭能力测定
采用Transwell-Matrigel胶法,Transwell小室上室先铺胶,加入Matrigel胶50 μL (1.25 mg/mL),然后参照Transwell说明书进行,培养20~24 h后用MTT法分别检测上、下室细胞的A值,计算侵袭率:A侵袭细胞=A下表面细胞/
1.3 统计学处理
数据使用SPSS 13.0统计学软件处理,细胞的生长曲线采用重复测量的方差分析,细胞的生长周期、集落形成实验、迁移及侵袭实验均采用方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 细胞生长曲线
pwpi-SKOV3与SKOV3细胞相比,生长计数均值差异无统计学意义(P=0.762),而IL-8(1-77)-pwpi-SKOV3和IL-8(5-77)-pwpi-SKOV3细胞生长速度明显快于SKOV3细胞,生长计数均值差异有统计学意义(P=0.000),表明IL-8(1-77)和IL-8(5-77)的过表达对SKOV3细胞的生长具有促进作用。而IL-8(9-77)-pwpi-SKOV3细胞生长速度明显慢于SKOV3细胞,生长计数均值差异有统计学意义(P=0.001,图1)。
2.2 细胞生长周期
流式细胞仪检测结果显示,IL-8(1-77)-pwpi-SKOV3和IL-8(5-77)-pwpi-SKOV3在G2期的比率明显高于SKOV3,差异有统计学意义(P=0.017和0.020);其他细胞生长周期差异均无统计学意义(P>0.05;表1,图2)。
2.3 细胞集落形成实验
细胞集落形成实验结果显示,IL-8(1-77)-pwpi-SKOV3和IL-8(5-77)-pwpi-SKOV3细胞克隆率明显高于SKOV3,差异有统计学意义(P=0.000和0.001),IL-8(9-77)-pwpi-SKOV3细胞克隆率明显低于SKOV3(P=0.013,表2,图3)。
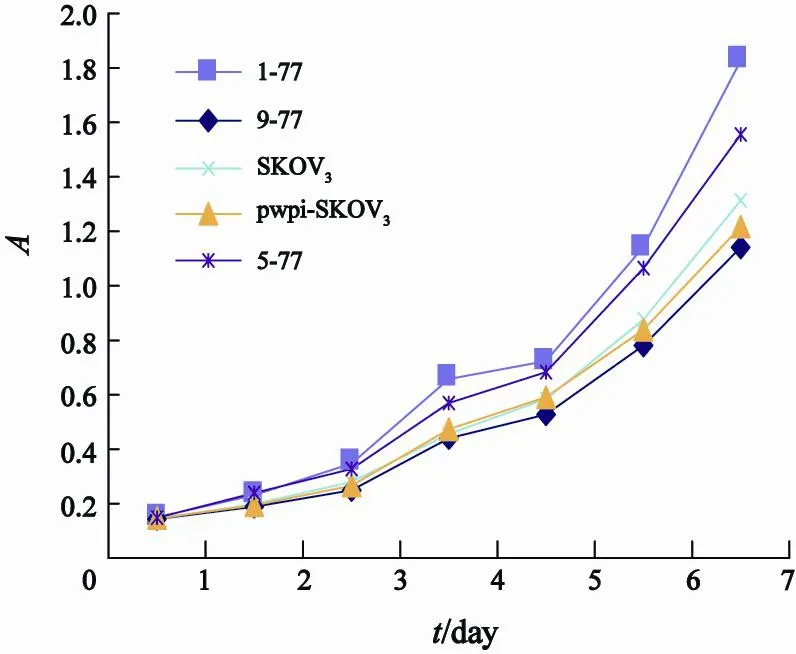
图 1 5组细胞的生长曲线图Fig. 1 The growth curves of the 5 groups of cells
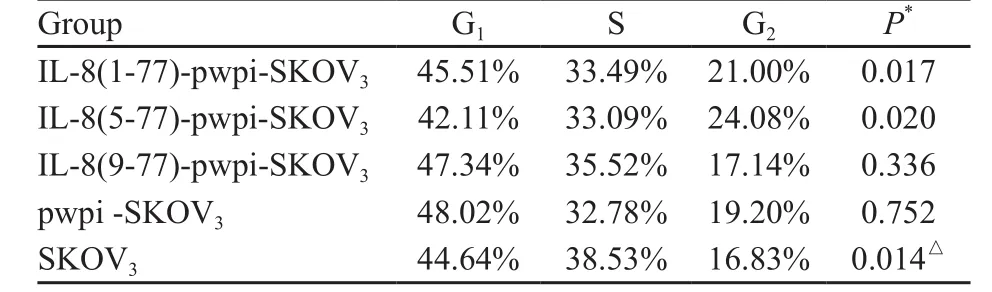
表 1 5组细胞的细胞生长周期Tab. 1 The cell cycle of the 5 groups of cells
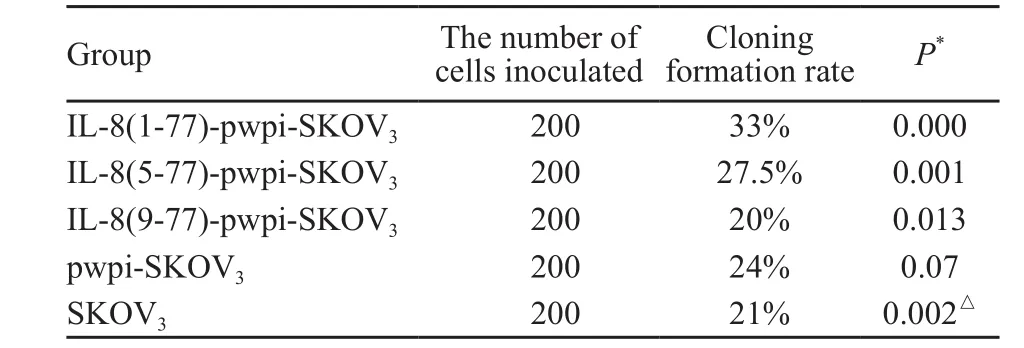
表 2 5组细胞的克隆形成率Tab. 2 The cells cloning formation rate of the 5 groups
2.4 细胞体外迁移能力
IL-8(1-77)-pwpi-SKOV3、IL-8(5-77)-pwpi-SKOV3、IL-8(9-77)-pwpi-SKOV3、pwpi-SKOV3和SKOV3之间Transwell小室上、下表面细胞的A值差异无统计学意义(P>0.05,表3)。
表 3 5组细胞的体外迁移能力Tab. 3 Migration capability of the 5 groups of cells in vitro ()
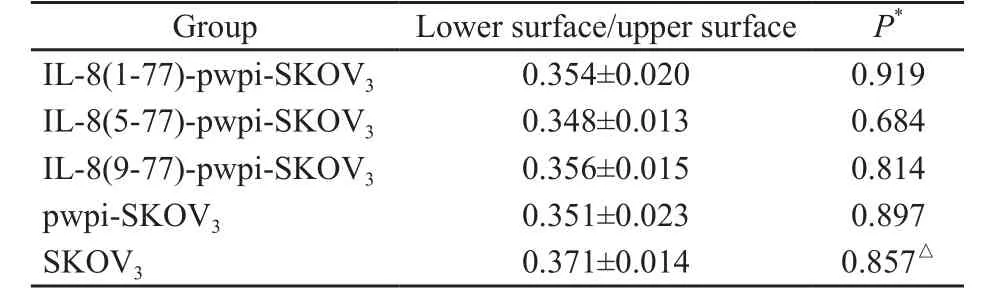
表 3 5组细胞的体外迁移能力Tab. 3 Migration capability of the 5 groups of cells in vitro ()
*: Comparison of each group with SKOV3group;△: Compared with each group..
GroupLower surface/upper surfaceP*IL-8(1-77)-pwpi-SKOV30.354±0.0200.919 IL-8(5-77)-pwpi-SKOV30.348±0.0130.684 IL-8(9-77)-pwpi-SKOV30.356±0.015 0.814 pwpi-SKOV30.351±0.0230.897 SKOV30.371±0.0140.857△
2.5 细胞体外侵袭能力
IL-8(1-77)-pwpi-SKOV3和IL-8(5-77)-pwpi-SKOV3细胞侵袭能力明显强于SKOV3,差异有统计学意义(P=0.000和0.002),IL-8(9-77)-pwpi-SKOV3明显弱于SKOV3(P=0.067,表4,图4)。
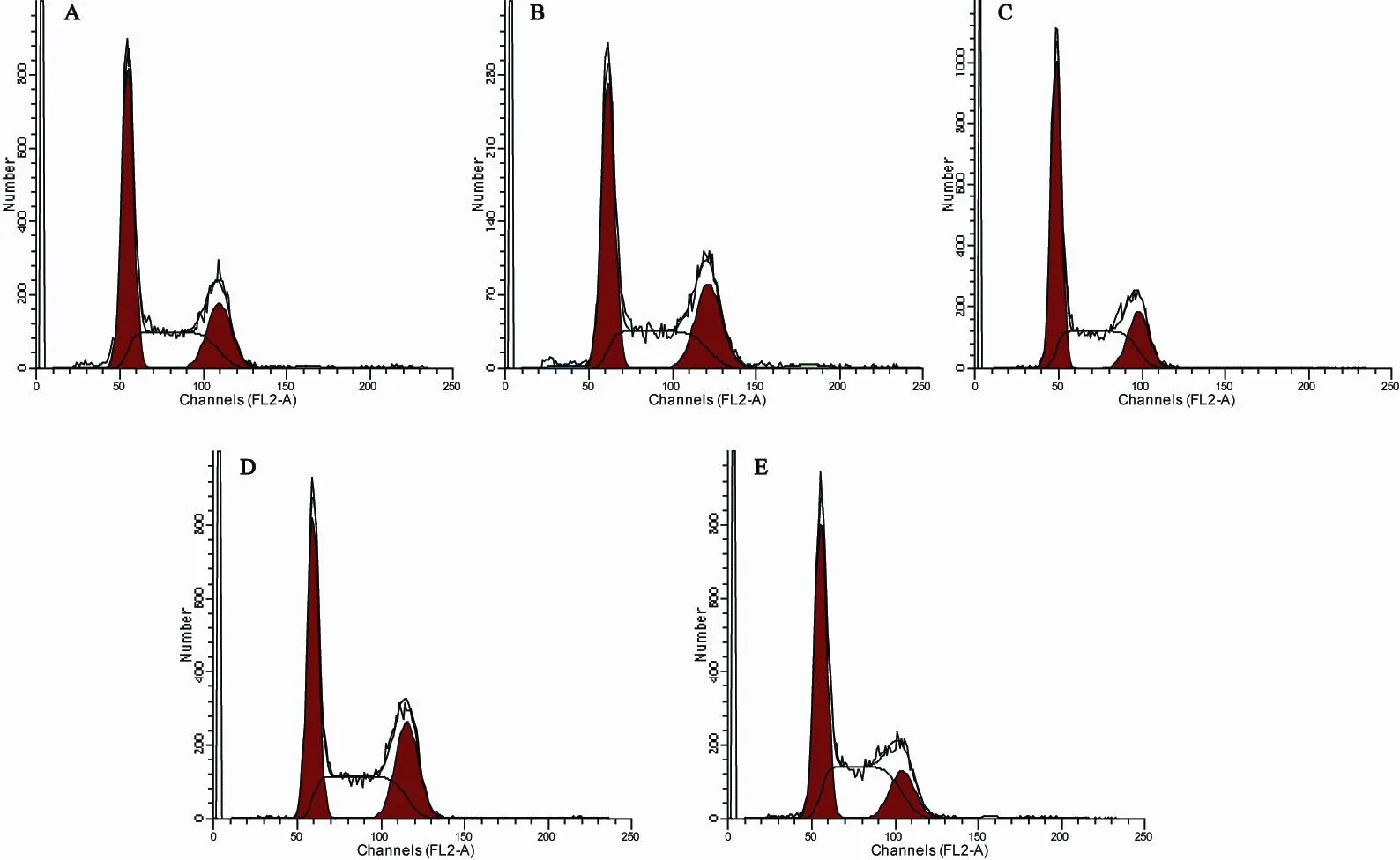
图 2 5 组细胞的细胞生长周期图Fig. 2 The cell growth cycle diagram of the 5 groups of cells
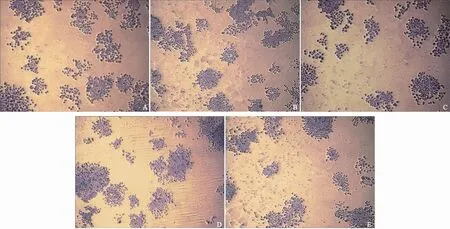
图 3 接种细胞为200个时的细胞集落形成图Fig. 3 The cell colony formation diagram were when inoculated cell number to be 200
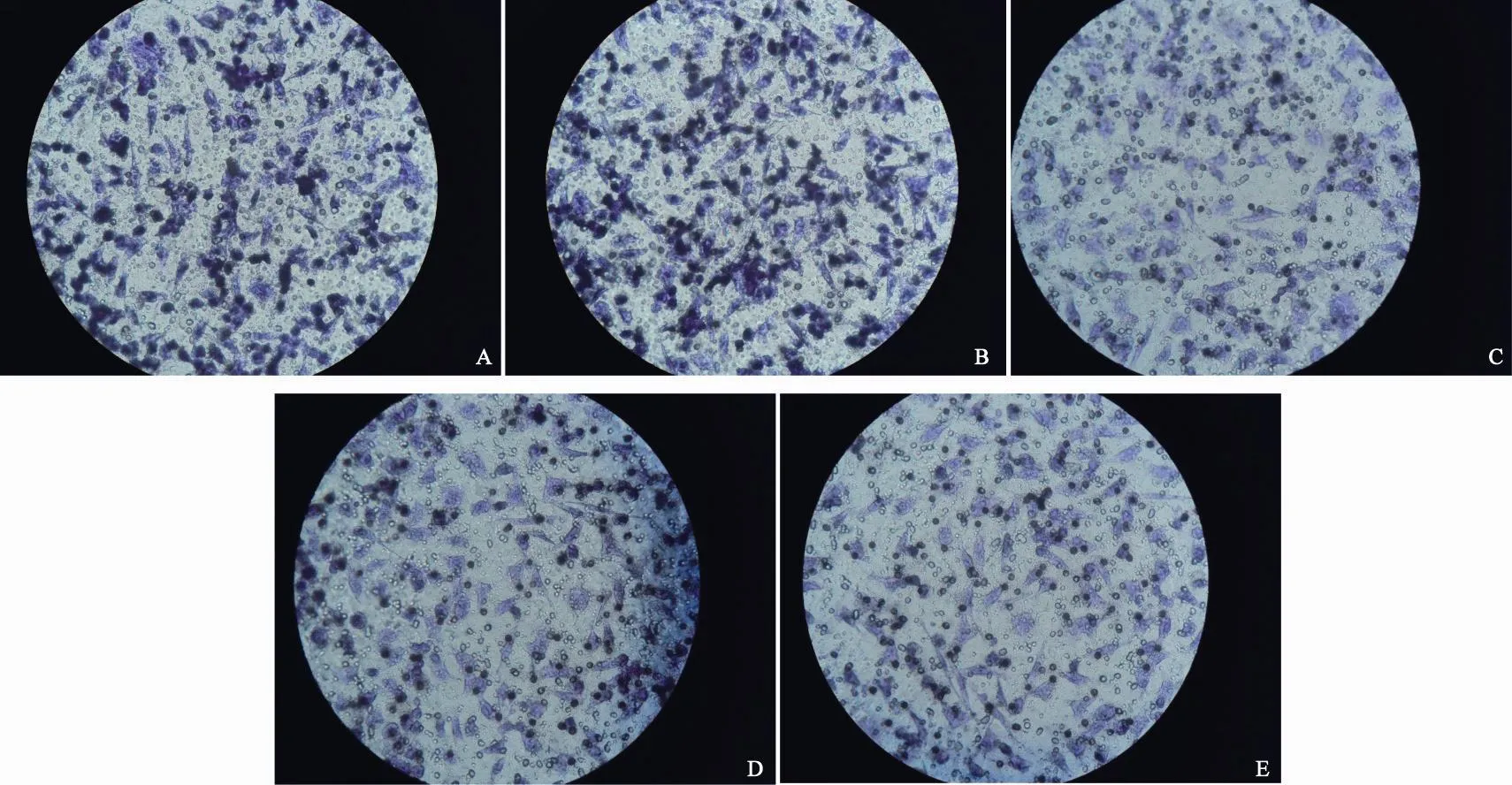
图 4 5 组细胞体外侵袭图Fig. 4 Invading capability of the 5 groups of cells in vitro
表 4 5组细胞的体外侵袭能力Tab. 4 Invading capability of the 5 groups of cells in vitro ()
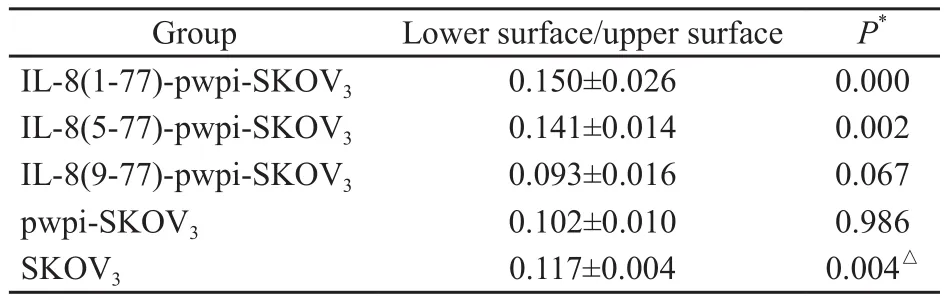
表 4 5组细胞的体外侵袭能力Tab. 4 Invading capability of the 5 groups of cells in vitro ()
*: Comparison of each group with SKOV3group;△: Compared with each group.
GroupLower surface/upper surfaceP*IL-8(1-77)-pwpi-SKOV30.150±0.0260.000 IL-8(5-77)-pwpi-SKOV30.141±0.0140.002 IL-8(9-77)-pwpi-SKOV30.093±0.016 0.067 pwpi-SKOV30.102±0.0100.986 SKOV30.117±0.0040.004△
3 讨 论
卵巢癌是女性常见的恶性肿瘤之一,由于卵巢位于盆腔深部,早期病变不易发现,一旦出现症状多属晚期。近年来,理想的肿瘤细胞减灭术和铂类为主的化疗方案的应用,使卵巢癌的治疗效果有了明显提高,但5年生存率仅为30%~40%[7],病死率居妇科恶性肿瘤首位,主要原因与70%的患者在就诊时已属晚期,治疗后70%的患者将会复发有关。因此,寻找诊断和治疗手段是目前卵巢癌研究的重点。
本课题组在前期利用蛋白组学技术筛选鉴定和验证新的潜在的卵巢上皮癌血清标志物时,发现血清IL-8可以作为卵巢上皮癌的标志物,但不同亚型的IL-8卵巢上皮癌血清中的含量并不一致[4]。IL-8属于趋化因子,成熟的IL-8分子由蛋白酶水解的不同可裂解成以下7链:MDNCF-a 、IL-8(1-77)、IL-8(5-77)、IL-8(6-77)、IL-8(7-77)、IL-8(8-77)、IL-8(9-77)。这些亚型都具有生物学活性,但不同亚型的IL-8在诱导中性粒细胞的趋化和脱颗粒的能力不同[8]。IL-8各亚型在人类卵巢肿瘤生长的作用以前研究得很少。为了更好地了解IL-8各亚型在卵巢肿瘤中的作用,本课题组先期已成功构建小分子蛋白慢病毒表达系统,并将IL-8的3种亚型IL-8(1-77)、IL-8(5-77)、IL-8(9-77)转染至无IL-8蛋白表达的卵巢癌SKOV3细胞株中,研究其对卵巢癌细胞功能的影响。我们的数据表明,IL-8亚型IL-8(1-77)和IL-8(5-77)能促进卵巢癌细胞SKOV3的生长和增殖,并增强其侵袭能力,而IL-8(9-77)对SKOV3细胞增殖有抑制作用。虽然对于IL-8(5-77)报道较少,但在IL-8亚型中,IL-8(5-77)与IL-8(6-77)的功能相似,两者同属于中性粒细胞激化因子1III型。本课题组前期研究表明[9],IL-8(1-77)在恶性和良性卵巢肿瘤细胞中表达,但在正常卵巢细胞中不表达;L-8(6-77)在恶性卵巢肿瘤细胞中表达,在良性肿瘤和健康人群样本中不表达;IL-8(9-77)在卵巢恶性肿瘤细胞及良性肿瘤或正常卵巢细胞中均不表达。这些研究结果显示,在不同的环境、诱导剂作用下,IL-8各亚型对卵巢恶性肿瘤细胞发挥不同的调节功能。
Mortier等[10]的研究结果显示,IL-8多种亚型在诱导中性粒细胞外渗方面的作用可分为3类:第1类IL-8通过氨肽酶裂解而成,包含75至79个氨基酸形式,具有中度诱导中性粒细胞外渗能力;第2类通过蛋白水解生成(如丝氨酸蛋白酶),包含69至72个氨基酸的形式,能够非常有力地诱导中性粒细胞外渗;第3类是通过肽酰基精氨酸脱亚氨酶把精氨酸氨基末端修改成瓜氨酸,有微弱诱导中性粒细胞外渗能力。而Clark-Lewis等[11]的研究显示,IL-8的亚型对中性粒细胞的趋化活性较短的形式比全长的形式活跃。结合此结果,我们可以推断IL-8(1-77)、IL-8(5-77)、IL-8(9-77)对于肿瘤细胞的增长活性呈逐步下降的趋势,甚至IL-8(9-77)对肿瘤的生长有抑制作用。这和本研究结果相一致。
Galligan等[12]研究表明,IL-8能够促进碱性磷酸酶、过氧化物酶、超氧阴离子自由基的释放,而在牛的炎性反应过程中发挥中性粒细胞聚集和活化,剂量低时无明显的增强牛细胞迁移能力,而两亚型剂量越高,其对牛细胞迁移能力越强,IL-8(6-77)与IL-8(1-77)两种亚型之间的迁移能力无差别。Lee等[6]应用IL-8转染的卵巢细胞株进行体外侵袭和迁移实验,探讨IL-8是否能促进卵巢癌细胞株的侵袭和迁移,结果均为阴性。结合他们的研究结果,我们可以确定的是,IL-8及其亚型并不促进卵巢肿瘤细胞的迁移,但各亚型对侵袭能力的影响有所不同,原因可能与IL-8能够诱导新生血管生成有关[13-14]。
[1] WATANABE H, IWASE M, OHASHI M, et al. Role of interleukin-8 secreted from human oral squamous cell carcinoma cell lines [J]. Oral Oncol, 2002, 38(7): 670-679.
[2] INOUE K, SLATON J W, KIM S J , et al. Interleukin 8 expression regulates tumorigenicity and metastasis in human bladder cancer [J]. Cancer Res, 2000, 60(8): 2290-2299.
[3] BARSHISHAT M, ARIEL A, CAHALON L, et al. TNF- alpha and IL-8 regulate the expression and function of CD44 varian proteins in human colon carcinoma cells [J]. Clin Exp Metastasis, 2002, 19(4): 327-337.
[4] 王琪, 李力, 黎丹戎, 等. 应用蛋白质芯片飞行质谱技术筛选卵巢癌血清标志物 [J]. 中华妇产科杂志, 2006, 41(8): 544.
[5] 尹巧云, 李力, 于红静,等. 小分子蛋白慢病毒表达系统的构建 [J]. 中国癌症防治杂志, 2011, 3(4) : 271-276.
[6] LEE L F, HELLENDALL R P, WANG Y, et al. IL-8 reduced tumorigenicity of human ovarian cancer in vivo due to neutrophil infiltration [J]. J Immunol, 2000, 164(5): 2769-2775.
[7] JEMAL A, SIEGEL R, WARD E, et a1. Cancer statistics[J]. CA Cancer J Clin, 2007, 57(1): 43-66.
[8] HOMES W E, LEE J, KUANG W J, et al. Structure and functional expression of a human interleukin-8 receptor [J]. Science, 1991, 253(5025): 1278-1280.
[9] 周怡, 王琪, 张玮, 等. LCM、IMB联合MALDI-TOF-MS技术在恶性卵巢上皮瘤相关标志物分离检测中的应用[J]. 山东医药, 2011, 51(18): 467-473.
[10] MORTIER A, BERGHMANS N, RONSSE I, et al. Biological activity of CXCL8 forms generated by alternative cleavage of the signal peptide or by aminopeptidase-mediated truncation[J]. PLoS One, 2011, 6(8): 23913.
[11] CLARK-LEWIS I, SCHUMACHER C, BAGGIOLINI M, et al. Structure-activity relationships of interleukin-8 determined using chemically synthesized analogs. Critical role of NH2-terminal residues and evidence for uncoupling of neutrophil chemotaxis,exocytosis,and receptor binding activities [J]. J Biol Chem, 1991, 266(34): 23128-23134.
[12] GALLIGAN C L, COOMBER B L. Effects of human IL-8 isoforms on bovine neutrophil function in vitro [J]. Vet Immunol Immunopathol, 2000, 74(1-2): 71-85.
[13] KOCH A E, POLVERINI P J, KUNKEL S L, et al. Interleukin-8 as a macrophage-derived mediator of angiogenesis [J]. Science, 1992, 258(5089): 1798-1801.
[14] STRIETER R M, KUNKEL S L, ELNER V M, et al. Interleukin-8. A corneal factor that induces neovascularization[J]. Am J Pathol, 1992, 141(6): 1279-1284.
The impact of three subtypes of IL-8 on biological functions of ovarian cancer SKOV3cells
WANG Ai-ping, WANG Qi, ZHANG Wei, YIN Qiao-yun, LI Li (Department of Gynecology Oncology, Affiliated Tumor Hospital of Guangxi Medical University and the Emphasis Lab of High Incidence Cancer in Guangxi Region, Nanning Guangxi 530021, China)
LI Li E-mail: lili@gxmu.edu.cn
Background and purpose: Ovarian cancer progression is a multistep process. Recent research shows that IL-8 level of ovarian cancer patients is significantly higher than that of patients with benign tumors and normal people, the growth and metastasis of ovarian cancer may be associated with over-expression of IL-8, but there is no report about the function of the main subtypes of IL-8 in ovarian cancer. The study was to investigate the influence of IL-8 three subtypes on ovarian cancer SKOV3cell proliferation, growth, migrating and invasive capability, and the underlying mechanism. Methods: After confirming obtaining SKOV3cell with three hypotypes IL-8(1-77), IL-8(5-77), IL-8(9-77) over-expression respectively, MTT colorimetric method was used to detect the growth cure of different cells; The flow cytometry was used to compare the cell cycle of different cells; The cell proliferation capability of different cells was tested by the cell body colony formation; Transwell closet was used to compare different cell body’s external migration and invasive capability. Results: IL-8(1-77)-pwpi-SKOV3and IL-8(5-77)-pwpi-SKOV3cells in the ratio of G2phase were significantly higher than that of SKOV3cells (P=0.017 and 0.020). The cloning formation rate of IL-8(1-77)-pwpi-SKOV3and IL-8 (5-77) -pwpi-SKOV3cells were significantly higher than that of SKOV3cells (P=0.000 and 0.001), IL-8 (9-77)-pwpi-SKOV3cells was significantly lower than SKOV3cells (P=0.013); the migration ability in vitro of different groups of cells had no statistically significant differences (P>0.05), but the invasion ability invitro of IL-8( 1-77 )-pwpi-SKOV3and IL-8 (5-77) -pwpi-SKOV3cells were significantly stronger than that of SKOV3cells(P=0.000 and 0.002), IL-8 (9-77) -pwpi-SKOV3cells was significantly weaker than that of SKOV3cells(P=0.067).. Conclusion: The subtypes of IL-8 (1-77) and IL-8 (5-77) can promote ovarian cancer SKOV3cell growth and proliferation, and enhance their invasive ability, while IL-8(9-77) inhibits proliferation of ovarian cancer SKOV3cells.
Ovarian cancer; IL-8 subtype; Biological functions
10.3969/j.issn.1007-3969.2013.04.002
R737.31
:A
:1007-3639(2013)04-0248-06
2012-12-03
2013-02-01)
国家自然科学基金(No:30760266)。
李力 E-mail:lili@gxmu.edu.cn

