糖尿病性脑血管病情绪障碍的危险因素的临床对照研究
杨诚 刘陈先 黄海波
糖尿病性脑血管病是指由糖尿病诱发的脑血管病,在糖、脂肪和蛋白质等一系列营养物质代谢紊乱的基础上,所产生的颅内大血管和微血管病变。糖尿病,尤其是2 型糖尿病患者,20%~40%会发生脑血管病,并成为糖尿病患者的主要死亡原因之一。临床上主要表现为脑动脉粥样硬化、无症状性卒中和急性脑血管病等。其发病机制、临床特点、治疗和预后均有别于非糖尿病性脑血管病[1-2]。因糖尿病与脑血管病病程长,对患者生活质量负面影响大,患者长期处于应激状态,导致患者易伴发焦虑、抑郁等情绪障碍,并影响糖尿病与脑血管疾病的发生、病情发展与转归[3]。糖尿病性脑血管病的情绪障碍的治疗有重要作用,近年来引起广泛关注与重视。本研究拟观察糖尿病性脑血病患者伴发焦虑、抑郁等情绪障碍的危险因素,以探讨对糖尿病性脑血管病伴发抑郁障碍的有效的预防和临床治疗方法。
1 资料与方法
1.1 一般资料 选择2008年5月-2013年5月就诊于本院的糖尿病脑性脑血管伴发焦虑抑郁障碍的患者84 例,为观察组;选择同期就诊的无焦虑抑郁障碍的糖尿病脑血管病患者95例,为对照组。观察组中男45 例,女39 例,平均年龄为(50±10)岁;对照组中男50 例,女45 例,平均年龄为(48±9)岁。两组在性别、年龄、文化程度、病程等差异无统计学意义。
纳入标准:(1)符合1999年WHO推荐的糖尿病诊断标准;(2)符合1996年第四届脑血管病学术会议修订的《各类脑血管病诊断要点》标准,并经CT或MRI证实;(3)伴发焦虑抑郁障碍者符合CCMD-3 中关于焦虑和/或抑郁障碍诊断标准;(4)年龄18~65岁;(5)受教育水平在小学及小学以上。
排除标准:(1)有精神疾病史与有意识障碍者;(2)有严重心肝肾疾病者。
1.2 方法 对两组患者进行糖尿病性脑血管疾病的常规治疗,同时治疗组的患者接受抗焦虑抑郁的药物治疗,要求患者依从性好,在研究过程中按时服药。两组均于治疗前、治疗后4 周、治疗后6 个月后进行空腹血糖、餐后2 h血糖、糖化血红蛋白、神经功能缺损程度和生活质量等项目检测。
1.3 观察指标
1.3.1 一般资料统计 研究组编制的一般资料调查表包括:姓名、性别、年龄、文化程度、体重、病程等。危险因素观察指标调查表包括:3 次测量的体重指数、血压、空腹血糖、餐后2 h血糖、糖化血红蛋白、血胰岛素、血C肽、血脂、胰岛素抵抗指数、24 h微量蛋白排泄率、纤维蛋白原、颈总动脉狭窄程度、头颅CT等。
1.3.2 神经功能缺损程度评分标准 1995年,我国第四次脑血管病学术会议通过了脑卒中患者临床神经功能缺损评分标准,是由斯堪的纳维亚卒中量表(SSS)修订而来。其目的是对脑卒中后患者所存留的或新出现的神经功能缺损进行识别和评定,并进行疗效考评。具有较好的信度、效度和敏感度。最高分45 分,最低分0 分,轻型0~15 分,中型16~30 分,重型31~45 分[4]。
1.3.3 糖尿病生活质量调查表(DQOL) 为单项选择题,分4 个部分(满意度,影响程度,对社会或职业的烦恼,与糖尿病相关的烦恼),46 道题,每题有5 个选项。满意度模块计算得分从6 分(非常满意)到1 分(非常不满意),影响程度模块和两个烦恼模块得分从1 分(无)到6 分(一直是),累计总分越低,反映糖尿病生活质量满意率越低。
1.3.4 抑郁自评量表(SDS) 由Zung于1965年编制而成,含有20 个项目,每个条目为 1~4 的4 级评分。各条目得分相加得总粗分,将总粗分乘以1.25 以后取整数部分即得标准分。按照中国常模结果标准分总分<52 为无抑郁,53~62 为轻微至轻度抑郁,63~72 为中度抑郁,≥73 为重度抑郁。
1.3.5 焦虑自评量表(SAS) 由Zung于1971年编制而成,含有20 个项目,每个条目为1~4 的4 级评分。各条目得分相加得总粗分,将总粗分乘以1.25 以后取整数部分即得标准分,按照中国常模结果,SAS标准分的分界值为50 分,其中50~59 分为轻度焦虑,60~69 分为中度焦虑,70 分以上为重度焦虑。
1.4 统计学方法 应用SPSS 19.0 进行数据分析。计量资料均以均数±标准差(±s)表示,对两组患者的一般资料进行t检验;以3 次检测的检测指标为因变量,检测时间为组内变量,分组为组间变量进行重复测量方差分析[5-9]。所有的统计分析方法均采用双侧检验,P<0.05 为差异有统计学意义。
2 结果
2.1 SAS、SDS评分比较 观察组84 例患者的SAS、SDS 3 次测量值如表1所示,重复方差分析结果显示,SAS评分时间主效应显著(F=118.02,P<0.01);SDS评分时间主效应显著(F=149.97,P<0.01);SAS和SDS评分随治疗的进行逐渐降低。
表1 观察组SAS和SDS评分统计(±s)

表1 观察组SAS和SDS评分统计(±s)
项目 治疗前 治疗后4 周 治疗后6 个月 SDS 62±8 55±6 48±10 SAS 53±9 47±7 42±8
2.2 两组患者空腹血糖、餐后2 h血糖、糖化血红蛋白、神经缺损程度和生活质量比较 两组患者空腹血糖、餐后2 h血糖、糖化血红蛋白、神经缺损程度和生活质量的3 次测量值见表2。
表2 两组患者空腹血糖、餐后2 h血糖、糖化血红蛋白、神经缺损程度和生活质量测量值(±s)

表2 两组患者空腹血糖、餐后2 h血糖、糖化血红蛋白、神经缺损程度和生活质量测量值(±s)
组别 空腹血糖 餐后2 h血糖 糖化血红蛋白 神经缺损程度 生活质量观察组治疗前 9.13±3.57 14.81±4.64 6.83±1.75 25.05±4.88 62.49±7.83治疗后4 周 7.62±1.82 12.13±1.98 5.89±1.20 20.40±4.81 73.15±6.14治疗后6 个月 6.95±1.69 10.60±1.01 5.15±1.12 16.47±2.78 82.49±5.34对照组治疗前 9.54±3.83 14.05±5.15 6.83±1.80 12.02±2.62 83.66±3.32治疗后4 周 8.41±2.83 12.29±3.35 6.33±1.64 11.91±1.57 84.16±2.67治疗后6 个月 7.58±1.93 10.92±2.36 5.91±1.42 11.52±1.34 86.91±2.51
2.2.1 空腹血糖 重复方差分析显示,时间主效应显著,空腹血糖在3 个时间点的检测值有明显差异,组间主效应及其与检测时间的交互作用不显著(表3)。图1显示,两组患者的空腹血糖随治疗进行明显下降,治疗前两组间差异无统计学意义(F=0.56,P>0.05),治疗后4 周、6 个月,观察组的空腹血糖值明显低于对照组(F=4.78,P<0.05;F=5.31,P>0.05)。
2.2.2 餐后2 h血糖 重复方差分析显示,时间主效应显著,餐后2 h血糖在3 个时间点的检测值有明显差异,组间主效应及其与检测时间的交互作用不显著(表4)。图2显示,两组患者的空腹血糖随治疗进行明显下降,观察组下降幅度更大一些。

图1 不同检测时间空腹血糖变化趋势

图2 不同检测时间餐后2 h血糖变化趋势

表3 空腹血糖重复方差分析

表4 餐后2 h血糖重复方差分析
2.2.3 糖化血红蛋白 重复方差分析显示,时间主效应显著,糖化血红蛋白在三个时间点的检测值有明显差异;组间及其与检测时间的交互作用显著(表5)。图3直观反映,观察组在4 周、6 个月后明显低于对照组(F=4.241,P<0.05;F=15.333,P<0.01),治疗组的糖化血红蛋白值随治疗的进行下降幅度更大。

表5 糖化血红蛋白重复方差分析
2.2.4 神经缺损程度 重复方差分析显示,时间、分组主效应显著,两者的交互作用显著(表6)。随着治疗的进行,观察组的神经缺损程度明显改善(图4)。
2.2.5 生活质量 重复方差分析显示,时间、分组主效应显著,两者的交互作用显著(表7)。随着治疗的进行,观察组的生活质量明显改善(图5)。

图3 不同检测时间糖化血红蛋白变化趋势
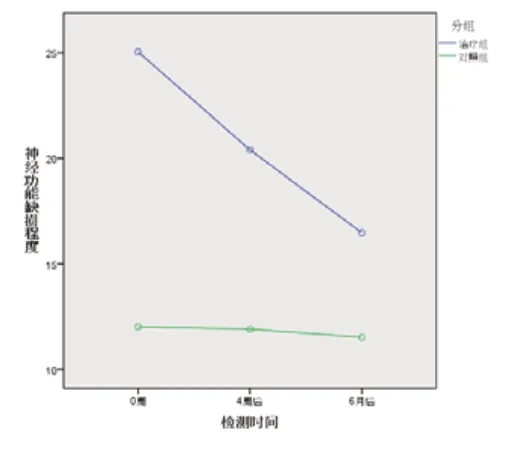
图4 不同检测时间神经缺损程度变化趋势

表6 神经缺损程度重复方差分析

表7 生活质量重复方差分析

图5 不同检测时间生活质量变化趋势
3 讨论
本研究结果表明,抗焦虑抑郁药物明显改善观察组患者的焦虑抑郁情绪,并且在半年后的随访调查中仍保持相对稳定的情绪;其空腹血糖、糖化血红蛋白、神经缺损程度和生活质量,与对照组相比有更大改善。
糖尿病是一种多种病因所致的心身疾病,其发生、发展与转归不仅与生物因素有关,也受到社会心理因素的影响。世界卫生组织已把糖尿病归为与生活方式有关的非传染性慢性疾病,并强调心理应激在其发生中的重要作用[10]。糖尿病目前还不可以根治,许多患者不能正确面对,从而导致心理心理问题,多项研究表明其中最常见的是焦虑、抑郁等情绪障碍[11-12]。这些情绪障碍反过来又会影响糖尿病病情,使其加重,形成恶性循环。因此,临床医生近年来也开始关注对糖尿病患者的情绪障碍的诊断与治疗[13]。本研究发现抗焦虑抑郁药物很好改善了患者的情绪障碍,这与以往的研究结果一致[14]。本研究进一步发现,患者的焦虑抑郁情绪的改善有利于血糖水平的控制。付明媚等[15]对近年来有关心理干预与糖尿病患者焦虑抑郁症状的25 篇文献的Meta分析表明,心理干预可有效地改善糖尿病患者的抑郁和焦虑症状,并可较好地控制血糖水平,显著降低空腹血糖、餐后2 h血糖及糖化血红蛋白水平。这都说明情绪障碍的改善有利于糖尿病患者病情的控制。这可能是与情绪与神经内分泌的相互影响有关[16-18],王晓敏等[19]研究发现糖尿病伴抑郁大鼠HPA轴活动亢进,血浆CRH、ACTH、CorT水平显著增高,而NE和5-HT水平下降;其中。CorT是机体拮抗胰岛素的重要激素之一,CorT水平增高会加重胰岛素抵抗;NE和5-HT水平下降,导致机体神经内分泌系统紊乱,促进机体内的糖皮质等升糖激素进一步升高,拮抗胰岛素作用增强,导致血糖水平持续升高。但也有研究发现,应用米氮平治疗糖尿病患者的抑郁情绪会伴随空腹血糖升高[20]。本研究结果与此不一致,可能是由于不同抗焦虑抑郁药物的药理作用不同,进而与患者的糖代谢及降糖药物产生不同作用,导致血糖升高或降低,提示我们在临床中需继续观察与研究,以期选择合适的药物。
无论是1 型或2 型糖尿病,都是动脉硬化和脑血管病的重要独立危险因素之一,可使脑卒中发生率增加1.5~6 倍。糖尿病性脑血管病包括颅内大血管病变和微血管病变[1]。多资料显示糖尿病性脑血管病是在遗传的基础上,高血糖、多元醇代谢异常、蛋白质非酶糖化、血脂异常、血液流变学异常、血小板功能异常等相关因素所致[21-25]。焦虑、抑郁情绪是脑血管病的常见并发症,文献报道,抑郁的发病率为25%~79%,焦虑的发病率为62%~79%[26]。脑卒中后抑郁患者情绪低落,对治疗没有信心,依从性差,对神经功能康复和生活质量都有影响。文献报道神经功能缺损的严重程度与卒中后抑郁有关,重度抑郁可延迟神经功能的恢复[27]。本研究结果显示,糖尿病性脑血管病患者情绪障碍的改善可促进其神经功能的康复,也有助于提高患者生活质量。以往多项研究显示脑卒中后抑郁的改善对神经功能的康复和生活质量有积极意义[28-30]。
糖尿病性脑血管病伴发情绪障碍可能有两种途径,一是患者对躯体疾病的心理应激反应;二是躯体疾病的某种生物学因素影响情绪。两种疾病的同时发生和相互影响,对医生提出更高要求。需要医生有生物医学模式转变为社会-心理-生物医学模式,在治疗躯体疾病的同时关注患者的情绪等心理精神因素,及时发现、诊断、治疗心理精神疾病。
[1]周厚广,董强,胡仁明.糖尿病性脑血管病的研究进展[J].中国脑血管病杂志,2009,6(1):49-53.
[2]杨玺.糖尿病性脑血管病的临床诊断与治疗[J].中国社区医师,中国社区医师(医学专业),2012,14(3):7,379.
[3]周承姝.糖尿病性脑血管病204 例临床分析[J].现在中西医结合杂志,2009,18(10):1120-1121.
[4]陶子荣.我国脑卒中患者临床神经功能缺损评分标准信度、效度及敏感度的评价[J].第二军医大学学报,2009,30(3):283-285.
[5]董英,赵耐青.重复测量资料方差分析中主效应意义的探讨[J].复旦学报(医学版),2005,32(6):682-686.
[6]邱宏,金如锋.用SPSS 11.0 实现对重复测量资料的方差分析[J].数理医药学杂志,2006,19(2):162-165.
[7]邱宏,金国琴.水迷宫重复测量数据的方差分析及其在SPSS中的实现[J].中西医结合学报,2007,5(1):101-105.
[8]王立芹,杨俊英.单因素重复测量设计的方差分析及SAS与SPSS的实现[J].华北煤炭医学院学报,2005,7(1):17-19.
[9]陈益伟,资晓宏.神经生长因子对糖尿病性脑血管疾病的治疗作用[J].中国医师杂志,2004,6(11):1573-1574.
[10]翁孝琴,陈佐明.2 型糖尿病患者抑郁焦虑的相关研究[J].现代预防医学,2012,39 (15):3894-3897.
[11]孙丽娟.2 型糖尿病患者的心理状况及个性特征分析[J].中国健康心理学杂志,2004,12(4):267.
[12]2 型糖尿病患者的焦虑抑郁情绪分析[J].复旦学报(医学版),2004,31(5):615.
[13]马建东,钱东丽.综合心理治疗对糖尿病情绪障碍的对照研究[J].中国民政医学杂志,1997,9(4):219-220.
[14]张桂平,龙金亮.西酞普兰联合护理干预治疗Ⅱ型糖尿病情绪障碍的研究[J].中国健康心理学杂志.2008,16(8):950-951.
[15]付明媚,董雅娟.心理干预对糖尿病患者焦虑抑郁症状及血糖控制影响的Meta分析[J].中国全科医学,2013,16(2 A):436-439.
[16]Pavlatou MG,Mastorakos G,Lekakis I,et al.Chronic administration of an angiotensin Ⅱ receptor antagonist resets the hypothalamic-pituitaryadrenal ( HPA ) axis and improves the affect of patientswith diabetes mellitus type 2:preliminary results[J].Stress,2008,11(1):62-72.
[17]Martin P,Cosgrove,Lincoln A,et al.Does depression increase the riskof developing type 2 diabetes[J].Occup Med,2008,58(1):7-14.
[18]Katon W,von Korff M,Ciechanowski P,et al.Behavioral and clinical factors associated with depression among individuals with diabetes[J].Diabetes Care,2004,27(4):914-920.
[19]王晓敏,谢斌,周志愉,等.2 型糖尿病肝郁大鼠糖代谢及 HPA 轴功能变化[J].山东医药,2011,51(4):42-43.
[20]魏宏强,李淑英,康瑞.米氮平对伴糖尿病的抑郁障碍患者空腹血糖的影响[J].中国新药与临床杂志,2011,30(9):663-666.
[21]韦丽忠.糖尿病性脑血管病发病机制研究的最新进展[J]医学理论与实践,2012,25(9):1040-1041.
[22]宋颖,李启富.糖尿病合并脑卒中的治疗进展[J].重庆医学,2009,38(18):2292-2294.
[23]付享征,金玲,沈洁.急性脑梗死与糖尿病临床关系[J].中国临床保健杂志,2005,8(4):359-360.
[24]朱凌云,孙侃,李晓军.糖尿病合并脑梗死的临床特点与机制研究进展[J].医学综述,2008,14(7):1075-1077.
[25]王艳巧,陈传杰,马均辉.糖尿病合并脑梗死危险因素分析[J].中国煤炭工业医学杂志,2009,12(5):742-743.
[26]杨青云,陈玉成.早期药物干预对脑卒中后抑郁焦虑症状改善及神经功能康复的临床疗效[J].中国现代医学杂志,2010,20(11):1742-1746.
[27]李广安,李金芳,程立新,等.脑卒中后抑郁早期综合干预的随访研究[J].中国心理卫生杂志,2004,18(1):15-17.
[28]包锡卿,王庚鑫,刘贤臣,等.脑卒中后抑郁患者的心理干预前瞻性对照研究[J].中国心理卫生杂志,2001,15(4):260-261.
[29]邹立.卒中后抑郁早期药物干预对神经功能康复影响的临床对照研究[J].实用医学杂志,2008,24(20):3508-3509.
[30]杨晓国,林一均,陈晓顶.氟西汀改善脑卒中后抑郁及神经功能缺损的临床研究[J].实用医学杂志,2009,25(7):1127-1128.

