毛细管电泳-质谱联用法测定葡萄酒中8种有机酸含量
李永库,刘衣南,吕琳琳,李晓静,王 芬
(1.沈阳农业大学理学院,辽宁 沈阳 110161;2.鞍山师范学院化学与生命科学学院,辽宁 鞍山 114005;3.中州大学实验中心,河南 郑州 450044)
有机酸是葡萄酒的主要成分之一,葡萄酒中的酸度主要由有机酸决定,有机酸的种类、浓度与葡萄酒的类型、品质有很大关系,它们影响着葡萄酒的口感、色泽及生物稳定性,因此,对葡萄酒中的有机酸进行检测十分重要。目前已有采用高效液相色 谱法[1-6]、离子 色谱法[7-9]、高 效 液相色谱-质谱 联 用 法[10]和 毛 细 管 电 泳 法[11-16]测定葡萄酒中多种有机酸含量的报道,但采用毛细管电泳-质谱联用法同时测定葡萄酒中草酸、富马酸、琥珀酸、柠檬酸、苹果酸、抗坏血酸、酒石酸和乳酸尚未见报道。
毛细管电泳(CE)仪具有分离选择性易调节、分离效率高、速度快、有机溶剂和样品消耗少、样品处理简便等优点,已成为一种复杂样品中痕量物质的分析方法。毛细管电泳与质谱联用(CE/MS)可以克服常用的毛细管电泳-紫外检测方法中灵敏度不高、定性能力差的不足,在一次分析中可同时得到组分迁移时间、分子质量和碎片特征信息,为复杂样品的定性、定量分析提供了一种强有力的手段[17]。但是,毛细管电泳常用的非挥发性表面活性剂和缓冲体系会降低大气压电喷雾电离源(ESI)的电喷雾效率和污染离子源[18-19],限制了 CE/MS的联用。而海美溴铵作为改性剂,能够与毛细管内壁形成比较牢固的吸附层,不易被缓冲液冲掉,从而大大减少了表面活性剂对样品电离的影响[20]。实验表明,海美溴铵-醋酸铵缓冲体系对有机酸在ESI电离源的电离强度没有明显的影响。本研究拟建立毛细管电泳-电喷雾质谱(CE-ESI-MS)测定葡萄酒中8种有机酸的方法,并应用于实际样品测定。
1 实验部分
1.1 仪器与试剂
Agilent HP3DCE毛细管电泳仪和1100 MSD TRAP SL 质谱仪:美国 Agilent公司产品,通过CE/MS喷雾组件连接;鞘流液:由Agilent1100等梯度泵和1∶100分流器提供;未涂层弹性石英毛细管(50μm×83cm):河北永年锐丰色谱器件厂产品;Orion868型pH/ISE测试仪:美国奥立龙公司产品;Sartorius 215S电子天平:德国赛多利斯公司产品;Waters Pro Plus超纯水仪:美国Waters公司产品。
甲醇、乙腈、异丙醇(色谱纯):美国Fisher公司产品;氨水、醋酸、醋酸铵(分析纯):上海试剂一厂产品;海美溴铵(分析纯):美国Sigma公司产品;草酸、富马酸、琥珀酸、柠檬酸、苹果酸、抗坏血酸、酒石酸、乳酸标准品:美国Sigma公司产品;实验用水均为超纯水。
1.2 标准溶液的配制
准确称取各1.0mg草酸、富马酸、琥珀酸、柠檬酸、苹果酸、抗坏血酸、酒石酸和乳酸,用水溶解并定容至1mL容量瓶,得到1g/L各酸的储备液。密封置于4℃下保存,实验时用缓冲溶液稀释至所需浓度。
1.3 样品的制备
吸取20.0mL混合均匀的葡萄酒样,以10 000r/min离心10min,除去不溶物,用缓冲溶液准确定容至20.0mL,经0.45μm微孔滤膜过滤后作为供试品溶液。
1.4 电泳分离条件
以40.0mmol/L醋酸铵(用1.0mol/L醋酸调至pH 4.5)为运行缓冲溶液,未涂层弹性石英毛细管(50μm×80cm),压力进样(5kPa×8s),分离电压25kV,分离温度25℃。毛细管柱插入质谱前先活化,每天用0.1mol/L氢氧化钠冲洗30min,然后分别用水、1.5mmol/L海美溴铵和缓冲溶液各冲洗3min。所有溶液使用前均经0.45μm微孔滤膜过滤,并用超声波脱气5min,同一缓冲溶液运行3~4次后应更换。
1.5 质谱条件
电喷雾电离源(ESI源,负离子模式),在m/z50~200进行全离子扫描,然后选择m/z89.1(草酸)、115.1(富马酸)、117.1(琥珀酸)、191.1(柠檬酸)、133.2(苹果酸)、175.1(抗坏血酸)、149.0(酒石酸)和89.1(乳酸)带负电荷的准分子离子峰峰面积用于定量;毛细管电压4.0 kV;喷雾气(N2)压力8.27×104Pa;干燥气(N2)流速10L/min,温度350℃;鞘液组成:30%异丙 醇 (含 3.0mmol/L 氨 水);鞘 液 流速6μL/min。
2 结果与讨论
2.1 电泳条件的优化
2.1.1 表面活性剂的种类和浓度对分离的影响
毛细管电泳法常用的表面活性剂有十二烷基三甲基溴化铵(DTAB)、十四烷基三甲基溴化铵(TTAB)、十六烷基三甲基溴化铵(CTAB)等。但由于DTAB、TTAB和CTAB不易挥发,影响样品的电离,大大降低了质谱检测灵敏度,因此不能使用。而海美溴铵作为改性剂,其主要优点是能形成比较牢固的吸附层,不易被缓冲液冲掉[20]。因此在将毛细管插入质谱前先用海美溴铵冲洗,然后用缓冲溶液冲洗10min,可以大大减少表面活性剂对样品电离的影响。
本研究考察了不同浓度的海美溴铵对有机酸迁移时间的影响,示于图1。随着海美溴铵浓度的增加,有机酸迁移时间减少。当海美溴铵浓度大于2.0mmol/L时,柠檬酸和苹果酸部分重叠;而当海美溴铵浓度等于1.5mmol/L时,各酸的分离度和电离强度均较好。

图1 海美溴铵浓度对迁移时间的影响Fig.1 Effect of hexadimethrine bromide concentration on the migration times
2.1.2 缓冲溶液pH值对分离的影响 有机酸为弱酸,其pKa值大多在2~6之间,有机酸的有效迁移率大小在很大程度上取决于缓冲液的pH值。因此缓冲溶液的pH值是影响毛细管电泳分离的关键因素,pH值的改变将引起电渗流(EOF)、峰形及分离度的变化。本研究在pH 3~7的范围内考察缓冲溶液的pH值对分离情况的影响,示于图2。结果表明,迁移时间随着pH的增加而减少,但pH值小于或大于5.0时,都有部分酸分不开,当pH等于5.0时,各酸的分离效果均较好。
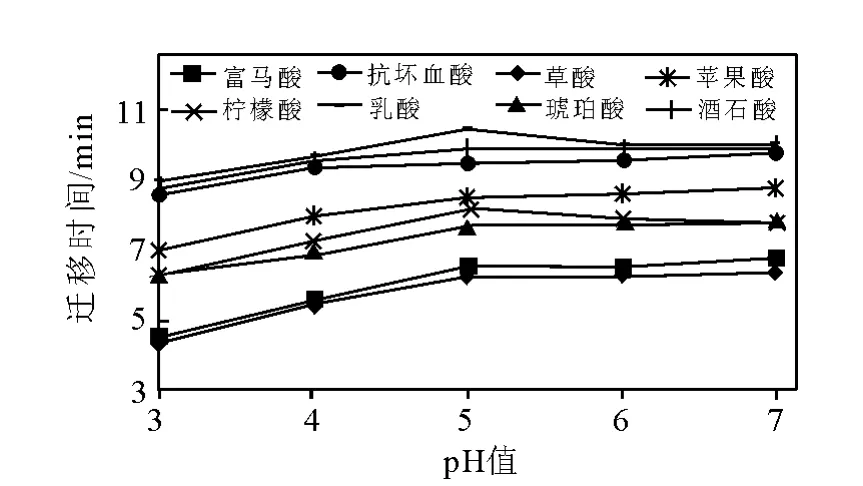
图2 pH值对有机酸迁移时间的影响Fig.2 Effect of pH on the migration times of the organic acids
2.1.3 缓冲溶液种类和浓度对分离的影响
由于质谱中必须使用易挥发的缓冲溶液,难挥发盐的缓冲溶液(如磷酸盐等)容易堵塞喷雾口、污染喷雾室、影响样品的电离。因此本研究选择了易挥发性的铵盐,如甲酸铵和醋酸铵作为缓冲溶液,实验发现醋酸铵的分离效果比甲酸铵好。不同浓度的乙酸铵缓冲溶液对分离度的影响也不同,有机酸的迁移时间随缓冲溶液浓度的增加而加长,从而改善分离度。但是缓冲溶液浓度太大,会产生焦耳热效应,引起区带增宽和分析时间延长,同时各酸的电离强度也降低。综上,缓冲溶液的浓度为40.0mmol/L时,样品分离效果和电离强度较好。
2.2 质谱条件的优化
实验对比了全扫描模式(FS)和选择离子扫描模式(SIM),发现FS模式下8种有机酸的灵敏度略好于SIM模式,灵敏度比对结果列于表1。因此,本实验选择FS模式。
鞘液是影响电喷雾电离条件的重要因素,选择合适的鞘液有利于样品离子化过程中液滴的去溶剂化,能够促进样品电离,降低背景信号。对比了甲醇、异丙醇、乙腈对样品电离的影响,结果显示,使用异丙醇作为鞘液时,背景噪音低且样品电离强度大,当异丙醇浓度达30%时,响应值最高。

表1 全扫描模式与选择离子扫描模式的灵敏度对比(S/N=3,mg/L)Table 1 Comparison of eight acids sensitivity by FS and SIM(S/N=3,mg/L)
甲酸、乙酸、氨水是常用的鞘液添加剂,在30%异丙醇溶液中分别添加了甲酸、乙酸、氨水,结果发现添加氨水效果最佳。综合考虑8种组分的检测灵敏度,选择3mmol/L氨水作为鞘液添加剂,其浓度对电离的影响示于图3。
2.3 鞘液的流速对样品电离的影响
本研究考察了不同鞘液流速对样品电离的影响。当流速从3μL/min升到6μL/min时,样品的电离强度随着流速的增加而升高;当流速大于8μL/min时,样品的电离强度反而降低,因为鞘液的流速太大,对样品有稀释作用。因此选择鞘液的流速为6μL/min。

图3 鞘液中氨水的浓度对电离的影响Fig.3 Effect of the concentration of the ammonium in sheath liquid on ionization
2.4 样品的色谱图及定性分析
在优化的条件下,8种组分在15min内获得分离度较好的总离子流色谱图,示于图4。根据各组分的出峰时间和一级质谱m/z值进行定性分析。
2.5 线性关系及检出限
配制一系列不同浓度的草酸、富马酸、琥珀酸、柠檬酸、苹果酸、抗坏血酸、酒石酸和乳酸标准品混合溶液,按最优化的实验条件进行测定。以8种有机酸的分子离子峰的峰面积对浓度(mg/L)进行线性回归,以峰面积外标法定量,得到分析物回归方程及相关系数,以S/N=3为标准,测得各物质的检出限,列于表2。
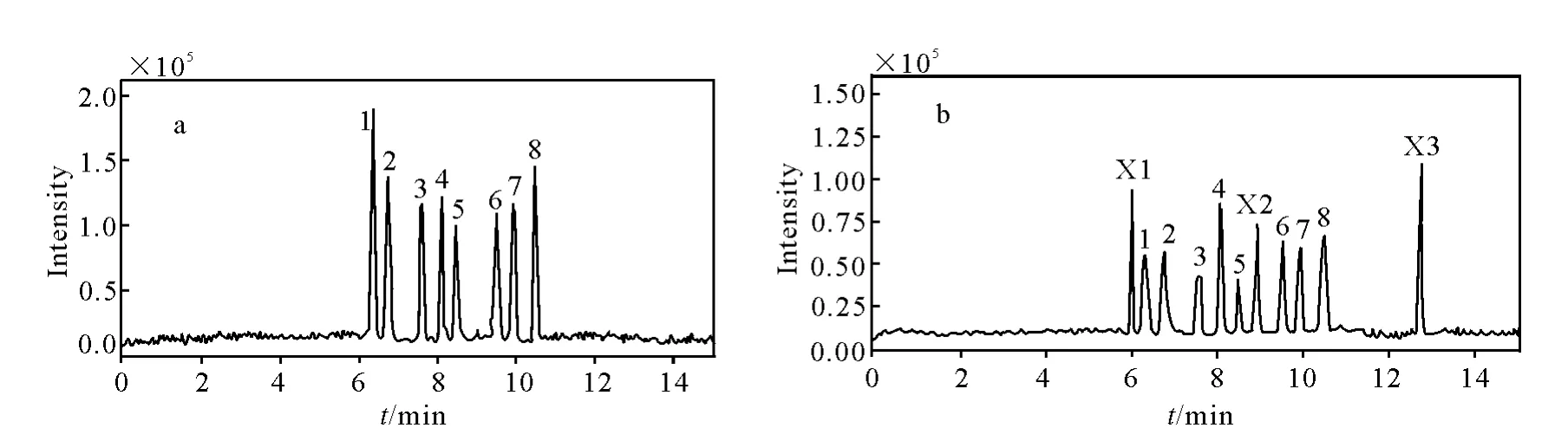
图4 标准品(a)和样品(b)的总离子流图Fig.4 Total ion chromatogram of standard mixture(a)and samples(b)
2.6 精密度和回收率实验
将同一样品分别取2份,其中一份作为本底,另一份准确加入一定量8种有机酸标准溶液,按1.3的方法处理成待测溶液,在优化的实验条件下,对每份样品平行测定5次,按照外标法定量并计算其回收率,结果列于表3。
2.7 样品分析
按优化的实验方法,对市售的5种葡萄酒的有机酸进行测定,结果列于表4。
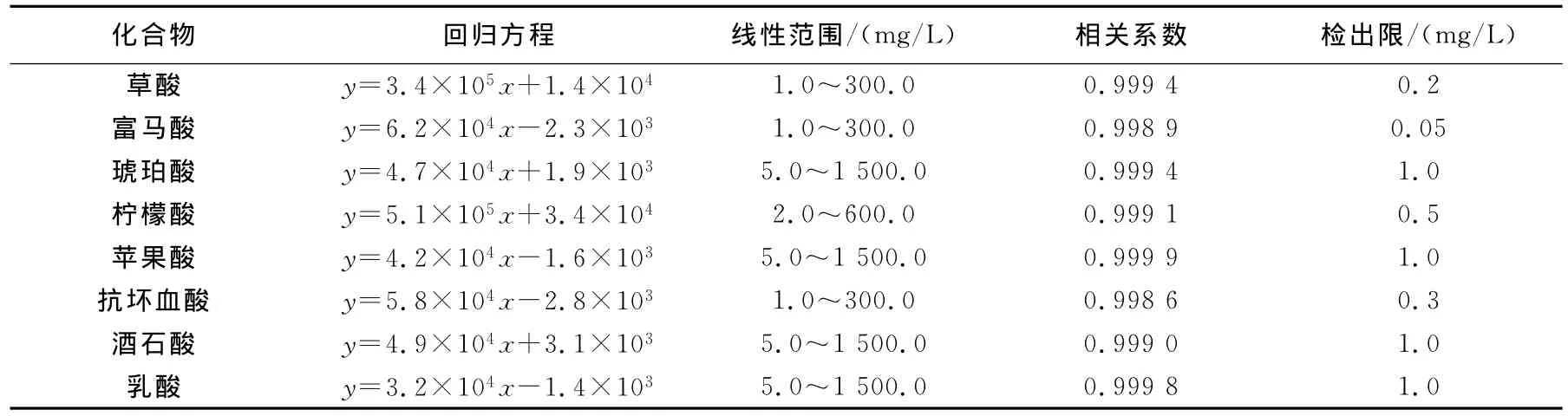
表2 8种有机酸的线性关系和检出限Table 2 The linear range and detection limit of eight organic acids

表3 样品加标回收率(n=5)Table 3 Recovery of the method(n=5)

表4 样品测定结果(n=5)Table 4 Results of sample analysis(n=5)
3 结论
本研究采用毛细管电泳-电喷雾电离质谱法同时测定了葡萄酒中草酸、富马酸、琥珀酸、柠檬酸、苹果酸、抗坏血酸、酒石酸和乳酸8种有机酸含量,该方法不需衍生,前处理简单、快速、专一性强,灵敏度、重现性好,适合复杂体系中有机酸成分的分析。
[1] 吕旭聪,黄志清,黄若兰,等.反相高效液相色谱法同时快速测定黄酒和葡萄酒中有机酸的含量[J].食品与发酵工业,2010,36(6):131-135.LV Xucong,HUANG ZHiqing,HUANG Ruolan,et al.Simultaneous determination of organic acids in wine with reverse-phase high performance liquid chromatography[J].Food and Fermentation Industries,2010,36(6):131-135(in Chinese).
[2] 崔 婧,段长青,潘秋红.反相高效液相色谱法测定葡萄中的有机酸[J].中外葡萄与葡萄酒,2010,(5):25-30.CUI Jing,DUAN Changqing,PAN Qiuhong.Determination of organic acids in grape berry with reversed-phase high performance liquid chromatography[J].Sino-Overseas Grapevine Wine,2010,(5):25-30(in Chinese).
[3] GONCALVES J,SILVA C L,CASTILHO P C,et al.An attractive,sensitive and high-throughput strategy based on microextraction by packed sorbent followed by UHPLC-PDA analysis for quanti-fication of hydroxybenzoic and hydroxycinnamic acids in wines[J].Microchemical Journal,2013,106:129-138.
[4] ZHENG Y J,DUAN Y T,ZHANG Y F,et al.Determination of organic acids in red wine and must on only one RP-LC-column directly after sample dilution and filtration[J].Chromatographia,2009,69(11/12):1 391-1 395.
[5] ESCOBAL A,GONZALEZ J,IRIONDO C,et al.Liquid chromatographic determination of organic acids in txakoli from Bizkaia[J].Food Chem,1997,58(4):381-384.
[6] LÓPEZ E F,GÓMEZ E F.Simultaneous determination ofthe major organicacids,sugars,glycerol,and ethanol by HPLC in grape musts and white wines[J].J Chromatogr Sci,1996,34(5):254-257.
[7] ZHU Y,ZHANG X D,NIU W J.Simultaneous determination of carbohydrat es and organic acids in beer and wine by ion chromatography[J].Mikrochim Acta,1997,127(3/4):189-194.
[8] MORALES M L,GONZALEZ A G,TRONCOSO A M.Ion-exclusion-chromatographic determination of organic acids in vinegars[J].J Chromatogr A,1998,822(1):45-51.
[9] 成 霈,刘 佳,顾慧莹,等.离子色谱法测定果酒中的有机酸[J].食品与发酵工业,2011,37(8):175-177.CHENG Pei,LIU Jia,GU Huiying,et al.Determination of organic acid in fruit wine by ion chromatography[J].Food and Fermentation Industries,2011,37(8):175-177(in Chinese).
[10] FLORES P,HELLÍN P,FENOLL J.Determination of organic acids in fruits and vegetables by liquid chromatography with tandem-mass spectrometry[J].Food Chem,2012,132(2):1 049-1 054.
[11] CASTINEIRA A,PENA R M,HERRERO C,et al.Analysis of organic acids in wine by capillary electrophoresis with direct UV detection[J].J Food Comp and Anal,2002,15(3):319-331.
[12] PERES R G,MORAES E P,MICKE G A,et al.Rapid method for the determination of organic acids in wine by capillary electrophoresis with indirect UV detection[J].Food Control,2009,20(6):548-552.
[13] CASTINEIRA A,PENA R M,HERRERO C,et al.Simultaneous determination of organic acids in wine samples by capillary electrophoresis and UV detection:Optimization with five different background electrolytes[J].J High Resol Chromatogr,2000,23(11):647-652.
[14] CHEN Z L,TANG C,YU J C.Simultaneous determination ofinorganic anions and organic acids in environmental samples by capillary zone electrophoresis with indirect UV detection[J].J High Resol Chromatogr,1999,22(7):379-385.
[15] 唐美华,屠春燕,薛亚芳,等.毛细管电泳法测定葡萄酒中的有机酸含量[J].食品科学,2009,30(8):209-211.TANG Meihua,TU Chunyan,XUE Yafang,et al.Determination of organic acids in grape wine using capillary zone electrophoresis[J].Food Science,2009,30(8):209-211(in Chinese).
[16] MATO I,SUA′REZ-LUQUE S,HUIDOBRO J F.Simple determination of main organic acids in grape juice and wine by using capillary zone electrophoresis with direct UV detection[J].Food Chem,2007,102(1):104-112.
[17] 梁 振,段继诚,张维冰,等.毛细管电泳-电喷雾质谱联用中缓冲液pH对质谱检测灵敏度的影响[J].色谱,2003,21(1):9-12.LIANG Zhen,DUAN Jicheng,ZHANG Weibing,et al.Evaluation of the effects of the pH value of buffer on capillary electrophoresis-electrospray ionization-mass spectrometry signal intensity[J].Chinese Journal of Chromatography,2003,21(1):9-12(in Chinese).
[18] 周国华,罗国安.毛细管电泳质谱联用技术及其应用[J].分析科学学报,1998,14(4):338-344.ZHOU Guohua,LUO Guoan.Capillary electrophoresis-mass spectrometry and its application[J].Journal of Analytical Science,1998,14(4):338-344(in Chinese).
[19] 许崇峰,申华莉,宋浩威,等.毛细管电泳-电喷雾质谱联用技术及其在蛋白质分析领域中的应用[J].分析测试学报,2002,21(4):95-98.XU Congfeng,SHEN Huali,SONG Haowei,et al.Capillary electrophoresis-electrospray mass spectrometry and its application in proteomics[J].Journal of Instrumental Analysis,2002,21(4):95-98(in Chinese).
[20] TERABE S,IAEMURA T.Effect of polymer ion concentration on migration velocities in ionexchange electrokinetic chromatography[J].J Chromato A,1990,515:667-676.

