超高效液相色谱-串联质谱法测定鱼中孔雀石绿、结晶紫及其代谢物残留量
周贻兵,吴 坤,刘利亚,王娅芳,李 磊,林 野
(1.贵州省疾病预防控制中心,贵州 贵阳 550004;2.贵州师范学院,贵州 贵阳 550018)
孔雀石绿(malachite green,MG)和结晶紫(crystal violet,CV)均属于碱性三苯甲烷类染料。MG与CV能够阻碍蛋白肽的形成,抑制细胞分裂,从而产生良好的抗菌和杀菌作用,因杀菌效果较好、价廉、易得等优点,作为化学消毒剂曾被广泛应用于水产养殖疾病的防治。鱼暴露在含有MG或CV的水中,MG和CV会迅速被鱼类吸附且富集在肌肉中,并在组织中很快代谢为危害性更强的隐色孔雀石绿(leucomalachite green,LMG)和隐色结晶紫(leucocrystal violet,LCV),而代谢物在肌肉组织中的残留时间较长。MG和CV及其代谢物具有高毒、高残留和致癌、致畸、致突变等特点[1-7]。欧美、日本等国家已宣布严禁在水产养殖中使用孔雀石绿和结晶紫,并规定水产品中孔雀石绿和结晶紫不得检出。2002年5月我国农业部将其列入《食品动物禁用的兽药及其化合物清单》中,禁止用于所有食品动物,但非法使用屡禁不止。
目前,鱼中孔雀石绿、结晶紫及其代谢物的测定方法有高效液相色谱法、气相色谱-质谱法、高效液相色谱-质谱法、高效液相色谱-串联质谱法、共振瑞利散射法、薄层色谱法、分光光度法等[8-12]。气相色谱-质谱法仅能测定隐性孔雀石绿;液相色谱-质谱法需要特殊的柱后衍生设备,可能会引起峰展宽、降低灵敏度,同时衍生化试剂也可能对分离造成干扰;薄层色谱法、分光光度法等操作过程繁琐,易造成假阳性。鱼样品的基质较为复杂,易造成基质抑制效应,可通过稳定性同位素稀释技术、基质匹配标准曲线和选择较优的样品净化技术来解决。本研究在样品中加入同位素内标,采用超高效液相色谱-串联质谱(UPLC-MS/MS)法同时测定鱼样品中 MG、LMG、CV、LCV残留,并对大批次鱼样的肌肉组织进行检测。
1 实验部分
1.1 仪器与试剂
Ultimate 3000超高压液相色谱仪,TSQ Quantum ultra三重四极杆质谱仪:美国Thermo-Fisher世尔科技有限公司产品,配有电喷雾离子源(ESI);Sigma台式高速离心机;TTL-DCⅡ型氮吹仪;艾科浦超纯水机;中性氧化铝固相萃取小柱(6mL/1g)。
孔雀石绿、隐色孔雀石绿标准品(100mg/L):购自农业部环境保护科研所;结晶紫标准品(纯度>98.9%)、隐色结晶紫(纯度>99.7%):购自中国计量科学研究院;D5-孔雀石绿苦味酸盐标准品和D5-隐色孔雀石绿标准品(纯度>99.7%):购自Sigma公司;醋酸铵(分析纯),乙腈(色谱纯),甲酸(色谱纯):购自天津市科密欧化学试剂有限公司。
标准溶液的配制:分别准确称取适量的结晶紫、隐色结晶紫、D5-隐色孔雀石绿和D5-孔雀石绿苦味酸(折算成D5-孔雀石绿)标准品,用乙腈配制成1 000mg/L标准贮备液;将标准贮备液(CV、LCV、D5-MG、D5-LMG)和 MG、LMG(100mg/L)用乙腈稀释成10mg/L标准中间液和内标中间液;分别取适量的标准中间液和内标中间液,用乙腈稀释成100μg/L标准使用液。
1.2 样品处理
1.2.1 样品的制备与提取 从市场上购买不同品种的活鱼,经剖杀去除头、骨、内脏,将肉切成块状,用电动绞肉机打成浆状,于-20℃保存,待测。
将鱼样解冻,准确称取5g(精确到0.1g)均匀样品于50mL塑料离心管中,添加100μL混合同位素内标使用液,加入25mL乙腈,旋涡混匀器上混匀,以10 000r/min离心10min,收集上清液于玻璃管中,待净化。
1.2.2 样品净化 用5mL乙腈活化中性氧化铝小柱,取5mL上清液于中性氧化铝小柱上,用10mL玻璃试管收集滤液,再用5mL乙腈淋洗小柱,将收集的滤液和淋洗液混合,40℃下氮吹至近干,用V(乙腈)∶V(5mmol/L醋酸铵)=50∶50的溶液溶解残渣,过0.22μm滤膜,液质联用仪检测。
1.3 实验条件
1.3.1 色谱条件 色谱柱:Hypersil Gold-C18柱(150mm×2.1mm×1.9μm);柱温30℃;进样体积10μL;流动相:5mmol/L乙酸铵(用乙酸调节pH 4.5)和乙腈;流速0.4mL/min;梯度洗脱条件列于表1。
1.3.2 质谱条件 ESI(+)离子源,喷雾电压3 000V,毛细管温度350℃,蒸发温度450℃,鞘气压力276kPa,辅助气压力104kPa,碰撞气(Ar)压力0.2Pa,SRM 优化参数列于表2。
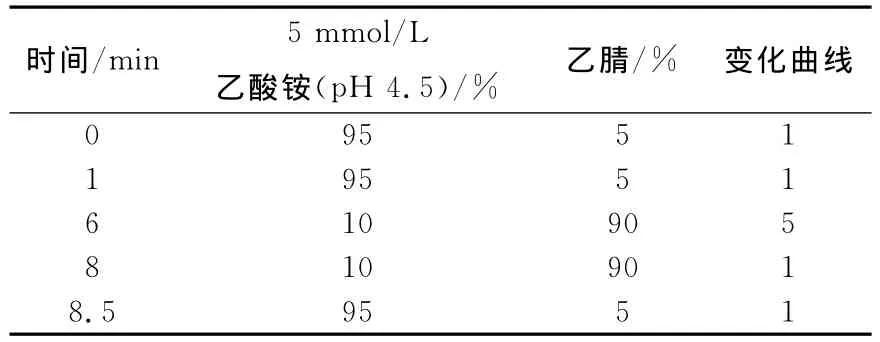
表1 梯度洗脱条件Table 1 The conditions of gradient elution

表2 质谱参数Table 2 MS parameters
2 结果与讨论
2.1 提取与净化
MG、CV在鱼肌肉组织中很快代谢为LMG、LCV,隐色代谢物具有很好的亲脂性,鱼肌肉样品基质化学成分复杂,其中脂肪的存在不利于目标物的提取与净化,在测定过程中易产生离子抑制效应,所以应设法去除脂肪以提高离子化效率和仪器的灵敏度。去除样品中的脂肪常用氧化铝(酸性氧化铝、中性氧化铝、碱性氧化铝)[13-14],在非极性溶剂乙腈中,用乙腈活化过的酸性氧化铝和中性氧化铝对目标化合物的吸附能力很弱,而碱性氧化铝对MG有一定的吸附,所以本实验选择的中性氧化铝能有效的去除脂肪且减少目标化合物的吸附。在样品提取和净化过程中,微量的LMG、LCV被氧化为MG、CV,文献报道[15]加入还原能力更强的物质能有效防止这种情况的发生,而本实验则采用加入稳定性同位素内标物质来提高测定的准确性。
2.2 LC-MS/MS分析
通过ESI正离子模式对4种目标化合物及2种内标化合物进行全扫描,找出准分子离子峰[M+H],并且以此准分子离子峰为母离子进行轰击和二级质谱扫描,找出2个信号较强的碎片离子构成监测离子对(表2)。结晶紫碎片离子的质谱图示于图1,可以看出,结晶紫m/z340和356两个碎片离子的响应信号较强,以这两个碎片离子和准分子离子峰构成监测离子对。改变透镜电压使母离子最大效率的通过一级质谱进入二级质谱进行碰撞,对碎片离子的碰撞能量进行优化,提高碎片离子的响应强度。结晶紫准分子离子透镜电压优化曲线和碎片离子碰撞能量优化曲线示于图2。
在流动相中加入适量的甲酸、乙酸和低浓度的挥发性缓冲盐在离子化过程中得到更加丰富的离子碎片信息,改善峰形,提高测定的灵敏度,本实验在流动相水中加入5mmol/L醋酸铵,用乙酸调节pH 4.5,获得良好的效果。以SRM模式对待测物进行定性定量分析,混合标准溶液SRM图示于图3。

图1 结晶紫准分子离子(a)和碎片离子(b)质谱图Fig.1 Mass spectrometer of quasi-molecular(a)and fragment(b)ions of CV

图2 结晶紫准分子离子透镜电压(a)和碎片离子碰撞能量优化曲线(b)Fig.2 Optimizing curves of quasi-molecular ion tube lens(a)and fragment ion collision energy(b)of CV

图3 混合标准溶液的提取离子色谱图Fig.3 Ion chromatogram of extract in mixed standard solution
2.3 工作曲线和检出限
取100μg/L混合标准工作液和混合同位素内标工作液,用V(乙腈)∶V(5mmol/L醋酸铵)=50∶50的溶液配制成0、0.25、0.5、1.0、2.0、4.0μg/L系列浓度溶液,其中内标含量均为2.0μg/L,按1.3进行测定。分别用 MG、CV的峰面积与D5-MG的峰面积比值和LMG、LCV的峰面积与D5-LMG的峰面积比值为纵坐标,以质量浓度为横坐标绘制工作曲线。MG:y=0.219 7x-0.011 1(r2=0.999 1);CV:y=0.245 7x-0.006 4(r2=0.999 6);LMG:y=0.443 7x-0.011 4(r2=0.999 6);LCV:y=0.083 8x+0.004 1(r2=0.999 3)。以各目标物在空白样品中的S/N=3计算该方法的检出限,MG、LMG、CV 检出限为 0.01 μg/kg,LCV检出限为0.06μg/kg。
2.4 方法的回收率及精密度实验
在空白样品中分别添加0.25、2.0μg/kg混合标准溶液和2.0μg/kg内标溶液,充分混匀,放置过夜吸收,按1.2方法提取、净化、上机测定,回收率及精密度列于表3。

表3 回收率及精密度实验结果(n=6)Table 3 The results of recoveries and precision
2.5 实际样品的测定
应用此方法检测市售的109批鱼样品,其中孔雀石绿阳性样品1份,含量为0.57μg/kg;隐色孔雀石绿阳性样品15份,含量在0.65~10.6 μg/kg之间;结晶紫阳性样品5份,含量在0.56~1.19μg/kg之间;隐性结晶紫阳性样品1份,含量为0.65μg/kg。结果表明,市售的鱼样品中仍然存在滥用孔雀石绿和结晶紫的情况。
3 结论
本研究建立了UPLC-MS/MS测定鱼样品中孔雀石绿、结晶紫及其代谢物残留量的方法。样品中MG、CV及其代谢物直接用乙腈提取,简化了样品前处理步骤,同时加入稳定同位素内标进行校正,降低基质抑制效应。在空白样品中加入两个浓度水平的标准溶液,回收率、精密度良好,检出限低。该方法能够灵敏、准确、可靠的测定鱼中MG、CV及其代谢物残留,为鱼类水产品养殖、流通和使用环节的市场监管提供参考依据。
[1] CULP S J,BELAND F A.Malachite green:A toxicological review [J].International Journal of Toxicology,1996,15:219-238.
[2] 刘 军,胡华军,张明洲,等.鱼药孔雀石绿的毒性、危害和检测现状[J].浙江农业学报,2006,18(5):397-340.LIU Jun,HU Huajun,ZHANG Mingzhou,et al.Review on toxicity,damage and detection of fishing drug-malachite green[J].Acta Agriculturae Zhangjiang Gensis,2006,18(5):397-340(in Chinese).
[3] 李永生,刘艳辉.禁用药物孔雀石绿的毒性、危害及控制措施[J].吉林水利,2010,30(5):100-102.LI Yongsheng,LIU Yanhui.The toxicity of prohibited of malachite green,hazards and control measures[J].Jilin Water Resources,2010,30(5):100-102(in Chinese).
[4] 翟毓秀,郭莹莹,耿 霞,等.孔雀石绿的代谢机理及生物毒性研究进展[J].中国海洋大学学报,2007,37(1):27-32.ZHAI Yuxiu,GUO Yingying,GENG Xia,et al.Advances in studies on metabolic mechanism and bio-toxicity of malachite green[J].Periodical of Ocean University of China,2007,37(1):27-32(in Chinese).
[5] ANDERSEN W C,ROYBAL J E,TURNIPSEED S B.Liquid chromatographic determination of malachite green and leucomalachite green(LMG)residues in salmon with in situ LMG Oxidation[J].Journal of AOAC International,2005,88:1 292-1 298.
[6] LEE K C,WU J L,CAI Z G.Determination of malachite green and leucomalachite green in edible goldfish muscle by liquid chromatography-ion trap mass spectrometry[J].Journal of Chromatography B,2006,843(2):247-251.
[7] WU X L,ZHANG G,WU Y N,et al.Simultaneous determination of malachite green,gentian violet and their leucometabolites in aquatic products by high-performance liquid chromatographylinear ion trap mass spectrometry[J].J Chromatography A,2007,1 172(2):121-126.
[8] BERGWERFF A A,SCHERPENISSE P.Determination of residues of malachite green in aquatic animals[J].Journal of Chromatography B,2003,788(2):351-359.
[9] 朱宽正,王 鹏,林雁飞,等.液相色谱-串联质谱法同时测定水产品中孔雀石绿、结晶紫以及它们的隐色代谢物残留[J].色谱,2007,25(1):66-69.ZHU Kuanzheng,WANG Peng,LIN Yanfei,et al.Simultaneous determination of residues of malachite green,crystal violet and their leuco metabolites in aquatic products by liquid chromatography-tandem mass spectrometry[J].Chinese Journal of Chromatography,2007,25(1):66-69 (in Chinese).
[10] 谢 文,丁慧瑛,奚君阳,等.水产品中孔雀石绿、结晶紫及其代谢产物残留量的检测[J].色谱,2006,24(5):529-530.XIE Wen,DING Huiying,XI Junyang,et al.Determination of residual amounts of malachite green crystal violet and their lucobases in aquatic products[J].Chinese Journal of Chromatography,2006,24(5):529-530(in Chinese).
[11] 高华鹏,李永夫,沈维军,等.高效液相色谱-串联质谱联用测定鳗鱼中孔雀石绿、结晶紫及其代谢物残留量[J].理化检验:化学分册,2008,44(2):103-106.GAO Huapeng,LI Yongfu,SHEN Weijun,et al.HPLC-MS/MS determination of residual amounts of malachite green crystal violet and their lucobases in eel[J].Physical Testing and Chemical Analysis Part B:Chemical Analysis,2008,44(2):103-106(in Chinese).
[12] 张玉黔,权伍英,栾 燕,等.液相色谱-串联质谱法测定水产品中孔雀石绿及其代谢产物隐性孔雀石绿的方法研究[J].中国卫生检验杂志,2006,16(7):826-827.ZHANG Yuqian,QUAN Wuying,LUAN Yan,et al.Determination of viola crystallina,leucoviola crystallina and their metabolites contents in aquatic products by HPLC-MS/MS methods[J].Chinese Journal Health Laboratory Technology,2006,16(7):826-827(in Chinese).
[13] RUSHING L G,THOMPSON Jr H C.Simultaneous determination of malachite green,gentian violet and their leucometabolites in cat fish or trout tissue by high-performance liquid chromatography with visible detection[J].Journal of Chromatography B,1997,688:325-330.
[14] 郭德华,叶长淋,朱莹洁.液相色谱法测定鳗鱼中的孔雀石绿[J].化学计量分析,2002,11(2):20-21.GUO Dehua,YE Changlin,ZHU Yingjie.Determination of malachite green in the eel by liquid chromatography[J].Chemical Analysis and Meterage,2002,11(2):20-21(in Chinese).
[15] 江 洁,林 洪,徐 杰.孔雀石绿及无色孔雀石绿的固相萃取性能比较[J].理化检验:化学分册,2008,44(10):965-967.JIANG Jie,LIN Hong,XU Jie.Study of extraction behavior of solid phase extraction materials for malachite green and leucomalachite green[J].Physical Testing and Chemical Analysis Part B:Chemical Analysis,2008,44(10):965-967(in Chinese).

