28烷醇对6-羟基多巴胺致帕金森病大鼠的行为学作用及其机制研究①
王涛,乔洪文,刘雁勇,杨楠,纪超,陈彪,左萍萍
·专题·
28烷醇对6-羟基多巴胺致帕金森病大鼠的行为学作用及其机制研究①
王涛1,乔洪文1,刘雁勇2,杨楠2,纪超2,陈彪1,左萍萍2
目的 观察28烷醇对帕金森病模型大鼠的行为学改善作用与中脑水平神经生长因子(NGF)、神经生长因子前体(proNGF)及其各自受体表达的变化。方法将6-羟基多巴胺(6-OHDA)通过立体定位仪注入大鼠右侧纹状体,以28烷醇17.5 mg/kg (低剂量组)、35 mg/kg(中剂量组)、70 mg/kg(高剂量组)进行干预。给药2周后行阿朴吗啡诱导的旋转测试和平衡杆测试;TUNEL染色检测纹状体内的细胞凋亡情况;Western印迹法检测caspase-3、NGF及其受体、proNGF及其受体蛋白表达情况。结果与模型组相比,中剂量和高剂量组旋转试验和平衡杆实验成绩改善(P<0.05);高剂量组纹状体内凋亡小体减少(P<0.05),NGF及其受体TrkA表达增高(P<0.05),proNGF及其受体sortilin和p75NTR表达降低(P<0.05),caspase-3表达减少(P<0.05)。结论28烷醇可改善帕金森病大鼠病理行为。其神经保护机制可能是调节NGF介导的细胞存活通路和proNGF介导的凋亡通路相关蛋白表达,进而减少神经细胞凋亡。
帕金森病;神经生长因子;神经生长因子前体;神经保护;凋亡;大鼠
[本文著录格式]王涛,乔洪文,刘雁勇,等.28烷醇对6-羟基多巴胺致帕金森病大鼠的行为学作用及其机制研究[J].中国康复理论与实践,2013,19(11):1001-1005.
帕金森病是常见的与衰老有关的神经系统退行性疾病。根据我国的一项调查,65岁以上人群中,帕金森病的患病率为1.7%[1],尚未诊断的帕金森病患者大约还有300万~400万。随着我国人口老龄化的加剧,帕金森病患者数也将会在未来20年呈急剧上升趋势。目前尚无治愈疾病的有效方法,多巴胺替代疗法只能控制运动系统的症状,但不能阻止病理进程。因此,寻求阻止或延缓帕金森病病理进程的神经保护治疗是帕金森病治疗的根本措施[2]。28烷醇是一种从米糠蜡、甘蔗蜡等中提取的天然长链高级脂肪醇。它可有效降低血清胆固醇水平,抗脂质过氧化,抑制血小板凝聚,抑制血管内皮平滑肌细胞的增生等[3]。初步临床研究显示,一定剂量的28烷醇对帕金森病患者有一定疗效[4]。本实验观察28烷醇对帕金森病模型大鼠的行为学改善作用及其分子学机制。
1 材料与方法
1.1 实验动物及分组
健康Sprague-Dawley大鼠63只,雄性,体重210~220g,鼠龄3个月,由北京维通利华动物公司提供。行为学测试无异常。按照体重从轻到重顺序为动物编号(1~63号),利用随机数字表,63只大鼠随机分为假手术组(n=10)和造模组(n=53)。
1.2 主要试剂和药品
28烷醇单体由中国医学科学院药物所朱海波教授惠赠,以含0.5%缩甲基纤维素钠(CMC)水助溶制成悬浮液。6-羟基多巴胺(6-hydroxydopamine,6-OHDA)、阿朴吗啡(Apomorphine,APO):美国SIGMA公司;兔多克隆抗神经生长因子前体(precursor of nerve growth factor,proNGF)抗体:CHEMICON公司;神经生长因子(nerve growth factor,NGF)和sortilin抗体:ABCAM公司;p75NTR抗体:UPSTATE公司;兔多抗caspase-3、phospho-TrkA(p-TrkA)及actin抗体:SANTA CRUZ公司;HRP标记羊抗兔二抗及SP-9002免疫组化试剂盒:北京中杉金桥公司;TUNEL凋亡试剂盒:美国罗氏公司。
1.3 方法
1.3.1 帕金森病大鼠模型的制备 造模组大鼠腹腔注射1%戊巴比妥钠50 mg/kg麻醉,颅平位固定于大鼠脑立体定向仪。剪开头皮并剥离骨膜,确定具体坐标并标记,用牙科钻小心钻透颅骨。根据Paxinos Watson图谱,确定右侧纹状体(CPU)坐标,行两点注射[5]:前囟前0.5 mm,矢状线旁开2.5 mm,硬膜下5.0 mm;前囟后0.5 mm,矢状线旁开4.2 mm,硬膜下5.0 mm。两点各注射6-OHDA 15 μg,3 μl(溶于含0.2%抗坏血酸的生理盐水),注射速度1 μl/min,留针10 min,缓慢退针3 min(1 mm/min)。假手术组用相同方法两点注射同体积含0.2%抗坏血酸的生理盐水。术后模型成功标准参考文献[6]。
1.3.2 帕金森病大鼠模型筛选 术后第4周开始对53只造模组大鼠进行旋转实验筛选:阿朴吗啡0.5 mg/kg颈部皮下注射,观察行为变化30 min;若大鼠恒定转向健侧,且旋转圈数>150 r,每分钟最大旋转次数≥7,表示毁损稳定,视为造模成功。共40只造模组大鼠成功。
1.3.3 模型大鼠分组及给药 造模成功的大鼠按旋转圈数从少到多顺序为动物进行编号(1~40号),利用随机数字表随机分为模型组(n=10)、低剂量组(n=10)、中剂量组(n=10)和高剂量组(n=10)。分组后第1天,低、中、高剂量组大鼠分别给予28烷醇17.5 mg/kg、35 mg/kg、70 mg/kg,每天灌胃给药1次,模型组及假手术组给等量0.5%CMC水,连续给药2周。
1.3.4 行为学检测 给药2周后,行阿朴吗啡诱导的旋转试验和平衡杆试验。
1.3.4.1 阿朴吗啡诱导旋转实验 阿朴吗啡0.5 mg/kg行大鼠颈部皮下注射,观察并记录其在30 min内转向健侧的圈数。
1.3.4.2 平衡杆试验[7]平衡木杆105×4×3 cm,离地80 cm,两端由木架支撑。木杆的一端为起始区,长20 cm,另一端为终点区,终点区后接一个大鼠笼,木杆下有1×1 m、厚12 cm垫子防止大鼠摔伤。
实验时,将大鼠放在起始区,面对鼠笼方向,开始计时。记录大鼠走过起始区的时间(潜伏期)和大鼠走过整个平衡杆的时间。潜伏期最大允许时间为1 min,走过横杆最大允许时间为2 min。大鼠先训练3次,然后开始正式实验。
1.3.5 TUNEL染色 行为学检测后,每组3只大鼠戊巴比妥钠50 mg/kg深度麻醉,剪开胸腔,暴露心脏,从左心尖处插入灌流针,剪开右心耳。先用PBS灌流,待血液冲洗干净后改用4%多聚甲醛继续灌流约15 min。断头取脑,置于4%多聚甲醛中4℃过夜。15%、20%和30%蔗糖溶液梯度脱水,4℃存放。冰冻切片机切取冠状脑片,片厚30 μm,收集于标本保护液中,-20℃保存。TUNEL染色步骤参照罗氏公司提供的产品说明书,DAB显色、干燥封片。每只动物取对应部位2张脑片统计凋亡小体,分析软件为Image-Pro Plus。
1.3.6 蛋白表达 行为学检测后,每组取6只大鼠迅速断头取脑,在冰面上迅速分离出两侧纹状体,-80℃冰箱保存。将各组右侧(患侧)纹状体放在平皿中,加入适量新鲜配制的RIPA裂解液,剪刀剪碎组织块(冰上操作);4℃ 3000 g离心5 min;弃上清,预冷PBS重复离心洗涤组织沉淀,至液体无红色;将组织沉淀转移至玻璃匀浆器,按30 mg组织加入RIPA裂解液10 ml/mg组织,冰上反复匀浆0.5~l h;4℃ 14,000 g离心15 min,取上清。用Bradford法定量蛋白。Western印迹电泳方法参见文献[8]。所有Western印迹实验至少重复3次,电泳条带结果定量分析采用Alpha-Ease®FC软件,相对密度采用靶蛋白/内参蛋白(actin)比值表示。
1.4 统计学分析
2 结果
2.1 行为学
在阿朴吗啡诱导旋转试验中,模型组动物在30 min内向健侧旋转的次数高于假手术组(P<0.001);低剂量组30 min向健侧旋转次数与模型组无显著性差异,而中剂量组及高剂量组30 min内旋转次数均减少(P<0.05)。在平衡杆试验中,与假手术组相比,模型组潜伏期和过杆总时间均增加(P<0.05);给药2周后,中剂量组和高剂量组的潜伏期和过杆总时间较模型组减少(P<0.05)。见表1。
2.2 TUNEL染色
与假手术组相比,模型组患侧纹状体区多数区域出现明显细胞核固缩,核内染色质在局部区域凝集,致密浓染,凋亡阳性细胞显著增多(P<0.001);与模型组相比,中剂量和高剂量组患侧纹状体内凋亡阳性细胞减少(P<0.05)。见图1、表2。
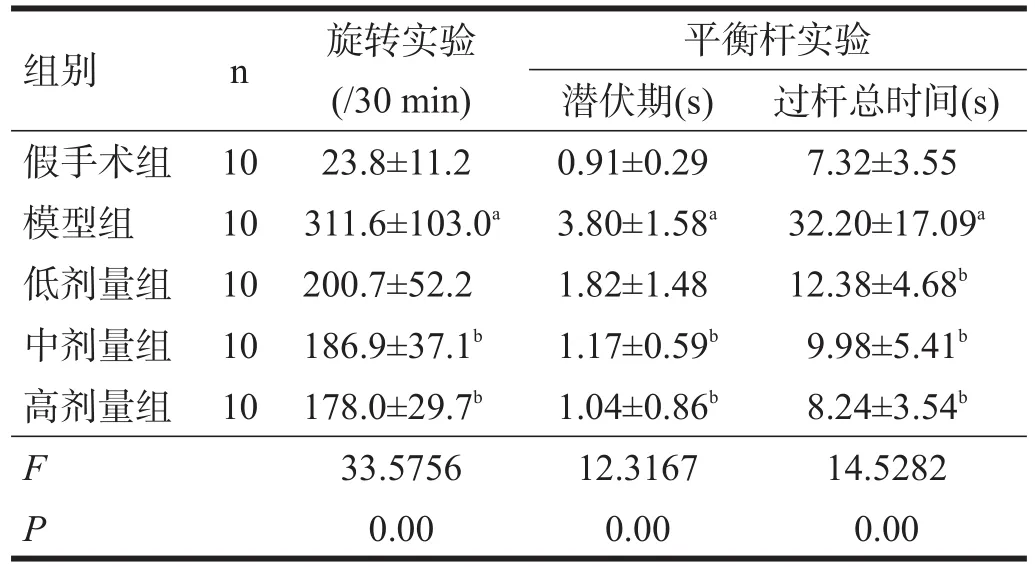
表1 各组行为学指标比较
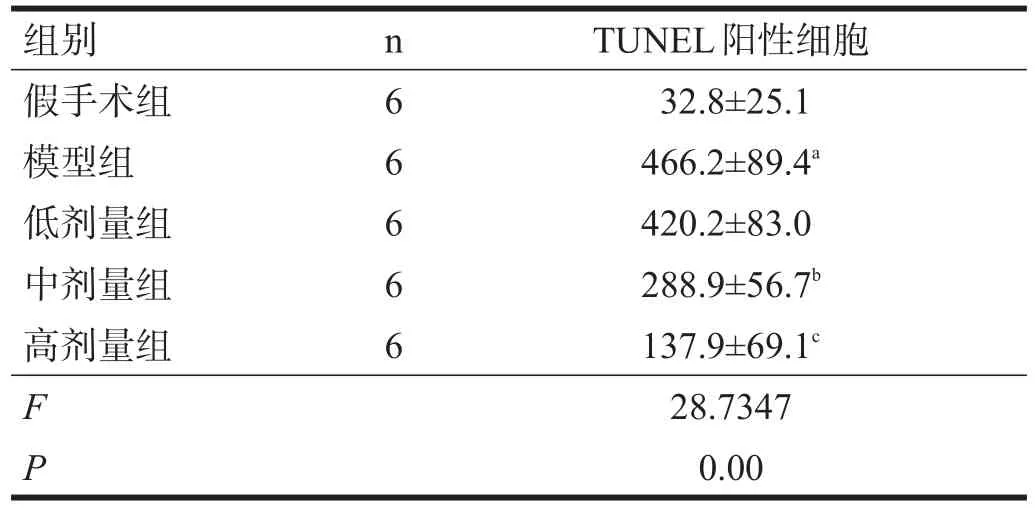
表2 各组TUNEL阳性细胞数比较(/mm2)

图1 各组纹状体TUNEL染色
2.3 蛋白表达
模型组凋亡相关蛋白caspase-3表达明显高于假手术组(P<0.01),高剂量组低于模型组(P<0.05)。
模型组介导细胞存活通路的NGF及其受体TrkA的磷酸化(活化)水平明显低于假手术组(P<0.01),介导细胞凋亡通路的proNGF及其受体sortilin及p75NTR高于假手术组(P<0.05);中剂量组和高剂量组NGF及TrkA表达高于模型组(P<0.05),而proNGF、sortilin和p75NTR表达低于模型组(P<0.05)。见表3。
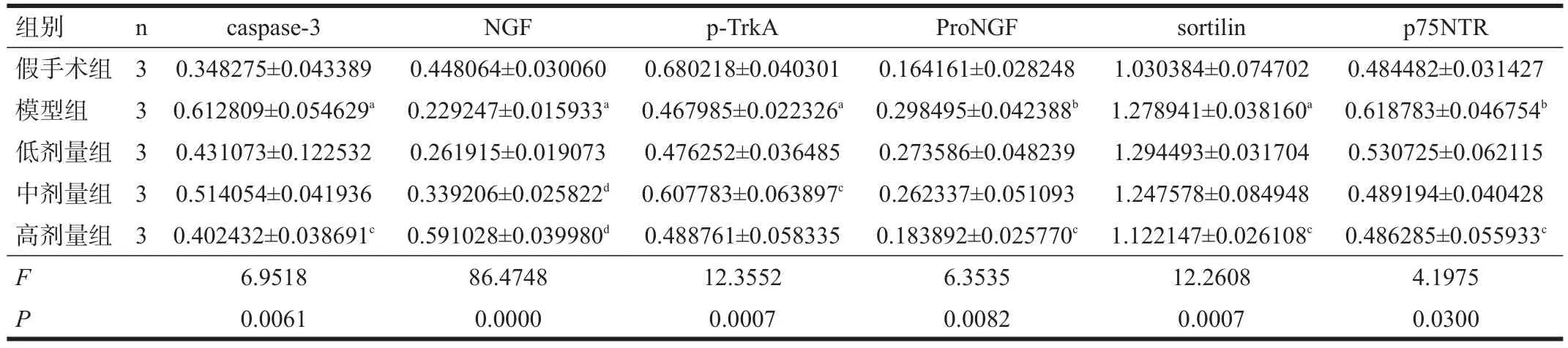
表3 各组纹状体内蛋白表达相对光密度(/actin)
3 讨论
28烷醇是从植物蜡中提取的天然长链高级脂肪醇(CH3[CH2]27OH,分子量410.77),是新型调脂非处方药普利醇的主要成分。普利醇作为一种与他汀类不同的降脂药物,可有效降低血清胆固醇水平,抑制血小板凝聚和血管内皮平滑肌细胞增生等。28烷醇在体内吸收分布较快[9],具有增强体力、精力和耐力,安全性和耐受性好等特点,为帕金森病的临床治疗和干预提供了新的潜在单体药物。
本研究使用脑立体定位技术,将6-OHDA单侧纹状体两点注射,构建帕金森病大鼠模型。并采用2项帕金森病行为学指标进行药效学评价。①阿朴吗啡诱导旋转试验,其原理是多巴胺(DA)神经末梢及黑质区的多巴胺神经元被6-OHDA选择性损毁,敏感性增高,出现超敏现象,注射多巴胺受体激动剂阿朴吗啡,可使模型动物向健侧产生旋转行为;②平衡杆实验,包括潜伏期和过杆总时间两项指标,分别评估大鼠的运动始动性和运动平衡能力[7]。行为学检测结果显示,帕金森病模型大鼠因患侧黑质纹状体通路受损而致向健侧产生旋转行为次数明显增多,运动始动性和运动平衡能力明显下降,与文献报道一致[7,10]。表明我们建立的帕金森病大鼠模型可靠。连续给予28烷醇2周后,中剂量组和高剂量组行为学指标均有明显改善,说明28烷醇可以改善模型大鼠的运动功能,具有较好的抗帕金森病药效。
NGF是最早被发现的神经营养因子类物质,对维持神经元的存活、生长、分化以及神经损伤后的修复与神经元再生有十分重要的作用[11-12]。NGF与其高亲和受体TrkA结合于细胞表面后,TrkA磷酸化,形成二聚体。活化的TrkA可介导磷脂酰肌醇-3激酶(PI3-K)/Akt信号通路。激活的Akt通过磷酸化与胞浆和核中其他信号因子相互作用来促进细胞存活并抑制凋亡[13]。
proNGF为NGF前体形式,它可促进NGF的折叠和调节分泌,并根据需要在胞内被蛋白酶水解裂解成NGF;另一面,proNGF与受体p75NTR和sortilin结合,并以高亲和性形成杂合三聚体,启动下游凋亡通路,导致神经细胞死亡[14]。
本研究采用Western印迹法检测帕金森病模型大鼠患侧纹状体内的NGF-TrkA蛋白表达,结果显示,模型组NGF和p-TrkA蛋白表达均降低,提示6-OHDA神经毒性对大鼠脑内NGF介导的细胞存活通路有明显抑制作用;TUNEL染色显示模型大鼠患侧纹状体内出现大量凋亡阳性细胞,推测由于NGF细胞存活信号通路受到抑制,导致纹状体内出现大量神经细胞凋亡;模型组凋亡相关蛋白caspase-3表达水平升高也证实了这一点。
本研究同时发现,中高剂量28烷醇治疗可以减少纹状体内细胞凋亡,NGF、p-TrkA蛋白表达有不同程度上升,对抗6-OHDA的神经毒性作用。
近年来,较多文献认为神经细胞生存或死亡取决于NGF和proNGF的平衡[15-17]。Western印迹结果显示,模型组大鼠纹状体proNGF及下游复合受体sortilin/p75NTR蛋白表达均增高,提示6-OHDA神经毒性可明显提高proNGF及其复合受体sortilin/p75NTR蛋白表达,激活下游细胞凋亡信号通路,这与我们在TUNEL染色和caspase-3蛋白电泳实验中观察到的结果一致。高剂量28烷醇可逆转介导凋亡信号通路的proNGF及其受体sortilin/p75NTR及下游凋亡蛋白caspase-3的过表达。
综合以上实验结果,神经毒素6-OHDA下调NGF及TrkA蛋白表达,同时上调proNGF-sortilin/p75NTR蛋白表达,促进细胞凋亡;而不同剂量28烷醇通过调节proNGF介导的细胞凋亡通路和NGF介导的细胞存活通路,可以部分逆转上述促凋亡效应。
目前国内对神经营养类因子的多数研究只局限于对单一信号通路的观察。例如,对NGF的神经保护研究大多只围绕着NGF及其介导的下游信号通路机制进行阐述,忽视了重要的前体形式proNGF及其受体p75NTR/sortilin在脑内的变化;神经细胞的存活或凋亡,取决于NGF与proNGF[18]及其受体TrkA和p75NTR/sortilin的对比,而不是仅取决于NGF介导的细胞存活通路[15-17]。
本研究阐述28烷醇对6-OHDA致帕金森病大鼠模型的行为学改善作用,探讨28烷醇的神经保护机制与其同时调节NGF介导的细胞存活通路和proNGF介导的细胞凋亡通路相关。为28烷醇应用于抗帕金森病临床药物干预提供了理论依据。
[1]Zhang ZX,Roman GC,Hong Z,et al.Parkinson's disease in China:prevalence in Beijing,Xi'an,and Shanghai[J].Lancet, 2005,365(9459):595-597.
[2]Santos CM.New agents promote neuroprotection in Parkinson's disease models[J].CNS Neurol Disord Drug Targets, 2012,11(4):410-418.
[3]Taylor JC,Rapport L,Lockwood GB.Octacosanol in human health[J].Nutrition,2003,19(2):192-195.
[4]Snider SR.Octacosanol in Parkinsonism[J].Ann Neurol,1984, 16(6):723.
[5]王涛,刘亚静,刘雁勇,等.28醇对6-羟基多巴胺致帕金森病大鼠模型行为学的改善作用[J].中国康复理论与实践,2011,17 (11):1025-1027.
[6]王涛,纪超,黎青,等.帕金森病模型大鼠纹状体内氧化应激与细胞凋亡蛋白的表达[J].中国康复理论与实践,2009,15(5): 431-433.
[7]Allbutt HN,Henderson JM.Use of the narrow beam test in the rat,6-hydroxydopamine model of Parkinson's disease[J].J Neurosci Methods,2007,159(2):195-202.
[8]Ji C,Song C,Aisa HA,et al.Gossypium herbaceam L.extracts ameliorate disequilibrium of IL-1RA/IL-1β ratio to attenuate inflammatory process induced by amyloid β in rats[J].Curr Alzheimer Res,2012,9(8):953-961.
[9]Sierra R,Gonzalez VL,Magraner J.Validation of a gas chromatographic method for determination of fatty alcohols in 10 mg film-coated tablets of policosanol[J].J AOAC Int,2002,85 (3):563-566.
[10]Sleeman IJ,Boshoff EL,Duty S.Fibroblast growth factor-20 protects against dopamine neuron loss in vitro and provides functional protection in the 6-hydroxydopamine-lesioned rat model of Parkinson's disease[J].Neuropharmacology,2012,63 (7):1268-1277.
[11]Lad SP,Neet KE,Mufson EJ.Nerve growth factor:structure, function and therapeutic implications for Alzheimer's disease[J].Curr Drug Targets CNS Neurol Disord,2003,2(5): 315-334.
[12]周宏珍,吕田明,申鹏,等.神经生长因子与丹参对脑缺血再灌注海马神经元的保护作用[J].南方医科大学学报,2011,31 (6):965-969.
[13]Ahn JY,Rong R,Liu X,et al.PIKE/nuclear PI3-kinase signaling mediates the antiapoptotic actions of NGF in the nucleus[J].EMBO J,2004,23(20):3995-4006.
[14]Lee R,Kermani P,Teng KK,et al.Regulation of cell survival by secreted proneurotrophins[J].Science,2001,294(5548): 1945-1948.
[15]Chao MV,Bothwell M.Neurotrophins:to cleave or not to cleave[J].Neuron,2002,33(1):9-12.
[16]Capsoni S,Brandi R,Arisi I,et al.A dual mechanism linking NGF/proNGF imbalance and early inflammation to Alzheimer's disease neurodegeneration in the AD11 anti-NGF mouse model[J].CNS Neurol Disord Drug Targets,2011,10(5): 635-647.
[17]Cekic M,Johnson SJ,Bhatt VH,et al.Progesterone treatment alters neurotrophin/proneurotrophin balance and receptor expression in rats with traumatic brain injury[J].Restor Neurol Neurosci,2012,30(2):115-126.
[18]Tiveron C,Fasulo L,Capsoni S,et al.ProNGFNGF imbalance triggers learning and memory deficits,neurodegeneration and spontaneousepileptic-like dischargesin transgenic mice[J].Cell Death Differ,2013,20(8):1017-1030.
Effects of Octacosanol on Behavioral Impairments and Its Mechanism through Nerve Growth Factor Mediated Pathway in Parkinsonism Rats Induced with 6-hydroxydopamine
WANG Tao,QIAO Hong-wen,LIU Yan-yong,et al.Department of Neurobiology,Beijing Institute of Geriatrics,Xuanwu Hospital,Capital Medical University,Beijing 100053,China
ObjectiveTo investigate the effects of octacosanol on the behavioral changes and its potential mechanism in 6-hydroxydopamine-induced Parkinsonism rats.Methods6-hydroxydopamine-induced Parkinsonism rats accepted octacosanol orally in the dosage of 17.5 mg/kg(low dose),35 mg/kg(medium dose)and 70 mg/kg(high dose)for 2 weeks,and then assessed with rotating test and narrow beam test.The apoptosis cells were counted with TUNEL assay,and the expression of nerve growth factor(NGF),precursor of nerve growth factor(proNGF),as well as their receptors were detected with Western blotting.ResultsThe achievement of behavioral tests significantly improved after administration of octacosanol(P<0.05),with the decrease of the apoptotic cells,more expression of NGF and its receptors TrkA,and less expression of caspase-3,proNGF and its receptors p75NTR and sortilin,especially at the dosage of 70 mg/kg(P<0.05).ConclusionOctacosanol may protect the neurol impairment from 6-hydroxydopamine through NGF mediated pathway to decrease the apoptosis.
Parkinson's disease;nerve growth factor;precursor of nerve growth factor;neuroprotection;apoptosis;rats
R742.5
A
1006-9771(2013)11-1001-05
2013-06-16
2013-08-12)
1.国家973基金项目(No.2010CB934002;No.2011CB504101;No.2011CBA00408);2.国家自然科学基金资助项目(No.81050025);3.神经变性病教育部重点实验室开放课题(No.2012SJBX01);4.北京市脑重大疾病重点实验室开放课题(No.2013NZDJ05)。
1.首都医科大学宣武医院神经生物学研究室,北京市100053;2.中国医学科学院基础医学研究所药理室,北京市100730。作者简介:王涛(1980-),男,汉族,辽宁大连市人,博士,助理研究员,主要研究方向:抗帕金森病新药药效学及机制研究。通讯作者:左萍萍(1950-),女,湖南长沙市人,博士,研究员,博士生导师,主要研究方向:神经药理学。
10.3969/j.issn.1006-9771.2013.11.001

