连接黏附因子-A在乳腺癌中的表达与意义
高 鹏 黄锦宇 鄢德宏 徐莹莹▲
1.中国医科大学附属第一医院乳腺外科,沈阳 110000;2.中国医科大学附属第一医院胃肠肿瘤外科,沈阳 110000;3.辽宁省新民市人民医院外一科,辽宁新民 110300
连接黏附因子(junctional adhesion molecule,JAM)超家族蛋白是一种跨膜蛋白,广泛表达于上皮及内皮细胞的紧密连接处,并在血小板和白细胞等血液细胞表达[1-2]。JAM的生理功能包括保持上皮细胞的极性,维持细胞间黏附,调节上皮细胞的形态,调控细胞迁移等[3-4]。近些年逐渐有文献报道JAM家族中的JAM-A与癌症的发生发展密切相关,并已成为全世界研究的热点。但JAM-A与乳腺癌的关系国内尚无研究,因此本研究采用免疫组织化学方法检测乳腺癌组织中JAM-A的表达并探讨其与临床病理特征和患者预后之间的关系。
1 资料与方法
1.1 一般资料
收集2005年1月~2007年12月中国医科大学附属第一医院肿瘤外科乳腺癌切除标本52例,病理结果均证实为浸润性乳腺癌,所有患者均有完整的临床资料和随访信息。
1.2 主要试剂
JAM-A 抗体(clone 2E3-1C8)购于 Abnova公司(德国)。通用型SABC试剂盒(即用型)、DAB试剂盒均购自武汉博士德有限公司。
1.3 免疫组织化学
组织切片常规脱蜡水化,双氧水阻断内源性酶,缓冲液高压修复,室温冷却30 min,加一抗于湿盒中4℃过夜,加入二抗,置湿盒中37℃ 30 min,加入SABC液于湿盒中30 min,最后加入DAB显色液显色1~2 min,加入苏木素复染液中复染4 min,盐酸乙醇分化,梯度乙醇透明,中性树胶封片。
1.4 染色结果判定
染色结果基于染色强度和阳性细胞比例进行综合评分,具体如下。
1.4.1 染色强度 细胞无染色,0分;细胞呈浅黄色,1分;细胞呈深黄色,2分;细胞呈深棕色,3分。
1.4.2 阳性细胞比例 无阳性细胞表达,0分;阳性表达细胞比例<25%,1分;阳性表达细胞比例介于25%~50%,2分;阳性表达细胞比例介于50%~75%,计3分;阳性表达细胞比例>75%,4分。
上述两种判断标准得分乘积为最终计分结果:<4分为JAM-A阴性表达,≥4分为阳性表达。
1.5 统计学方法
应用SPSS 19.0软件进行数据分析,JAM-A表达与临床资料的关系采用χ2检验,JAM-A阴性表达与JAM-A阳性表达患者的生存采用Kaplan-Miere法描绘,差异性采用Log-Rank检验,以P<0.05为差异有统计学意义。
2 结果
52例患者中,共有16例(30.8%)为JAM-A阳性表达,且均为细胞膜表达。
JAM-A的表达情况与乳腺癌的淋巴结转移和肿瘤大小明显相关,而与雌激素受体(ER)、孕激素受体(PR)、人类表皮生长因子受体2(HER2)无明显相关性,与JAM-A阴性患者相比,JAM-A阳性表达的患者发生淋巴结转移的概率明显减小,较大肿瘤的发生概率亦明显低于JAM-A阴性患者(表1),上述结果表明,JAM-A在乳腺癌的发生、发展中可能起肿瘤抑制因子的作用。
生存分析结果显示,JAM-A阳性患者的5年生存率为93.8%,JAM-A阴性患者的5年生存率为84.9%,两组5年生存率差异无统计学意义(P=0.30)(图1)。
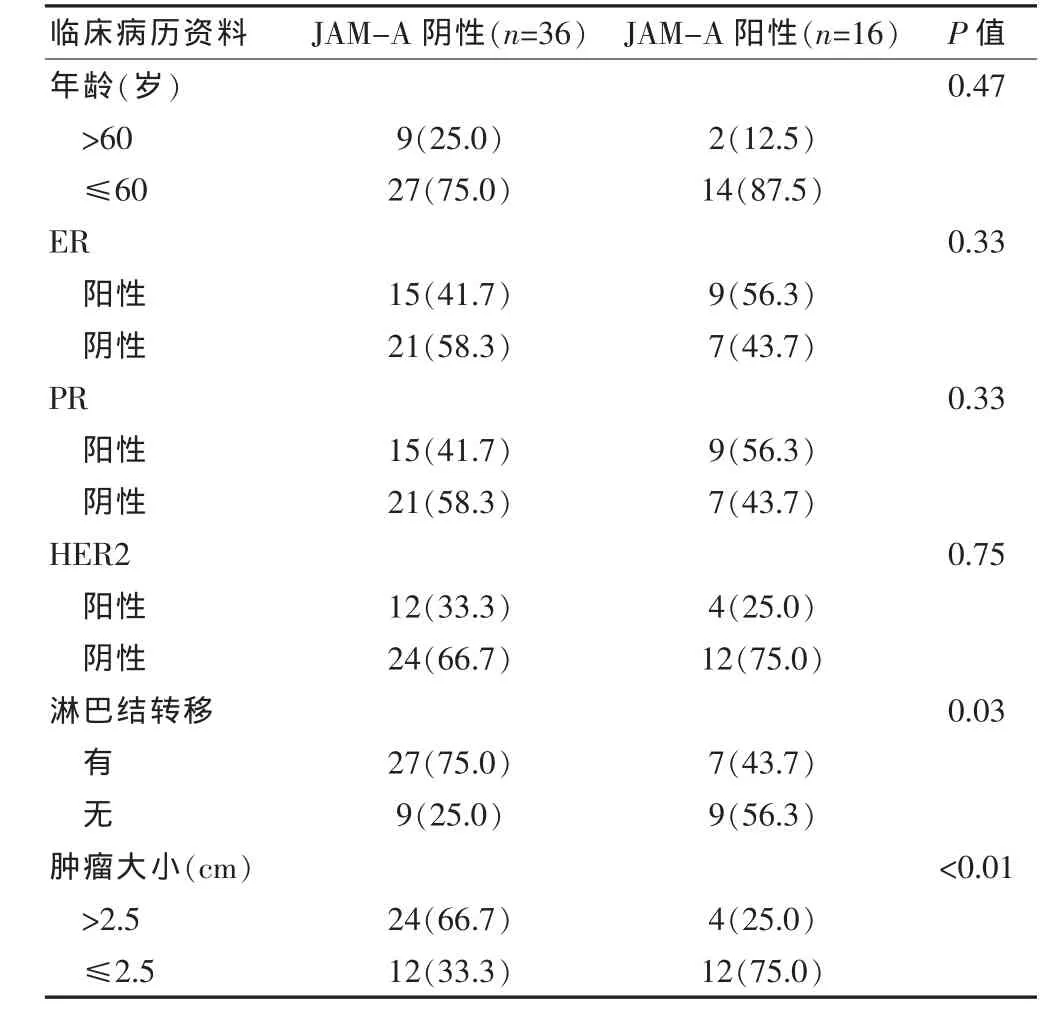
表1 JAM-A表达与临床资料的关系[n(%)]
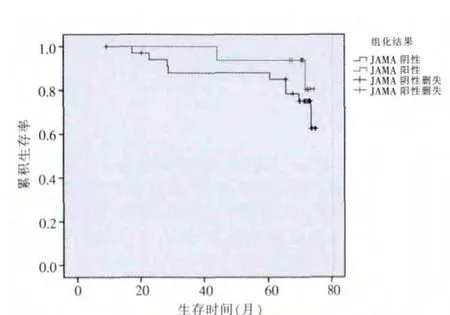
图1 JAM-A阴性表达与JAM-A阳性表达的生存曲线
3 讨论
在多数肿瘤中,JAM-A被认为是肿瘤进展的负调控因子。Gutwein等[5]发现,JAM-A在肾透明细胞癌中的表达明显低于癌旁和正常肾组织,在肾癌细胞系中发现了JAM-A对肿瘤细胞迁徙能力的抑制功能。Fong等[6]利用免疫组织化学技术检测JAM-A在186例胰腺癌组织中的表达情况时发现,JAM-A的表达降低与肿瘤的淋巴结转移,远处转移和肿瘤分期呈明显相关,预后分析显示JAM-A表达有利于肿瘤患者的预后,并且利用多因素证明JAM-A的表达情况是独立的预后因素。Nava等[7]通过体内及体外实验证明,JAM-A能通过同源二聚体的形式抑制肠上皮细胞的增殖能力,并且发现JAM-A是通过抑制Akt/b-catenin通路发挥相应的功能。在黑色素细胞瘤中,Ghislin等[8]发现利用siRNA降低内源性JAM-A表达后,肿瘤细胞的迁徙能力明显增强。
JAM-A在乳腺癌的进展中究竟发挥着怎样的作用一直存在争议。Brennan等[9]在乳腺癌的组织芯片中检测JAM-A的表达情况,发现癌灶中的JAM-A表达明显高于正常乳腺组织,并且乳腺癌中JAM-A的表达与HER2阳性、ER阴性、肿瘤分期明显相关。同样,McSherry等[10]利用乳腺癌组织芯片证明了Brennan的结果,JAM-A的高表达与HER2表达以及TNM分期具有相关性;此外,生存分析显示JAM-A的表达与乳腺癌患者的不良预后相关。McSherry等[11]在一篇研究中发现,JAM-A能够通过调控Rap1 GTPase和β1-integrin来发挥促进乳腺癌细胞迁徙的能力。而G觟tte等[12]的研究证明了JAM-A作为miR-145的下游靶基因,可以介导miR-145对乳腺癌细胞的侵袭和迁徙能力的调控,并得出JAM-A能够增强乳腺癌细胞的迁徙和侵袭能力的结论。与上述研究的结果相反,Naik等[13]在一篇研究JAM-A与乳腺癌关系的研究中指出,JAM-A的表达明显低于癌旁组织,并且在转移灶中表达最低;在乳腺癌细胞系后高表达JAM-A后,肿瘤细胞的运动能力以及侵袭能力大幅度减弱,并认为JAM-A高表达后肿瘤细胞间的紧密连接形成增多是其调控肿瘤细胞迁徙和侵袭的机制。
虽然国际上JAM-A对乳腺癌进展的调控已成为研究热点,但国内尚无此方面研究。为了填补国内这一空白,本研究应用免疫组织化学技术检测JAM-A在乳腺癌组织中的表达情况并探讨它和临床病理和预后的关系。结果表明,JAM-A的表达与淋巴结转移和肿瘤大小呈明显的负相关,JAM-A阳性表达的患者发生淋巴结转移的概率明显减小,较大肿瘤的发生概率亦明显低于JAM-A阴性患者。结果表明,JAM-A在乳腺癌的发生发展中可能起肿瘤抑制因子的作用,这一结果与国外的一篇研究报道结果一致[13]。尽管JAM-A与淋巴结转移和肿瘤大小明显相关,但JAM-A阳性与JAM-A阴性患者的生存差异无统计学意义,认为该结果主要与样本量较小有关,从生存率上可以看出,JAM-A阳性患者的生存要略好于JAM-A阴性患者,因此,本研究推测,如果适当扩大样本量,两组之间的生存差异很可能有统计学意义。
目前JAM-A正引起肿瘤学者的关注,相信随着研究的不断深入,JAM-A可能会成为辅助肿瘤诊断和判断预后的一个标志物,并且可能为肿瘤的治疗提供一个新靶点。
[1]Martìn-Padura I,Lostaglio S,Schneemann M,et al.Junctional adhesion molecule,a novel member of the immunoglobulin superfamily that distributes at intercellular junctions and modulates monocyte transmigration[J].J Cell Biol,1998,142(1):117-127.
[2]Naik UP,Eckfeld K.Junctional adhesion molecule 1 (JAM-1)[J].J Biol Regul Homeost Agents,2003,17(4):341-347.
[3]Liu Y,Nusrat A,Schnell FJ,et al.Human junction adhesion molecule regulates tight junction resealing in epithelia[J].J Cell Sci,2000,113(Pt 13):2363-2374.
[4]Liang TW,DeMarco RA,Mrsny RJ,et al.Characterization of huJAM:evidence for involvement in cell-cell contact and tight junction regulation[J].Am J Physiol Cell Physiol,2000,279(6):C1733-C1743.
[5]Gutwein P,Schramme A,Voss B,et al.Downregulation of junctional adhesion molecule-A is involved in the progression of clear cell renal cell carcinoma[J].Biochem Biophys Res Commun,2009,380(2):387-391.
[6]Fong D,Spizzo G,Mitterer M,et al.Low expression of junctional adhesion molecule A is associated with metastasis and poor survival in pancreatic cancer[J].Ann Surg Oncol,2012,19(13):4330-4336.
[7]Nava P,Capaldo CT,Koch S,et al.JAM-A regulates epithelial proliferation through Akt/β-catenin signalling[J].EMBO Rep,2011,12(4):314-320.
[8]Ghislin S,Obino D,Middendorp S,et al.Junctional adhesion molecules are required for melanoma cell lines transendothelial migration in vitro[J].Pigment Cell Melanoma Res,2011,24(3):504-511.
[9]Brennan K,McSherry EA,Hudson L,et al.Junctional adhesion molecule-A is co-expressed with HER2 in breast tumors and acts as a novel regulator of HER2 protein degradation and signaling[J].Oncogene,2012,32(22):2799-2804.
[10]McSherry EA,McGee SF,Jirstrom K,et al.JAM-A expression positively correlates with poor prognosis in breast cancer patients[J].Int J Cancer,2009,125(6):1343-1351.
[11]McSherry EA,Brennan K,Hudson L,et al.Breast cancer cell migration is regulated through junctional adhesion molecule-A-mediated activation of Rap1 GTPase[J].Breast Cancer Res,2011,13(2):R31.
[12]G觟tte M,Mohr C,Koo CY,et al.miR-145-dependent targeting of junctional adhesion molecule A and modulation of fascin expression are associated with reduced breast cancer cell motility and invasiveness[J].Oncogene,2010,29(50):6569-6580.
[13]Naik MU,Naik TU,Suckow AT,et al.Attenuation of junctional adhesion molecule-A is a contributing factor for breast cancer cell invasion[J].Cancer Res,2008,68(7):2194-2203.

