GnRHa预处理对子宫动脉栓塞术治疗子宫肌瘤临床疗效的影响
金爱红,周霞平,周凤珍
(广东省深圳市第二人民医院妇科, 深圳 518035)
子宫肌瘤(uterine myoma)又称子宫纤维瘤,是女性生殖系统最常见的良性肿瘤[1]。生育年龄期妇女子宫肌瘤发病率为20%~50%,主要表现为子宫出血、疼痛、不孕、流产及肿块压迫症状,是导致子宫切除的主要原因之一,严重影响育龄妇女的身心健康[2]。传统子宫肌瘤治疗方法包括肌瘤挖除术、子宫切除术、药物治疗、肌溶解、冷冻等[3]。1995年Ravina等[4]首先应用子宫动脉栓塞术(uterine artery embolization,UAE)作为手术治疗以外的另一种方法治疗子宫肌瘤,取得比较好的临床效果。内科治疗应用促性腺激素释放激素激动剂(gonadotropin releasing hormone agonist,GnRHa)可以暂时缓解肌瘤症状,缩小肌瘤体积,但长期使用存在着严重的副反应如骨质疏松、低雌激素综合征等,停药后肌瘤又重新长大,症状复发率高,因此单纯采用内科药物治疗也不能取得很好的疗效[5]。本研究通过观察UAE术前GnRHa预处理对子宫肌瘤临床疗效的影响,旨在探索子宫肌瘤治疗的新方案。
1 临床资料
1.1 研究对象
研究对象为2010年5月~2012年12月间于本院就诊的子宫肌瘤患者,均经盆腔妇科检查、彩色超声检查明确诊断。根据以下标准: ①子宫体积大于孕16周且高度怀疑子宫肌瘤恶变患者; ②子宫内膜活检病理为恶性肿瘤及子宫内膜非典型增生患者; ③黏膜下或浆膜下有蒂的肌瘤患者; ④穿刺部位感染或慢性盆腔炎患者;⑤有血管造影的禁忌证 (心、 肝、 肾重要器官功能障碍、 凝血机制异常) 患者; ⑥子宫动脉-静脉瘘患者, 排除UAE治疗禁忌症的患者, 最终共有35名子宫肌瘤患者纳入本研究, 且均自愿接受UAE治疗。根据UAE术前服用GnRHa与否分为GnRHa预处理组及对照组:GnRHa预处理组20例,年龄33~42岁,平均(38.35±6.46)岁;对照组15例,年龄34~45岁,平均(40.35±7.82)岁。本研究经医院伦理委员会批准,所有研究对象均自愿加入并签署知情同意书。
1.2 方法
1.2.1 GnRHa预处理组
GnRHa预处理组受试者 (20例) 在月经后第1 d行阴道超声测量子宫大小、最大肌瘤体积及平均肌瘤体积,并测定血清雌二醇(estradiol, E2)、促卵泡素(follicle-stimulating hormone, FSH)、黄体生成素(luteinizing hormone, LH)和孕酮(progesterone, P)水平。月经后第2 d肌注曲普瑞林醋酸盐(达菲林)治疗,此后两月均在月经后第2 d进行达菲林治疗,共计3次,每次3.75 mg。第3次治疗结束后,在患者月经干净后7~14 d立即行UAE术治疗。术前一天再次测量子宫大小、最大肌瘤体积及平均肌瘤体积, 并测定血清E2、 FSH、 LH和P水平。
1.2.2 对照组
对照组受试者(15例),术前不用任何药物治疗,同在月经干净后7~14 d行UAE术治疗。术前一天测量子宫大小、最大肌瘤体积及平均肌瘤体积,并测定血清E2、FSH、LH和P水平。
1.3 观察指标
GnRHa预处理组每次达菲林治疗结束后均观察药物副反应(骨质疏松及低刺激素综合征等)。GnRHa预处理及对照组UAE术后第3月再次测量子宫大小、最大肌瘤体积及平均肌瘤体积。以上两组中所有患者(35例)均参加以上随访研究,无患者失访。肌瘤体积计算公式=πabc/6(a、b、c分别表示肌瘤在三维的3个切面的直径值);UAE手术前后肌瘤体积缩小率公式:(术前体积-术后体积)/术前体积×100%。
1.4 统计学处理
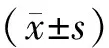
2 结 果
2.1 一般资料比较
GnRHa预处理组和对照组一般情况见表1,组间年龄、子宫大小、最大肌瘤体积、平均肌瘤体积及血清激素水平(E2、FSH、LH及P)比较均无统计学差异(P>0.05)。

表1 两组一般情况及血清激素水平比较
2.2 预处理组GnRHa预处理前后血清激素水平变化及药物副反应
GnRHa预处理组预处理前后血清激素水平变化见表2。GnRHa预处理后血清激素E2、FSH及LH均较预处理前下降, 差异具有统计学意义(P<0.05或P<0.01);但孕酮P水平在GnRHa预处理前后无统计学差异(P>0.05)。
GnRHa预处理后,出现药物副反应症状10例,其中低雌激素症状(潮热、出汗及头晕)5例(25%),失眠2例(10%),性欲减退3例(15%),无一例患者出现明显骨痛症状。所有副反应患者均完成达菲林及UAE术治疗,且UAE术治疗后均恢复正常。
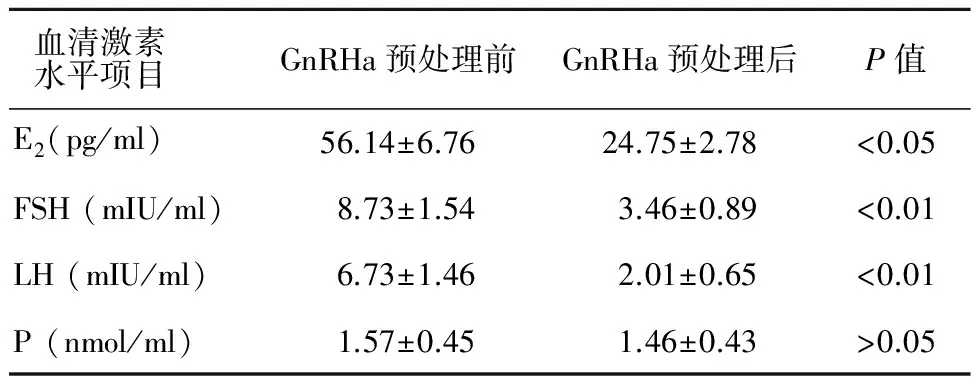
表2 预处理组GnRHa预处理前后血清激素水平变化
2.3 UAE术后肿瘤体积变化
UAE术后两组疗效比较见表3。GnRHa预处理组UAE术后3月子宫缩小率、最大肌瘤体积缩小率及平均肌瘤体积缩小率均显著高于对照组,差异具有统计学意义(P<0.01)。
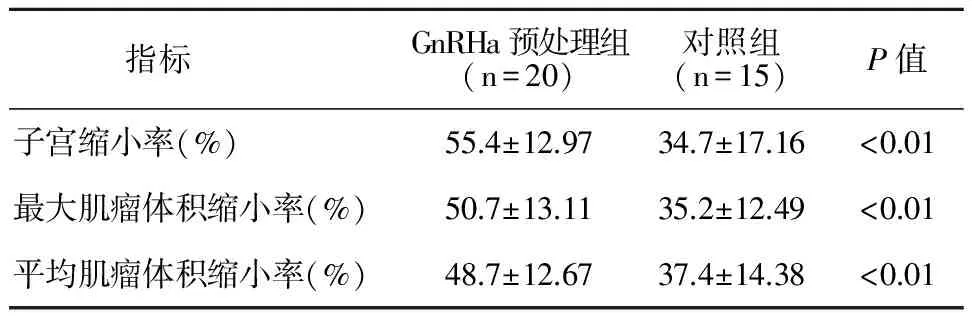
表3 UAE术后两组疗效比较
3 讨 论
子宫肌瘤作为一种良性肿瘤,对雌激素具有依赖性,因而在女性生殖期进行性增大,在更年期以后会受到抑制[6]。除了卵巢之外,一些研究表明子宫肌瘤组织也可以产生一定雌激素,并且在肌瘤中雌激素受体已被承认存在[7]。子宫肌瘤细胞产生的雌激素合成酶以及芳香化酶可将循环中的雄激素转换为雌激素,使得肌瘤组织中雌激素的分泌可达到足够高的浓度,独立于卵巢雌激素的存在,以支持其自身的生长[8,9]。 相对于传统的手术治疗而言,子宫肌瘤的内科治疗相对容易,无手术治疗后的并发症(如盆腔脏器粘连),因而得到了许多妇科医生的关注。此外,子宫肌瘤的内科治疗对于那些想保留生育功能或不愿行手术治疗的患者来说,也是一种不错的选择。内科治疗使用的药物包括雄激素[10]、避孕药(米非司酮)[11]、雌激素受体调节剂(雷洛昔芬)[12]及GnRHa。然而[13],综合考虑治疗效率及药物的安全性后,除了GnRHa,其他药物并没有获得足够的关注度。
GnRHa是下丘脑肽能神经元分泌的肽激素GnRH的类似物,其生物学效应较天然GnRH提高50~100倍。目前研究表明,GnRHa治疗子宫肌瘤的机制主要通过以下几条途径实现:①下调肌瘤中多种生长因子,如转化生长因子β(transforming growth factor beta, TGF-β)、碱性成纤维细胞生长因子(basic fibroblast growth factor, b-FGF)、血小板源性生长因子(platelet-derived growth factor, PDGF)及血管内皮生长因子(vascular endothelial growth factor, VEGF)的表达水平,抑制肿瘤的生长[14];②降低增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)水平,减少肌瘤细胞增殖,促进凋亡增加,导致肌瘤缩小[15]。③通过诱导闭经和卵巢激素分泌减少,导致雌激素减少,使得肌瘤体积减少。然而,使用该治疗方法,通常会导致雌激素减少的症状,包括血管舒缩不稳定,阴道干燥和显著性的骨损失,因而也妨碍了该药物的长期使用[16]。
UAE通过栓塞子宫动脉,阻断子宫肌瘤的血供,使肌瘤局部缺血,进而引起肌瘤凝固性坏死、玻璃样硬化,最终导致肌瘤体积缩小。相对于传统的子宫切除术及肌瘤切除术来说,住院时间短,恢复快,避免了外科手术风险,保留了子宫及生育功能。本研究通过对子宫肌瘤患者UAE术前GnRHa的短暂预处理,发现术后血清激素E2、FSH及LH显著性下降(P<0.05或P<0.01),术后子宫缩小率、最大肌瘤体积缩小率及平均肌瘤体积缩小率均较对照组高(P<0.01),提示术前GnRHa的预处理可以提高UAE的治疗效率,且GnRHa的短暂治疗并没有给患者带来严重的副反应。Kim等[17]的研究表明,大肌瘤UAE术前经GnRHa的预处理,也可显著增加UAE的疗效。此外,王庆一等[18]研究也表明GnRHa对治疗子宫肌瘤是安全有效的药物,但停药后易复发,作为术前或围绝经期用药较为合理。
综上所述,UAE术治疗子宫肌瘤时,术前应用GnRHa可以提高UAE治疗肌瘤的效率,并且相对于内科治疗副作用较小。这种综合介入和内科治疗的子宫肌瘤治疗方案,可能会为探索子宫肌瘤治疗方法提供新的思路。
[参考文献]
[1] Cheng MH, Wang PH. Uterine myoma: a condition amenable to medical therapy?[J]. Expert Opin Emerg Drugs, 2008, 13(1):119-133. doi: 10.1517/14728214.13.1.119.
[2] Wise LA, Radin RG, Palmer JR, et al. Association of intrauterine and early life factors with uterine leiomyomata in black women[J]. Ann Epidemiol, 2012, 22(12):847-854. doi: 10.1016/j.annepidem. 2012.09.006.
[3] Levy G, Hill MJ, Beall S, et al. Leiomyoma: genetics, assisted reproduction, pregnancy and therapeutic advances[J]. J Assist Reprod Genet, 2012, 29(8):703-712. doi: 10.1007/s10815-012-9784-0.
[4] Ravina JH, Herbreteau D, Ciraru-Vigneron N, et al. Arterial embolisation to treat uterine myomata[J]. Lancet, 1995, 346(8976):671-672.
[5] Nakayama M, Mitsuhashi T, Shimizu Y, et al. Pathological evaluation of uterine leiomyomas treated with gonadotropin-releasing hormone agonist (GnRHa) therapy: role of mast cells and a possible mechanism of GnRHa resistance in leiomyomas[J]. Pathol Int, 2008, 58(5):268-274. doi: 10.1111/j.1440-1827.2008.02222.x.
[6] Haney AF. Clinical decision making regarding leiomyomata: what we need in the next millennium[J]. Environ Health Perspect, 2000, 108 Suppl 5:835-839.
[7] Wang L, Huang H, Liu D, et al. Evaluation of 14-3-3 protein family levels and associated receptor expression of estrogen and progesterone in human uterine leiomyomas[J]. Gynecol Endocrinol, 2012, 28(8):665-668. doi: 10.3109/09513590.2012.650768.
[8] Sumitani H, Shozu M, Segawa T, et al. In situ estrogen synthesized by aromatase P450 in uterine leiomyoma cells promotes cell growth probably via an autocrine/intracrine mechanism[J]. Endocrinology, 2000, 141(10):3852-3861.
[9] Bulun SE, Imir G, Utsunomiya H, et al. Aromatase in endometriosis and uterine leiomyomata[J]. J Steroid Biochem Mol Biol, 2005, 95(1-5):57-62.
[10] Islam MS, Protic O, Giannubilo SR, et al. Uterine leiomyoma: available medical treatments and new possible therapeutic options[J]. J Clin Endocrinol Metab, 2013, 98(3):921-934. doi: 10.1210/jc.2012-3237.
[11] De Leo V, Morgante G, La Marca A, et al. A benefit-risk assessment of medical treatment for uterine leiomyomas[J]. Drug Saf, 2002, 25(11):759-779.
[12] Palomba S, Orio F Jr, Morelli M, et al. Raloxifene administration in premenopausal women with uterine leiomyomas: a pilot study[J]. J Clin Endocrinol Metab, 2002, 87(8):3603-3608.
[13] Parsanezhad ME, Azmoon M, Alborzi S, et al. A randomized, controlled clinical trial comparing the effects of aromatase inhibitor (letrozole) and gonadotropin-releasing hormone agonist (triptorelin) on uterine leiomyoma volume and hormonal status[J]. Fertil Steril, 2010, 93(1):192-198. doi: 10.1016/j.fertnstert.2008.09.064.
[14] Chegini N, Kornberg L. Gonadotropin releasing hormone analogue therapy alters signal transduction pathways involving mitogen-activated protein and focal adhesion kinases in leiomyoma[J]. J Soc Gynecol Investig, 2003, 10(1):21-26.
[15] Bifulco G, Miele C, Pellicano M, et al. Molecular mechanisms involved in GnRH analogue-related apoptosis for uterine leiomyomas[J]. Mol Hum Reprod, 2004, 10(1):43-48.
[16] Khan KN, Kitajima M, Hiraki K, et al. Changes in tissue inflammation, angiogenesis and apoptosis in endometriosis, adenomyosis and uterine myoma after GnRH agonist therapy[J]. Hum Reprod, 2010, 25(3):642-653. doi: 10.1093/humrep/dep437.
[17] Kim MD, Lee M, Lee MS, et al. Uterine artery embolization of large fibroids: comparative study of procedure with and without pretreatment gonadotropin-releasing hormone agonists[J]. AJR Am J Roentgenol, 2012, 199(2):441-446. doi: 10.2214/AJR.11.7220.
[18] 王庆一, 李敏. 米非司酮与长效GnRHa治疗子宫肌瘤的疗效观察[J].中国实用妇科与产科杂志,2002,18(6):361-363.

