不同预处理及发芽床对红豆草种子萌发的影响
史 毅,马晖玲
(甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
红豆草(Onobrychis viciaefolia)为豆科红豆属多年生植物,营养丰富、适口性好,可青饲和调制干草,是干旱、半干旱地区重要的豆科牧草,也可用作低产饲料地改良的先锋作物[1,2]。
种子是牧草生产最基本的生产资料,其发芽率的高低直接影响牧草的生产性能。在以往的研究中[3],发芽率低、硬实率高成为影响豆科牧草种子质量评价的主要因素。红豆草作为优质的豆科牧草,其茎叶茂盛,草质柔嫩,营养丰富,各类家畜均喜食,青饲家畜不得臌胀病,但一些品种常常被评价为发芽率低、发霉率高[4]。即使同一品种的红豆草,由于收获时间、种子在植株上着生部位、贮藏时间乃至形态、颜色不同其发芽率也存在差异[5]。目前,在提高红豆草种子发芽率的研究中,机械处理因其操作即时简便且效果明显常被采用[6];温水浸种能改善种皮透性,使坚硬的种皮变得柔软,提高种胚破皮率,能有效提高发芽率[7];阿地力等[9]认为,剥去红豆草的种皮可使发芽率比无处理的对照组提高10%,高温处理可使红豆草发芽率提高15%~17%。化学试剂处理具有去除萌发抑制的物质、增强种子吸水性能等作用,从而达到提高种子发芽率[3]。包桂荣等[9]认为低浓度 NaCl、Na2CO3盐溶液浸泡可提高红豆草发芽率。发芽床材料也是影响种子发芽能力的一大因素[8,10],阿地力等[8]利用沙布、脱脂棉作为发芽床,种子发芽率最高,其次是沙床、纸床。现有研究均采取单一方法和发芽床,试验采用机械处理,温水浸种和化学试剂处理3种方法,通过滤纸床,沙床和毛巾床3种发芽床进行红豆草种子发芽研究,以期为提高红豆草种子发芽率提供更为全面的依据。
1 材料和方法
1.1 试验材料
供试红豆草种子为甘肃红豆草,2012年购于甘肃省农业科学院,常规发芽率40%,硬实率32%。选择籽粒饱满的种子为试验材料。
1.2 试验方法
1.2.1 种子预处理 机械处理 (1)剥去种皮用清水浸泡1h后,用单面刀片和尖头镊子在不伤及种胚情况下完全剥去种皮备用[8];(2)碾磨处理 用100#砂纸轻轻摩擦至种皮表面有破损,失去光泽,用放大镜观察种子表面有明显的划痕而不损伤种胚为止,然后,用净水冲洗净备用[11]。
温水浸种 分别用30,40和50℃温水浸泡,浸泡时用玻璃棒不断搅拌,待水温接近室温时,静置24h后置床[7]。
化学试剂处理 分别用30%H2O2和98%H2SO4浸泡种子5,10和15min。处理时先将种子放入烧杯,然后,加入相应浓度的化学试剂至浸没种子,并用玻璃棒不断搅拌至预定时间后迅速倒入盛大量蒸馏水的烧杯并及时搅拌,去除上清液,再加入蒸馏水冲洗种子至pH 7.0,最后用滤纸吸干种子表面水分备用[3,6]。不做任何处理的种子为对照(ck)。
1.2.2 发芽床种类 滤纸床采用双层滤纸铺于培养皿经过121℃高温湿热灭菌26min;沙床用细河沙经121℃高温湿热灭菌26min后,铺于灭菌的培养皿中[10];毛巾床用单层白毛巾剪成培养皿大小的圆形铺于培养皿经过121℃高温湿热灭菌26min[4]。
1.2.3 置床 将处理好的种子置于湿润的发芽床上,每处理3次重复,每个重复50粒种子,于20℃,16h光照,湿度为50%培养箱中培养,经常检查加水,使发芽床保持湿润。发芽期间记录每天发芽种子数,以种子露白作为发芽标准[14],第7d统计发芽势,第14d统计发芽率,计算发芽指数。
发芽势/%=第7d种子萌发数/供试种子数×100%
发芽率/%=第14d种子萌发数/供试种子数×100%
发霉率/%=第14d种子发霉数/供试种子数×100
硬实率/%=第14d未萌发种子数/供试种子数×100
发芽指数GI=∑Gt/Dt
式中:Dt—置床之日算起的日数;Gt—相应各日的正常发芽数[13]。
对照和处理的种子均置于滤纸发芽床上进行发芽试验。选取不同处理方法中发芽率较高的处理组比较不同发芽床对发芽率的影响。
1.3 数据分析
采用SPSS 19.0进行数据统计分析,多重比较采用Duncan方法。
2 结果与分析
2.1 机械处理对红豆草种子萌发的影响
与对照相比,不同的机械处理均能显著提高红豆草种子在滤纸发芽床的发芽率(表1)。其中,2种机械处理方法中,剥去种皮对提高红豆草种子发芽率的效果较好,其发芽率可达57.7%,高出对照组17.4%,但发芽势不及碾磨处理,发芽指数比碾磨处理低7.76%。2种方法均降低了种子硬实率,且剥去种皮种子的发霉率比碾磨处理低15%。有此可见,剥去种皮可有效提高红豆草种子发芽率,碾磨处理次之。

表1 机械处理下红豆草种子的萌发Table 1 Effects of mechanical treatment on seed germination of Onobrychis viciifolia
2.2 温水浸种对红豆草种子萌发的影响
与对照相比,温水处理后红豆草种子发芽势、发芽率及发芽指数均有不同程度的提高且均达到显著水平(P<0.05)。随着处理温度的升高,种子发芽率呈上升趋势,50℃温水处理的发芽率最高,达到50.0%,发芽指数达45.72,比对照高15.53%,且发霉率最低(5.3%),比对照低25.4%。但温水处理提高了种子硬实率,50℃温水处理种子的硬实率最高,达45.7%,较对照高13.4个百分点。研究表明,温水处理能有效提高种子发芽率,降低种子发霉率的同时会提高种子硬实率(表2)。
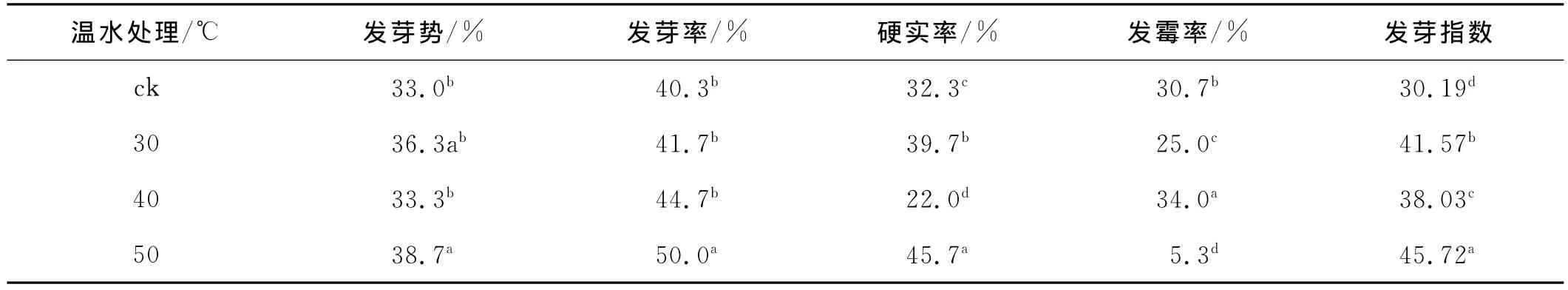
表2 温水浸种下红豆草种子的萌发Table 2 Effects of warm water soaking on seed germination of Onobrychis viciifolia
2.3 H2O2和H2SO4处理对红豆草种子萌发的影响
结果表明,随处理时间的延长,红豆草种子发芽率、发芽势和发芽指数均降低(表3)。H2O2和H2SO4处理15min,发芽势分别降至18.3%和6.0%,发芽率分别降至19.7%和7.7%,比对照低20.6%和32.6%。H2O210min,种子发霉率较对照降低12.4%,说明H2O2浸种处理不适用于提高红豆草种子发芽率,但可用于种子消毒以降低发霉率。而H2SO4浸种15min发霉率为56.3%,比对照提高25.6%,因此,98%H2SO4浸种不适于提高红豆草种子的萌发。
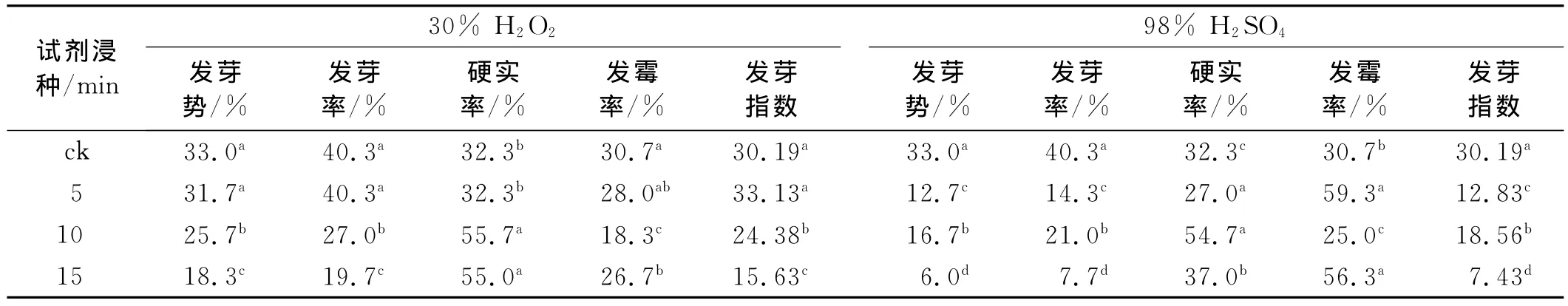
表3 H2O2和H2SO4浸种对红豆草种子萌发的影响Table 3 Effects of chemical reagent soaking on seed germination of Onobrychis viciifolia
2.4 不同发芽床对红豆草种子萌发的影响
3种发芽床对ck,去种皮处理和50℃温水浸种处理种子萌发的效应为沙床< 滤纸床< 毛巾床(表4),毛巾床的发芽势、发芽率以及发芽指数均显著高于滤纸床和沙床。去种皮和50℃温水浸种发芽率分别达到66.3%和63%,分别比滤纸床高8.6%和13%,较ck高26%和22.7%。发芽指数也有不同程度提高。其中,毛巾床的硬实率显著低于滤纸床和沙床,ck最低为17.0%,发霉率也有所下降。试验结果表明,毛巾床最适合红豆草种子的萌发。

表4 不同发芽床对红豆草种子萌发的影响Table 4 Effects of different germination bed on seed germinating of Onobrychis viciifolia
3 讨论与结论
3.1 机械处理对红豆草种子萌发的影响
剥去种皮,碾磨处理等常规简便的方法能有效提高种子的发芽率,降低硬实率,使难发芽的种子正常发芽[6]。试验采取2种机械处理方法均提高了红豆草种子的发芽率,降低了硬实率。其中,剥去种皮效果最佳,发芽势、发芽率和发芽指数均有显著提高,这与很多关于种子发芽试验的研究结果较为一致[6,8,15]。同时剥去种皮即去掉了种皮上可能携带的霉菌,发霉率降低。但剥去种皮操作相对困难,剥皮过程中操作不当会切去种胚,导致发芽率降低,达不到预期效果。
3.2 温水浸种对红豆草种子萌发的影响
试验设3个温度梯度,均不同程度提高了红豆草种子发芽率,并有效降低了发霉率。其中,50℃温水浸种处理效果最佳,且发霉率在所有处理中最低值,这与朱秀梅等[4]的研究结论相一致。但温水浸种提高了硬实率,由于温水浸种除去了部分硬实种表面的霉菌,从而造成更多的发霉种变为硬实种,进而提高了硬实率。结果表明,温水浸种对红豆草种子发芽能力有显著的提高。
3.3 H2O2和H2SO4对红豆草种子萌发的影响
试验表明,30%H2O2和浓H2SO4浸种均不同程度降低红豆草种子发芽势、发芽率及发芽指数,这与红豆草种皮薄有关,强氧化性溶液会浸透种皮,伤及胚乳或胚芽,降低了发芽能力,这与梁应林等[16]的研究结果相一致。H2O2溶液浸种可降低红豆草种子发霉率,说明H2O2溶液短时间浸泡可用于红豆草种子的消毒处理。而H2SO4溶液反而会较大幅度提高种子发霉率,其原因有待进一步研究。
3.4 不同发芽床对红豆草种子萌发的影响
不同发芽床对种子发芽能力有很大的影响。试验以沙、滤纸和毛巾为发芽床材料,选择2种发芽能力效果显著的种子处理方法和对照组进行比较,其中,2种处理方法和对照组在沙上的发芽效果不如滤纸床,分析原因可能是沙床水分保持在下部,上方与种子接触部分水分不足且接触面积小,使得发芽率减低[17,18]。毛巾床能显著提高3组红豆草种子的发芽势、发芽率和发芽指数,这与朱秀梅等[4]的研究结论相一致。并且毛巾床可降低种子硬实率,效果最好。
种子发芽率的高低直接影响到红豆草的生产性,研究表明,去种皮的红豆草种子不仅能显著提高发芽率,降低硬实率,并且能除去种皮表面的霉菌,降低发霉率,但剥皮操作较困难,不可伤及种胚。50℃温水浸种可显著提高红豆草种子发芽率,降低发霉率,且方法简便易行。H2O2溶液浸种可作为种子消毒剂使用。在发芽床的选用上,毛巾床可显著提高红豆草种子发芽率,降低硬实率。因此,建议在生产中可采用50℃温水浸种+H2O2溶液短时漂洗消毒+毛巾床置床,能提高红豆草种子发芽率,降低霉变率。
[1]陈宝书.红豆草[M].甘肃:甘肃科学技术出版社,1992.
[2]孙守琢.优质牧草—红豆草的优良特性[J].饲料博览,1995,26(1):26.
[3]赵小社,毕玉芬,许岳飞,等.不同处理方法对3种豆科灌木种子发芽率的影响[J].草原与草坪,2006(2):37-40.
[4]朱秀梅,赵永卫.红豆草种子发芽试验中防止种子霉烂的探讨[J].新疆畜牧业,2007(6):28-29.
[5]牛连杰.浅析种子发生硬实的原因及影响硬实形成的因素[J].种子世界,2004(9):32.
[6]陶茸,师尚礼,李玉珠,等.种子处理对扁蓿豆种子在1/2MS培养基上发芽率的影响[J].草原与草坪,2011,31(3):69-72.
[7]朱宇旌,刘艳.牧草种子休眠解除方法综述[J].草业科学,2003,20(3):24-27.
[8]阿地力,何剑.红豆草种子发芽条件及预处方法的探讨[J].新疆畜牧业,1999(4):34.
[9]包桂荣,乌日汗,宝布仁其其格,等.不同盐分对红豆草种子萌发的影响[J].内蒙古民族大学学报,2010,25(6):640-642.
[10]文西强,文云书,陈忠文,等.发芽床对豆薯种子发芽及幼苗生长的影响[J].种子科技,2007(2):43-44.
[11]李玉玲,徐成体.不同处理方法对青藏扁蓿豆种子发芽率的影响[J].青海畜牧兽医杂志,2007,37(3):20-21.
[12]王彦雕,张勇,陈年来,等.酸碱处理对不同条件贮藏的2种白刺种子萌发的影响[J].甘肃农业大学学报,2013,48(1):97-101.
[13]岑爱华,耿红.不同处理对萝卜种子发芽的影响[J].中国园艺文摘,2012(10):1-2.
[14]罗瑛,吴开永,刘国道.不同处理对银合欢种子发芽率的影响[J].安徽农业科学,2009,37(13):6227-6228,6231.
[15]刘开业,陆肇伦,杨烈.不同外源激素处理对狗牙根种子发芽的影响[J].草原与草坪,2011,31(5):26-29.
[16]梁应林,邓蓉,张定红,等.硫酸处理对饲用灌木及小冠花红豆草种子发芽率的影响[J].草业与畜牧,2011(9):25-27.
[17]俞靓,程积民,万惠娥.聚乙二醇和低温胁迫对红豆草种子萌发影响的研究[J].水土保持通报,2008,28(6):115-117.
[18]赵相勇,孟军江,吴佳海.不同处理方法对野生地八角硬实种子发芽率的影响[J].贵州农业科学,2012,40(3):48-50.

