毛细管电泳法对乳及乳制品中乳源蛋白的测定
田兰,陈春丽,马晓丽,孟磊,热娜·卡斯木
(新疆医科大学药学院,新疆乌鲁木齐830011)
乳及乳制品具有较高的营养价值,是人体获取蛋白质的重要途径。近年来,国内乳制品掺假现象严重,如三聚氰胺、皮革水解蛋白等非法物质的添加,严重损害消费者的利益和健康。国家制定的常规检验方法,不能将乳品中掺入的非乳蛋白区别检测。因此,从乳制品的特征性成分——乳源蛋白出发,对其进行定性定量表征,并由此对乳及乳制品在生产、流通、储存各个环节的质量品质进行分析、评价,控制,对于乳品行业的良性发展具有重要的意义[1]。
鲜牛乳含有3.0%~3.5%蛋白质,其中80%的为酪蛋白(CN),15%为乳清蛋白。酪蛋白分别为:α-酪蛋白(α-CN),β-酪蛋白(β-CN),k-酪蛋白(k-CN),乳清蛋白是在牛乳清液中,此类蛋白质主要是α-乳白蛋白(α-La)和 β-乳球蛋白(β-Lg)。乳蛋白由于遗传和非遗传的多态性以及应用的加工处理方法,使它们的定量测定变得十分复杂。毛细管电泳使分析化学得以从微升水平进入纳升水平,并使单细胞分析,乃至单分子分析成为可能。长期困扰我们的生物大分子如蛋白质的分离分析也因此有了新的转机。高效毛细管电泳技术因其高效、快速、微量、经济、自动化等优点被广泛应用于蛋白的分析[2-5]。
1 材料与方法
1.1 材料与仪器
P/ACE MDQ毛细管电泳仪:Beckman公司(配有紫外检测器);聚乙烯醇涂层毛细管柱:Beckman公司(65 cm×50 μm I.D.,有效长度 47 cm);PB- Satorius普及型10pH计:赛托利斯科学仪器(北京)有限公司;MS3 basic涡旋振荡器:德国IKA;Milli-Q Advantage A10超纯水仪:美国密理博;TGL-16G离心机:上海菲恰尔分析仪器有限公司;KQ-3200DV型数控超声清洗器:昆山市超声仪器有限公司。
α-乳白蛋白(α-La),β-乳球蛋白(β-Lg),α-酪蛋白(α-CN),β-酪蛋白(β-CN),k-酪蛋白(k-CN)标准品:Sigma公司;羟丙基甲基纤维素(HPMC):进口分装;DL-二硫苏糖醇(DTT)生物试剂:Merk;三羟甲基胺基甲烷(Tris):上海蓝季科技发展有限公司,柠檬酸,柠檬酸钠,尿素,磷酸、氢氧化钠均为分析纯;
原料乳取自本地某乳品生产厂家,市售鲜奶购自本地集市,其它样品均购自本地超市。
1.2 方法
1.2.1 实验条件
1.2.1.1 运行缓冲液制备
准确称取0.295 4 g柠檬酸钠,0.156 g二硫代苏糖醇(DTT),2.0111g三羟甲基胺基甲烷(Tris),置于100mL容量瓶中,加入6 mol/L尿素溶液75 mL,用H3PO4调节pH至8.0,置于冰箱中备用。
1.2.1.2 样品缓冲液制备
准确称取4.208 3 g柠檬酸,0.582 8,g柠檬酸钠,0.05%羟丙基甲基纤维素,置于100 mL容量瓶中,加入6 mol/L尿素溶液75 mL,用1 mol/L NaOH调节pH至3.0,备用。
1.2.1.3 操作条件
分离电压20 kV;压力进样0.5 psi,时间5 s;柱温:40℃;紫外检测波长:214 nm;毛细管两次进样之间用水冲洗5 min,柠檬酸缓冲液冲洗5 min,在1 min时自动调零。
1.2.2 样品处理
1.2.2.1 原料乳、液态奶样品的配制
将样品与样品缓冲溶液按1∶4(体积比)的比例混合,室温下放置1 h,10 000 r/min离心,取清液,用0.45 μm的滤膜过滤后直接进样。
1.2.2.2 酸奶样品
称取0.4 g酸奶,,加样品缓冲溶液约1.6 mL,至离心管2 mL处,混合,室温下放置1 h,10 000 r/min离心,取清液,用0.45 μm的滤膜过滤后直接进样。
1.2.2.3 奶粉样品的准备
称取1 g奶粉,溶于10 mL水中,超声振荡使其充分溶解平衡。将样品溶液与样品缓冲溶液按1∶4(体积比)的比例混合,室温下放置1 h,10 000 r/min离心,取清夜,用0.45 μm的滤膜过滤后直接进样。
1.2.3 标准溶液的配制
分别配制 α-La 、β-Lg、α-CN、β-CN、k-CN 的标准储备液:15、20、30、40、20 mg/mL,并置于冰箱中保存。上述标准溶液均同样经样品缓冲液处理后进样。
2 结果与讨论
2.1 方法学考察
2.1.1 线性范围
在1.2.1.3操作条件下,五种蛋白标准品高效毛细管电泳图谱如图1所示。
以5种标准蛋白的峰面积的峰面积为纵坐标,以标样的浓度为横坐标,绘制标准曲线,并利用最小二阶乘法进行线性回归,得到各蛋白的线性范围、回归方程及相关系数,结果如表1所示。
2.1.2 精密度


表1 方法的分析特征Table 1 Analytical characteristics of the method
取同一样品溶液,在1.2.1.3操作条件下,连续进样6次,测定进样精密度;取不同浓度的三份样品(三种浓度样品中5种蛋白总含量分别为31.41 mg/mL,21.96 mg/mL和328.54 mg/g进行测定,记录色谱峰面积,计算进样峰面积,得RSD结果如表2所示。

表2 乳蛋白的精密度Table 2 Precision of milk proteins
2.1.3 回收率
精密量取适量液态奶样品,平行取12份,3份空白,其余9分别加入低中高3种浓度的标准品溶液,按1.2.2.1方法处理,在1.2.1.3操作条件下测定,加标回收率测定结果如表3所示。
2.1.4 稳定性
2.1.4.1 测试稳定性
将样品按1.2.2.1项下方法处理之后,在0、12、24、36、40、48、60、64、68、72 h 按 1.2.1.3 操作条件测定测定,结果如表4所示。
结果显示,样品处理完之后需在64h内完成测定。
2.1.4.2 储存稳定性
将样品置于4℃冰箱保存,分别于24、36、48、72 h按项下进行样品处理,测定,并考察于-18℃保存24 h情况,结果如表5所示。
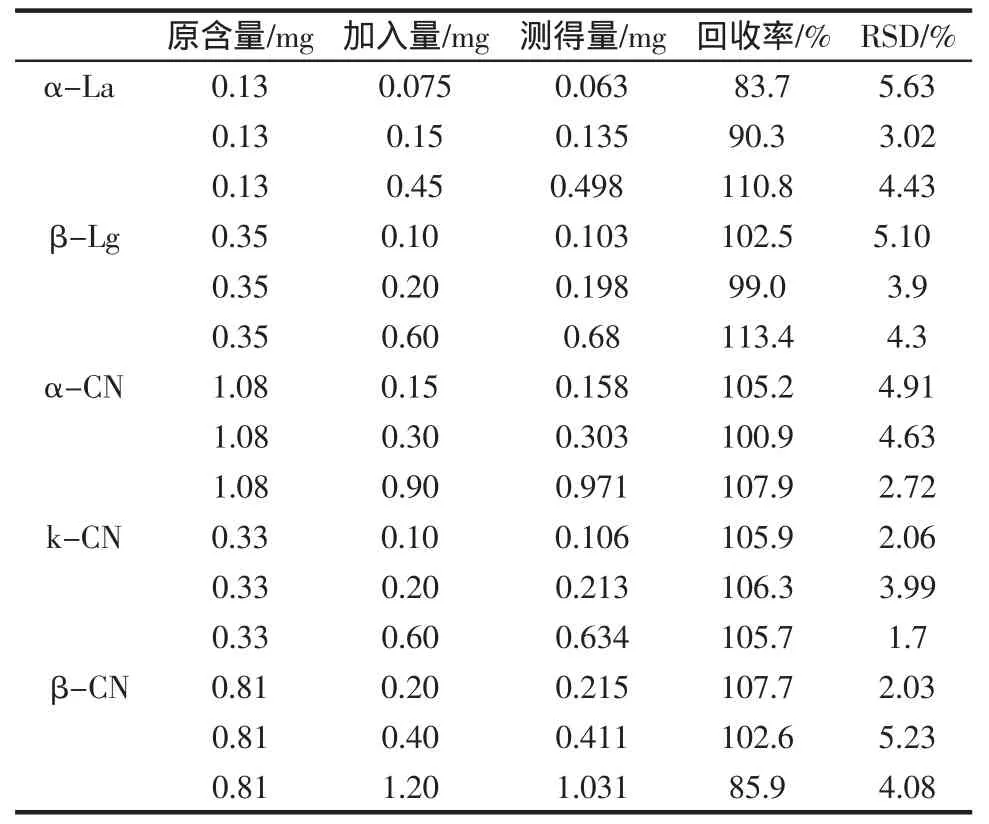
表3 乳蛋白的加标回收率(n=3)Table 3 Recoveries of the method

表4 乳蛋白测试稳定性Table 4 Stability of milk protein during testing
结果显示,样品可在4℃冰箱中保存72 h测定,不适合在-18℃冰箱中存储。
2.2 样品测定
分别取液态奶、酸奶和奶粉样品,按1.2.2.1项下方法处理之后,在1.2.1.3操作条件下测定,液态奶样品、酸奶样品及奶粉样品测定所得图谱如图2、图3、图4所示,结果如表6所示。
从表6的结果可以看出,本高效毛细管电泳测定方法测得5种蛋白总量的结果与样品包装标示量结果相符。
3 结论
1)本方法适用于液态奶、液态乳制品、酸奶及奶粉中乳蛋白的分析研究。
2)在对各种样品的测定中发现,各样品除了蛋白含量不同,图谱也有差异,可以结合乳制品形态、奶源、乳牛喂养、产地、加工工艺等各方面对原料乳及乳制品的进行品质控制。也可以借鉴中药指纹图谱的分析方法,为原料乳及乳制品建立相应的乳蛋白图谱,并进行更为深入透彻的解析。

表5 乳蛋白储存稳定性Table 5 Storing stability of milk protein
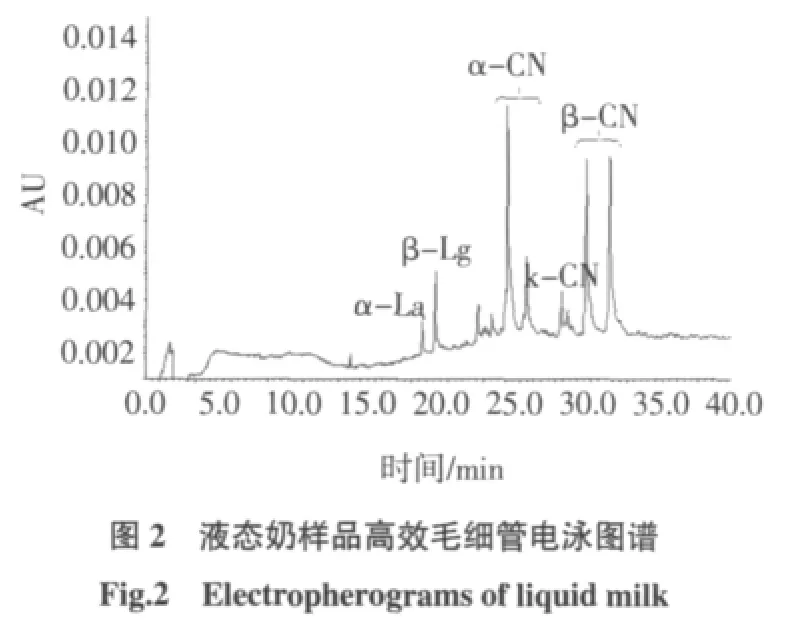
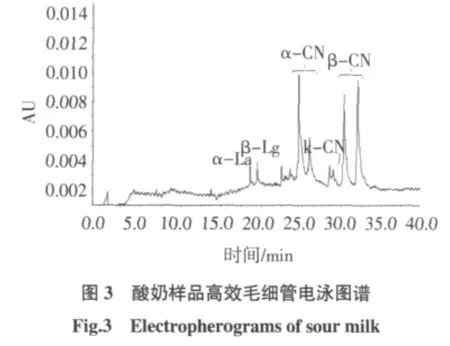
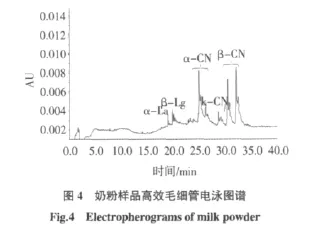
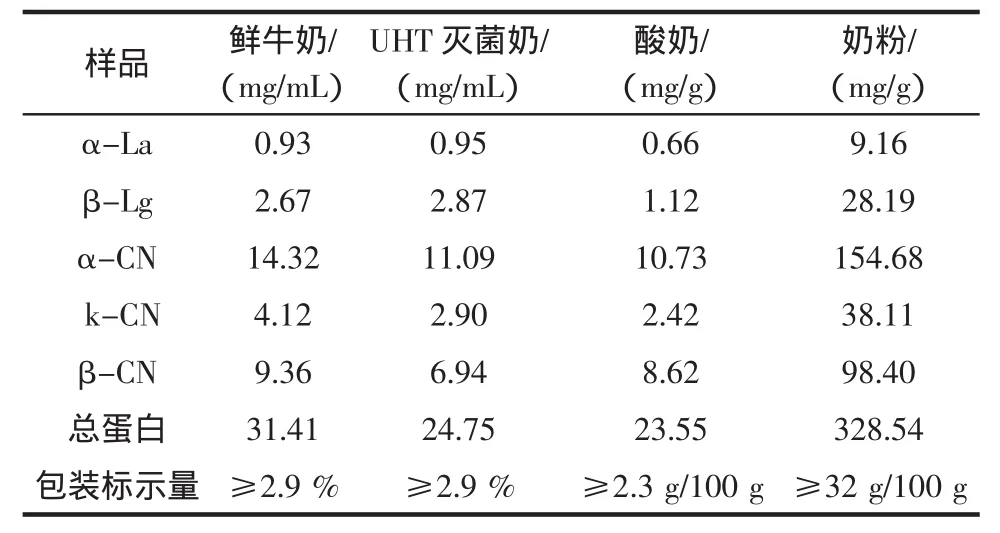
表6 乳及乳制品中乳蛋白含量测定Table 6 Samples determination of milk and milk products
3)本高效毛细管电泳方法与较为常用的分析手段高效液相(HPLC)法相比,HPLC法主要测定乳品中氨基酸的含量,该方法前处理方法简单(不需要衍生),溶剂消耗低,简单易行。但高效毛细管电泳测定乳蛋白需要使用涂层毛细管柱,价格较高,使用寿命有限(约200份样品,bekman工程师提供信息),5种乳蛋白的价格也较高。从方法学数据可以看出,高效毛细管电泳测定蛋白质含量的精密度、重现性、准确度与高效液相色谱的常规测试中RSD<2%相比,有一定差距,毛细管电泳技术的局限及蛋白质的特性限制了高效毛细管电泳在蛋白测定中的应用。
[1] 宋宏新,柏红梅,薛海燕,等.基于乳源蛋白质分析的乳品质量检测技术探讨[J].食品工业科技,2008,29(9):298-301
[2] 李春,刘丽波,刘宁.毛细管电泳技术评价乳制品质量的研究[J].食品工业科技,2008,29(5):288-290
[3] Patrick Clement,Samson O Agboolab,Roberta Bencini.A study of polymorphism in milk proteins from local and imported dairy sheep in Australia by capillary electrophoresis[J].LWT,2006,39(1):63-69
[4] J M L Heck,C Oliemanb,A Schenninkc,et al.Estimation of variation in concentration,hosphorylation and geneticpolymorphism of milk proteins using capillary zone electrophoresis[J].International Dairy Journal,2008,18(5):548-555
[5] 刘婷,姜金斗,刘宁.毛细管电泳检测奶粉中添加的大豆分离蛋白[J].分析科学学报,2008,24(1):37-41

