草菇TPI基因的克隆、结构及其在同核、异核菌株中的表达量
刘朋虎,邓优锦,江玉姬,谢宝贵
(1.福建农林大学菌物研究中心;2.福建农林大学国家菌草工程技术研究中心,福建福州350002)
食用菌是一种可供人类食用的大型真菌的统称,俗称“蘑菇”.经过近30年的发展,我国成为世界上最大的食用菌栽培、加工、贸易及消费的国家[1].在我国目前可人工栽培的近30种食用菌中,草菇(Volvariella volvacea)产量居第8位[2],具有很高的经济价值.草菇不仅味道鲜美、营养丰富且医药价值较高[3-4],深受人们喜爱.但目前对于草菇遗传的理论研究,却一直没有取得突破性的进展,限制了其产业发展.
磷酸丙糖异构酶(triosephosphate isomerase,TPI)可以催化磷酸二羟丙酮与3-磷酸甘油醛之间的可逆反应,是糖酵解途径中的一种酶,同时也在脂肪酸合成、糖原异生和戊糖途径中发挥重要作用[5-6].TPI活力与糖异生、葡萄糖分解有关,故与细胞能量供应有着密切的联系.研究TPI基因结构及表达量的变化,可以深入了解草菇的能量供应系统,为草菇分子育种提供理论依据.
本试验采用新一代Solexa测序技术,对草菇基因组、转录组、表达谱进行测序.根据基因组测序结果设计引物,克隆了两个草菇单孢菌株中的TPI基因,共线性分析了两个菌株中TPI基因的序列;同时利用转录组测序转录组读段反向定位于基因组,对TPI基因结构进行分析;利用表达谱信息,对两个单孢菌株及杂交后代异核菌株中TPI基因的表达量进行了研究,并采用实时荧光定量PCR技术进一步验证了该基因的表达.目前,国内外尚未见草菇TPI基因的相关报道.
1 材料与方法
1.1 供试菌株
供试菌株为PYd21、PYd15、H15-21,均来自福建农林大学菌物研究中心的菌种保藏中心.PYd21、PYd15为从福建主栽品种屏优一号(PY)分离的单孢菌株,两个菌株的形态不正常,不能出菇;H15-21为PYd21、PYd15配对杂交获得的异核菌株,菌丝形态正常,可以出菇.
1.2 基因组、转录组、表达谱的测序
委托深圳华大基因研究院对PYd21基因组从头测序,测序完成后进行组装并采用Genemark-ES(Version 2.3)基因预测软件[7]进行基因注释[8];对 PYd15、PYd21、H15-21 的菌丝体进行数字基因表达谱测序,测序参照王海英[9]的方法;分别提取8个样品(PYd15、PYd21、H15-21的菌丝体,H15-21出菇后的原基、钮扣期菌柄、蛋形期菌柄、伸长期菌柄和成熟期菌柄)的mRNA,将mRNA等量混合物进行转录组测序,参考 Zhang et al[10]的方法进行测序.
1.3 TPI基因的克隆及共线性分析
为验证PYd21基因组测序及组装结果,根据基因注释TPI基因序列用Primer Premier 5设计引物(引物序列 F:5'-GACCTTTGCTTTCGCTCAT-3';R:5'-CAGTACACTTTTCCCTTTCTTTA-3'),克隆了PYd21、PYd15中的TPI基因.用DNAMAN(Version 5.2.2)软件将克隆结果与基因组测序结果进行比对.
1.4 TPI基因结构分析
以基因组测序中PYd21的TPI基因分别向上、下游引物各延伸1000 bp作为参考序列,用Zoom Lite(1.5.4)软件[11]对转录组测序读段进行定位,并对定位结果进行配对末端分析,确定基因转录起始、终止位点,内含子位点,可变剪接位点.去除内含子序列后,将TPI基因序列提交美国国立生物信息中心(NCBI)网站的开放阅读框寻觅器(ORF Finder),确定基因的开放阅读框(ORF),并将其翻译成氨基酸序列在NCBI蛋白质数据库中进行蛋白质同源性比对.
1.5 TPI基因表达量分析
统计3个菌株数字基因表达谱中TPI基因的标准表达量,来表示TPI基因在3个菌株中的表达量.具体方法:以TPI基因序列为参照序列,用Zoom软件对表达标签库进行定位,获得TPI基因的表达标签,用CodonCode Aligner软件[12]分析表达标签序列和草菇基因组的序列,如果是唯一在TPI基因上定位,则选用,如果在多个基因上定位,则去除该标签.统计能唯一在TPI基因序列上定位的标签种类及其数量,然后进行标准化处理.标准化方法[13]:每百万个标签中唯一定位到该基因的标签数(transcript per million,TPM)=唯一定位在TPI基因上的标签数×106/该样本中的总标签数.
1.6 实时荧光定量PCR分析TPI基因的表达
用TRIzol总RNA提取试剂盒提取草菇RNA,用AMV First Strand cDNA Synthesis Kit(BBI)合成cDNA第一链,将反转录得到的cDNA稀释10倍作为模板进行检测.实时荧光定量PCR采用定量试剂SybrGreen PCR Master Mix(2×)(美国ABI公司),选用StepOnePlusTM型荧光定量PCR仪(美国ABI公司).用Primer Premier 5.0软件根据基因外显子区设计引物,内参基因为18S rRNA(表1).
PCR 反应体系:10 μL SybrGreen PCR Master Mix(2 ×)、上下游引物(10 μmol·L-1)各1 μL、1 μL 模板、7 μL ddH2O,合计20 μL.反应程序:95 ℃预变性10 min;95 ℃变性15 s,60 ℃复性1 min,40 个循环.每个反应做3次重复.以PYd21中TPI基因的表达量为参比,用Livak et al[14]的方法计算基因的相对表达量.
2 结果与分析
2.1 TPI基因的克隆与共线性
PYd21中TPI基因注释结果表明,TPI基因位于Scaffold 25上456379-457393 bp位点之间,全长1015 bp.根据此序列设计引物对单孢菌株 PYd21、PYd15进行 PCR扩增,并对PCR产物进行回收、测序(上海生工生物工程有限公司),测序结果应用DNAMAN(Version 5.2.2)软件进行比对.序列比对结果表明,基因克隆测序结果与基因组测序结果一致,且PYd21、PYd15中TPI基因的序列一致.表明PYd21中TPI基因组的测序、组装结果可靠,且PYd21、PYd15中的TPI基因无多态性.

表1 用于扩增TPI基因和18S rRNA内参基因的实时荧光定量PCR引物Table 1 primer pairs for amplifying TPI and 18S rRNA genes
2.2 TPI的结构
从基因组中提取包括TPI基因及其上、下游各1000 bp的序列,以之为参照序列,应用Zoom软件对转录组测序读段进行定位和配对末端分析.结果表明,TPI基因的全长为1015 bp,与 GeneMark-ES(Version 2.3)软件基因注释结果一致.Zoom软件分析结果还表明,TPI基因(GenBank登陆号:JQ478424)有6个外显子和5个内含子(表2),其中第4个内含子符合“GC-AG”法则,其余均符合“GT-AG”法则,第4个内含子比基因注释少54 bp,其余内含子的预测结果与转录组的分析结果一致.对TPI基因可变剪接位点进行分析的结果表明,在RNA加工过程中存在内含子保留和可变3'端剪切位点两种可变剪切类型,共有两个可变剪切位点(图1).将内含子切除后的基因序列提交NCBI,利用开放阅读框寻觅器确定其ORF,TPI基因ORF全长756 bp,编码251个氨基酸.将基因序列翻译成氨基酸序列进行NCBI BLASP比对,结果表明,TPI基因氨基酸序列与双色蜡蘑(Laccaria bicolor)(XP 001879541.1)、灰盖鬼伞(Coprinopsis cinerea)(XP 001835145.1)的覆盖度均为 100%,一致性均为73%,E 值分别1e-137,2e-137.
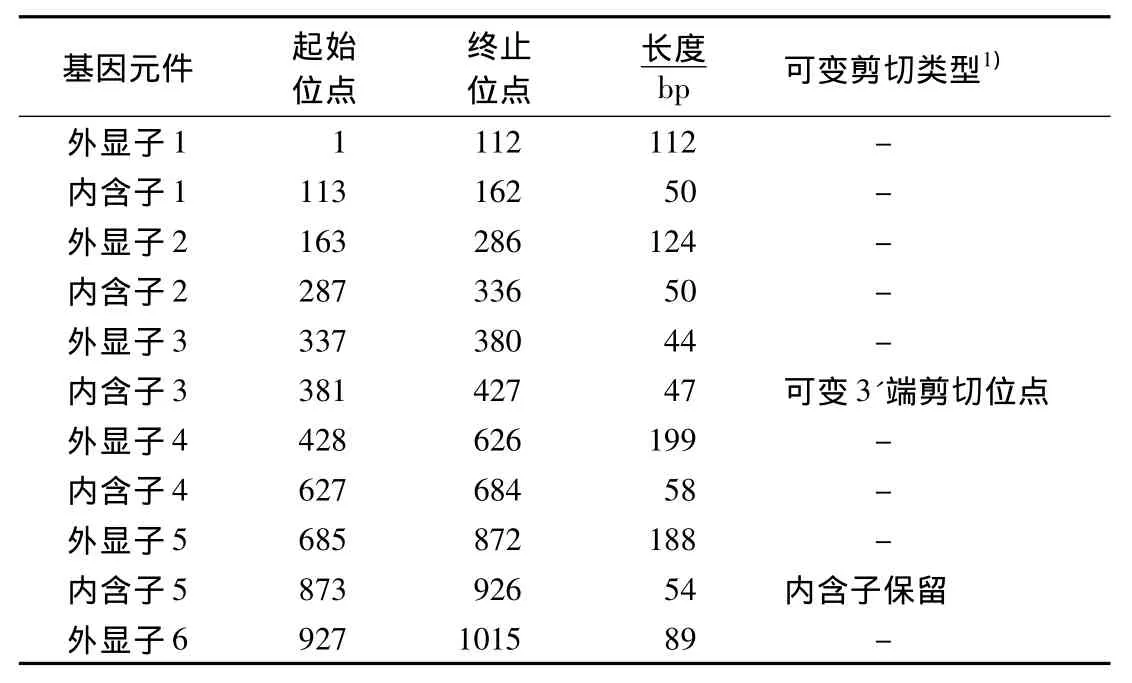
表2 TPI基因的组成Table 2 TPI gene components
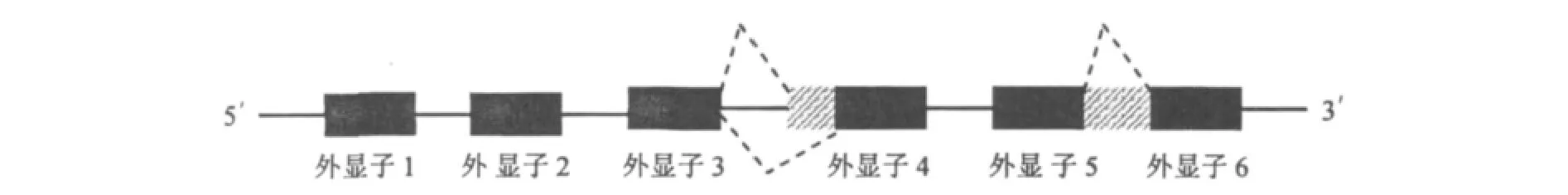
图1 TPI基因结构Fig.1 TPI gene model
2.3 TPI基因的表达量
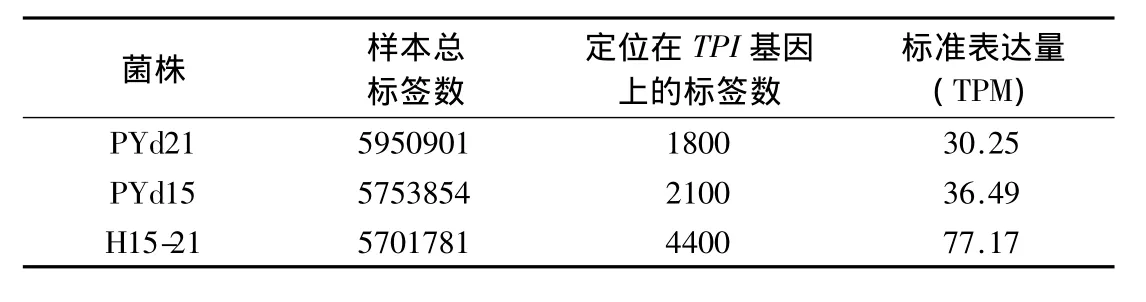
表3 TPI基因表达谱的表达量Table 3 Analysis of TPI gene expression
PYd21、PYd15 和 H15-21 菌丝的表达谱标签库分别在TPI序列上进行定位分析,获得1个在草菇基因组上唯一定位在TPI基因上的标签,统计其拷贝数(表3).以数据标准化后的TPM进行3个菌株TPI基因表达量比较的结果显示,异核菌株H15-21的表达量(TPM)远远高于单孢菌株,也高于两个单孢菌株表达量之和,表明异核菌株TPI基因的表达不是简单的加性效应,而具有异核体表达协同增效作用.为了验证表达谱测序的结果,采用实时荧光定量PCR来测定TPI基因的表达量.以18S rRNA为内参基因,以PYd21为参比进行TPI基因表达的相对定量分析,检测结果(表4)与表达谱的测序结果一致,进一步证实了异核体表达协同增效作用的存在.
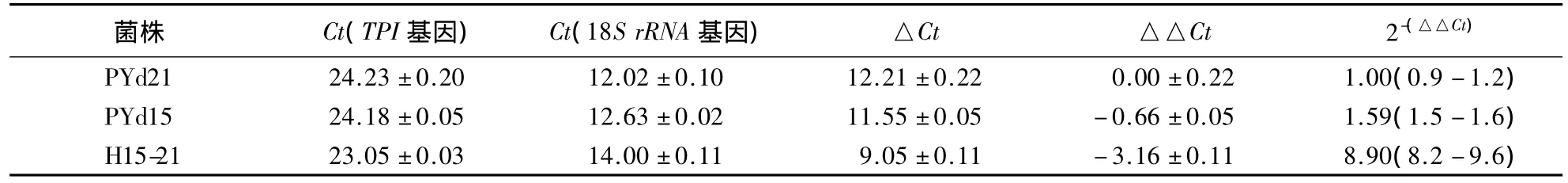
表4 TPI基因实时荧光定量PCR的相对表达量1)Table 4 TPI gene expression levels as determined by real-time quantitative PCR
3 讨论
TPI在自然界中分布广泛,几乎存在于所有的高等动、植物和微生物中.TPI缺乏会引起人类疾病[15].在血吸虫的研究中,作为非常有前景的用于制备寄生虫疫苗的候选抗原之一而受到血吸虫病疫苗研究者的关注[5].在草菇中,还没有TPI基因克隆及结构方面的报道.TPI基因在进化上比较保守,是良好的研究生物分子进化的材料[16].本试验中,草菇TPI基因的氨基酸序列与双色腊磨、灰盖鬼伞的同源性都很高,表明草菇TPI基因也具有很高的保守性.
多种因素都可导致基因的差异表达,研究生物体不同组织、不同细胞之间差异表达的基因具有重要的生物学意义.基因芯片首先使在整个转录组水平高通量鉴别基因的差异表达成为可能,并产生了重要的信息.但现在越来越多的研究者倾向用RNA直接测序的方法来研究转录组水平(RNA-seq)[17].有数据表明,RNA-seq比基因芯片更加灵敏可靠[18].本试验经过实时荧光定量PCR验证,表明基因数字表达谱数据是可靠的.
不同草菇单孢菌株之间的菌丝生长速度、菌落形态差异较大,这可能与菌丝的能量代谢有密切关系.TPI(EC 5.3.1.1)是糖酵解中一种重要的酶,对于糖酵解有效能量的生成是必需的.本试验中,作为亲本的单孢菌株PYd21、PYd15菌丝的生长速度慢,TPI基因的表达量也偏低;而杂交异核菌株H15-21菌丝的生长速度快,TPI基因的表达量高于两个亲本,TPI基因的表达量与菌丝生长呈正相关.由此推测,TPI基因表达量的增加使得菌丝体获取能量的能力增强,从而具有更快的生长速度.从表达量上看,H15-21表达量还高于两个单孢菌株之和,即在异核杂交菌株H15-21中,两种细胞核存在相互作用,可以产生协同增效作用.在以前的研究中,笔者发现草菇糖酵解中的葡萄糖-6-磷酸异构酶基因[19]和磷酸甘油酸变位酶基因[20]也存在这种异核体表达协同增效作用,故初步推测这种现状具有普遍性.如果这种机制具有普遍性,将有助于解释草菇生活史为何以异核体为主.
[1]福建省食用菌学会.福建省食用菌学科发展研究报告[J].海峡科学,2011,49(1):56-65.
[2]张金霞.中国食用菌产业科学与发展[M].北京:中国农业出版社,2009:47.
[3]AHLAWAT O P,SINGH R,KUMAR S.Evaluation of Volvariella volvacea strains for yield and diseases/insect-pests resistance using composted substrate of paddy straw and cotton mill wastes[J].Indian J Microbiol,2011,51(2):200 -205.
[4]WU J Y,CHEN C H,CHANG W H,et al.Anti-cancer effects of protein extracts from Calvatia lilacina,Pleurotus ostreatus and Volvariella volvacea[J].Evidence-based Complementary and Alternative Medicine,2011,89(3):303 -315.
[5]魏佳,徐梅倩,何国声,等.土耳其斯坦东毕吸虫磷酸丙糖异构酶基因的克隆及在毕赤酵母中的表达[J].中国兽医科学,2006,36(8):634 -638.
[6]周君,徐剑,相入丽,等.蜜蜂磷酸丙糖异构酶基因(AmTpi)全长cDNA的电子克隆及其验证[J].福建农林大学学报:自然科学版,2009,38(2):154 -159.
[7]TER-HOVHANNISYAN V,LOMSADZE A,CHERNOFF Y O,et al.Gene prediction in novel fungal genomes using an ab initio algorithm with unsupervised training[J].Genome Research,2008,18(12):1979 -1990.
[8]章小寅.草菇基因组测序及遗传连锁图构建[D].福州:福建农林大学,2010:24-27.
[9]王海英.草菇不同发育时期菌柄基因表达谱差异初步分析[D].福州:福建农林大学,2010:47-49.
[10]ZHANG G,GUO G,HU X,et al.Deep RNA sequencing at single base-pair resolution reveals high complexity of rice trnscriptome[J].Genome Research,2010,20(5):646 -654.
[11]LIN H,ZHANG Z,ZHANG M Q,et al.ZOOM!Zillions of oligos mapped[J].Bioinformatics,2008,24(21):2431 -2437.
[12]MORRISSY A S,MORIN R D,DELANEY A,et al.Next-generation tag sequencing for cancer gene expression profiling[J].Genome Research,2009,19(10):1825 -1835.
[13]CROTTINI A,DORDEL J,KÖHLER J,et al.A multilocus phylogeny of malagasy scincid lizards elucidatesthe relationships of the fossorial genera Androngo and Cryptoscincus[J].Molecular Phylogenetics and Evolution,2009,53(1):345 -350.
[14]LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△Ctmethod [J].Methods,2001,25:402 -408.
[15]刘江红,石毅,周筠梅.磷酸丙糖异构酶的折叠及稳定性研究[J].生物化学与生物物理进展,2006,33(5):465-472.
[16]RONIMUS R S,MORQAN H W.Distribution and phylogenies of enzymes of the Embden-Meyerhof-Parnas pathway from archaea and hyperthermophilic bacteria support a gluconeogenic origin of metabolism[J].Archaea,2003,1(3):199 -221.
[17]MALONE J H,OLIVER B.Microarrays,deep sequencing and the true measure of the transcriotome[J].BMC Biology,2011,9:34.
[18]THOEN P A,ARIUREK Y,THYGESEN H H,et al.Deep sequencing-based expression anaysis shows major advances in robustness,resolution and inter-lab portability over five microarray platforms[J].Nucleic Acid Res,2008,36:e141.
[19]刘朋虎,谢宝贵,邓优锦,等.草菇gpi基因结构及其异核体表达协同增效作用[J].食用菌学报,2011,18(4):1-5.
[20]刘朋虎,邓优锦,江玉姬,等.草菇PGAM基因克隆、结构及其在同核、异核菌株中的表达量分析[J].福建农业学报,2012,27(3):252 -256.

