采用荧光光谱法研究烟酸与牛血清白蛋白的相互作用
蔡向阳,谢勇平,蔡碧琼,郑新宇,李清禄
(福建农林大学生命科学学院,福建福州350002)
烟酸(nicotinic acid,NTA)是人体必需的13种维生素之一,已被广泛用于治疗由于低密度脂蛋白胆固醇(LDL-C)增多和高密度脂蛋白胆固醇(HDL-C)减少所导致的血脂异常[1],也是冠心病治疗史上第一个显示出可以减少该病死亡率的药物[2].血清白蛋白是人和动物体内血浆中含量最丰富的蛋白质,它不仅是维持血浆渗透压的主要力量,在生理上还参与多种内源、外源性物质(如药物和激素等)的存储和转运,使药物等到达受体部位发挥作用.
目前,研究药物等有机小分子与生物大分子的结合是药物动力学及临床药理学的重要内容[3].在NTA的药理学研究中,人们普遍关注NTA受体及抗脂解作用的生物学机制,忽略了NTA与其受体结合的化学热力学过程的研究.本试验采用荧光光谱法研究NTA与牛血清白蛋白(bovine serum albumin,BSA)的相互作用,并计算两者的结合常数(KA)、结合位点数(n)等,其结果对了解NTA在体内与受体结合、迁移和分布有重要的参考价值.
1 材料与方法
1.1 材料
仪器有Varian cary eclipse荧光分光光度计(美国瓦里安公司)、Cary-50紫外可见分光光度计(美国瓦里安公司)、pB-10数字显示酸度计(德国Sartorius集团)、SYC-15超级恒温槽(南京桑力电子设备厂).试剂有 NTA 标准溶液(1.0 ×10-2mol·L-1)、BSA 标准溶液(2.00 ×10-5mol·L-1)、NaH2PO4-Na2HPO4(pH 7.40)缓冲液,其他试剂均为分析纯,试验用水均为二次蒸馏水.
1.2 方法
1.2.1 NTA与BSA作用后的荧光光谱扫描 在8个10 mL的容量瓶中,各加入2 mL 20.0 μmol·L-1BSA标准溶液,再分别加入不同浓度的NTA溶液,用NaH2PO4-Na2HPO4缓冲液定容,摇匀,在测定温度(T)下恒温4 h.固定激发波长280 nm,激发狭缝5 nm,发射狭缝5 nm,扫描300-400 nm的荧光发射光谱.扫描完毕后,将波长差分别固定在15和60 nm,扫描BSA的同步荧光光谱,重复测定3次.
1.2.2 NTA-BSA的紫外—可见光谱扫描 分别稀释BSA和NTA至浓度为4.00 μmol·L-1,并对同浓度的NTA-BSA混合液分别进行240-400 nm的紫外—可见光谱扫描.
2 结果与分析
2.1 NTA与BSA作用后的荧光光谱
固定BSA的浓度,加入NTA,以激发波长(λex)为280 nm扫描体系的荧光光谱.图1显示:NTA对BSA的内源性荧光起到猝灭作用;随着NTA浓度的逐渐增大,BSA中的色氨酸在350 nm附近的荧光发射峰的强度呈递降趋势[4].可见,NTA与BSA之间发生了相互作用.
荧光猝灭可分为动态猝灭、静态猝灭等,且受温度的影响较大.温度升高,分子的热运动强度增大,碰撞频率提高,促进内源性荧光发生动态猝灭;温度降低,则有利于药物分子与蛋白质结合.不管是动态猝灭还是静态猝灭,其过程都可用 Stern-Volmer方程[4]进行描述,即:
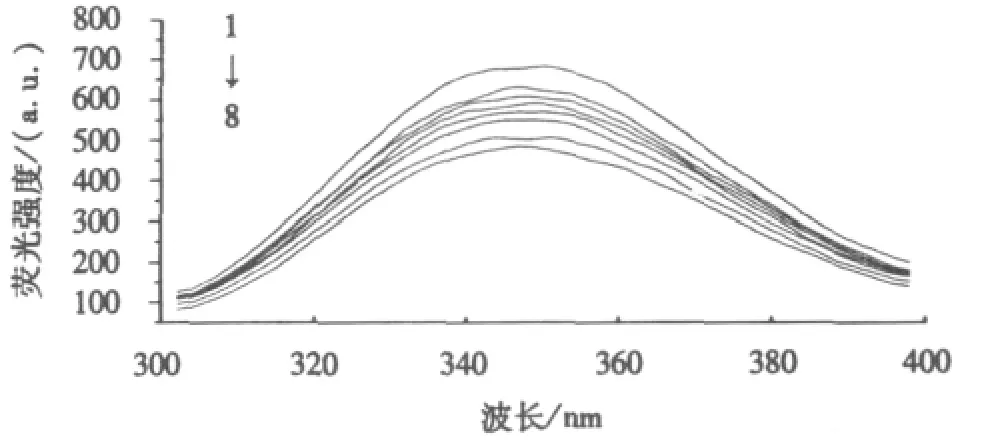
图1 NTA与BSA相互作用的荧光光谱图Fig.1 Fluorescencent spectra of NTA-BSA system

(1)式中,F0和F分别为猝灭剂Q加入前、后的荧光强度,Kq为双分子猝灭过程的速率常数,Ksv为动态猝灭常数,τ0为猝灭剂不存在时荧光体分子的平均寿命(约为10-8s)[6],CQ为猝灭剂的浓度.根据(1)式求出猝灭过程的Kq和Ksv(表1).

表1 NTA-BSA体系的Stern-Volmer方程1)Table 1 Stern-Volmer equations of NTA-BSA system
为阐明其猝灭机制,绘制出不同温度下BSA与NTA相互作用的Stern-Volmer线.从图2可以看出,F0/F与NTA浓度呈良好的线性关系,且随着NTA浓度的增加而增大;温度升高,斜率变大,即Ksv变大.Wang et al[7]认为:对于动态猝灭,Ksv随着温度的升高而增大;对于静态猝灭,则温度的升高使猝灭常数减小.可见,NTA与BSA的猝灭效应属于动态猝灭机理.
2.2 NTA与BSA相互作用的KA和n
药物小分子与蛋白质大分子的相互作用通常用KA和n来描述[8].NTA与BSA相互作用的KA和n采用Lineweaver-Burk方程计算:

根据(2)式作lg[(F0-F)/F]与lgCQ双对数曲线,拟合后的结果见图3.由图3可见,lg[(F0-F)/F]与lgCQ呈良好的线性关系,温度升高,斜率变大,且变化趋势同图2的结果一致.
根据图3拟合得到的Lineweaver-Burk方程求出NTA与BSA作用的KA和n(表2).
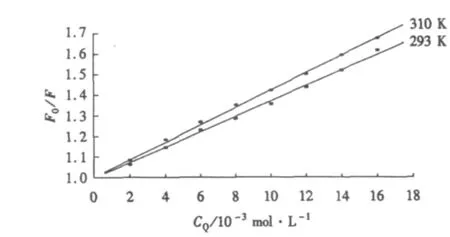
图2 NTA对BSA荧光猝灭作用的Stern-Volmer线Fig.2 Stern-Volmer lines of BSA quenched by NTA
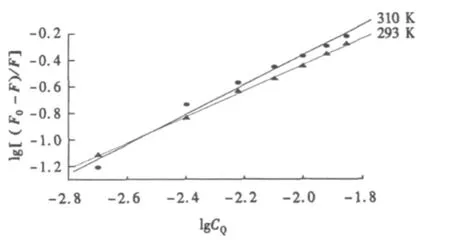
图3 NTA对BSA荧光猝灭作用的Lineweaver-Burk线Fig.3 Lineweaver-Burk lines of BSA quenched by NTA

表2 NTA与BSA的KA和nTable 2 Binding constants and binding sites of BSA-NTA
由表2可知:NTA与BSA之间的KA较小,表明作用较弱,分子间大致可形成一个结合位点;两者的结合受到温度的影响较为显著.在试验温度范围内,其KA随着温度的升高有所增大.
2.3 NTA与BSA相互作用力的热力学参数
在温度变化不大时,反应的焓变(ΔH)可以看作一个常数,根据Van't Hoff等压方程(3)可以求出NTA与BSA结合反应的ΔH.

根据(4)式可求出NTA与BSA结合反应的吉布斯自由能变(ΔG)和熵变(ΔS).

求得的NTA与BSA结合反应的热力学参数见表3.
根据ΔH和ΔS的相对大小,可以判断药物与蛋白质之间的主要作用力类型[10].由表3可知:NTA与 BSA结合反应的 ΔH>0,ΔS>0,表明NTA与BSA之间主要以疏水作用力相结合[11];ΔG<0表明NTA与BSA在常温下具有自发结合的趋势,温度升高,ΔG变得更负,表明温度升高结合的趋势增强,这与KA随着温度的升高而增大的结果一致.

表3 NTA与BSA结合反应的热力学参数Table 3 Thermodynamic parameters of interaction between NTA and BSA
2.4 NTA对BSA构象的影响
固定激发波长和发射波长差(Δλ)分别为15和60 nm,即分别对应蛋白质中酪氨酸和色氨酸残基的光谱特征[9],扫描同步荧光光谱,以分析蛋白质构象的变化.由图4可知,随着NTA浓度的增加,虽然BSA的同步荧光强度逐渐减弱,但最大发射峰的峰形和峰位均基本不变.表明NTA的加入并没有影响BSA的构象.
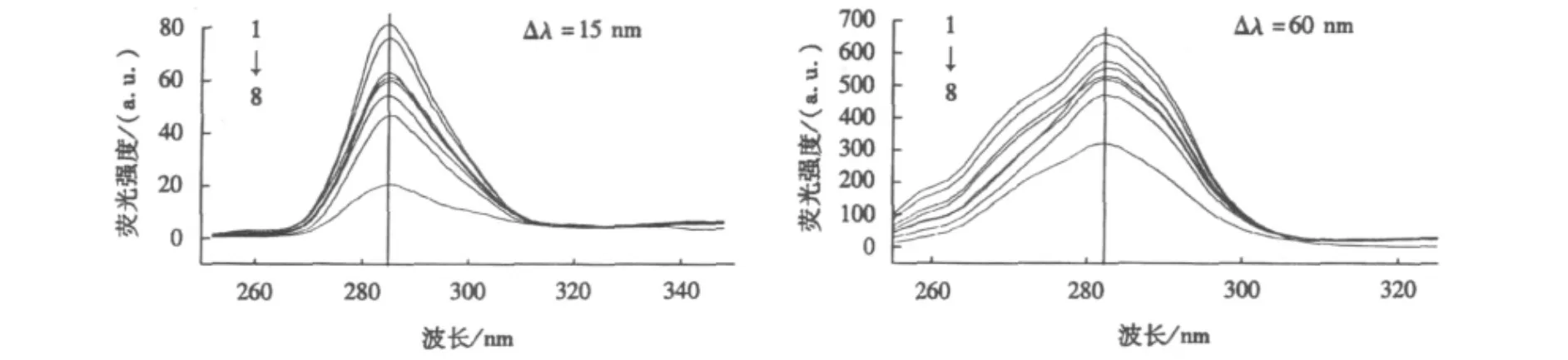
图4 NTA的与BSA相互作用的恒波长同步荧光光谱Fig.4 Constant wavelength synchronous fluorescence spectra of NTA-BSA
2.5 NTA与BSA作用的紫外吸收光谱
分别测定浓度为4.00×10-6mol·L-1的BSA、NTA和NTA-BSA混合液的紫外吸收光谱,结果如图5、6所示.将NTA、BSA紫外吸收光谱的叠加线与NTA-BSA混合液的紫外吸收光谱对比,紫外吸收峰的峰形与峰位基本不变,这表明NTA的加入并未使BSA的紫外吸收发生变化.药物对BSA的荧光猝灭是由于它与BSA的激发态分子发生了相互作用,即猝灭机理为动态猝灭.
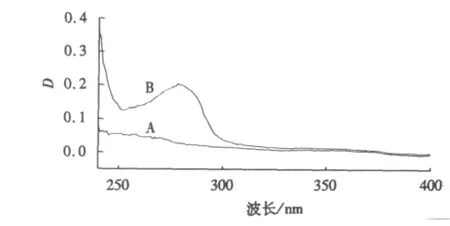
图5 NTA、BSA的紫外吸收光谱Fig.5 Ultraviolet-vis spectrometry of NTA and BSA
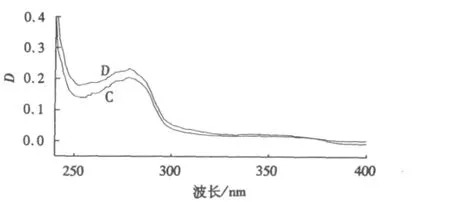
图6 NTA-BSA混合液的紫外吸收光谱Fig.6 Ultraviolet-vis spectrometry of NTA-BSA
3 结论
采用荧光光谱分析法,辅以紫外光谱分析,研究了NTA与BSA之间的相互作用.结果表明,NTA能猝灭BSA的内源性荧光,且以动态猝灭机制为主.热力学参数的计算表明,在T为293和310 K时,NTA与BSA的KA分别为31.9和72.9 L·mol-1,二者以疏水力作用为主,二者间只有弱的结合.同步荧光光谱和紫外光谱分析表明了NTA的加入没有引起BSA构象的变化.本试验结果对于阐明NTA的药物作用机制以及药代动力学等方面具有重要的参考价值.
[1]关静,霍艳艳,董春娇.烟酸类药物的研究进展[J].沈阳医学院学报,2011,13(2):110-112.
[2]CARLSON L A.Nicotinic acid:the broad-spectrum lipid drug.A 50th anniversary review[J].J Intern Med,2005,258:94-114.
[3]薛红波,李春涯,高兰昌,等.维生素B1与牛血清白蛋白的相互作用[J].分析试验室,2011,30(4):111-114.
[4]林玉龙,王静,杨彩琴,等.齐墩果酸与牛血清白蛋白相互作用的光谱研究[J].分析科学学报,2011,27(4):483-486.
[5]YANG M M,XI X L,YANG P.Comparison of reasonableness of the fluorescence quenching and enhancement equations at different temperatures[J].Acta Chim Sin,2006,64(14):1437 -1445.
[6]LAKOWICZ J R,WEBER G.Quenching of protein fluorescence by oxygen detection of structural fluctuations in proteins on the nanosecond time scale[J].Biochemistry,1973,12(21):4171 -4179.
[7]WANG Y Q,ZHANG H M,ZHANG G C.Studies of the interaction between palmatine hydrochloride and human serum albumin by fluorescence quenching method[J].Pharm Biomed Anal,2006,41(3):1041 -1046.
[8]XIE M X,XU X Y,WANGY D,et al.Interaction between hesperetin and human serum album in revealed by spectroscopic methods[J].Biochim Biophys Acta,2005,1724:215 -224.
[9]何华,叶海英,黛丽,等.洛美沙星-Tb3+配合物与BSA相互作用的荧光光谱研究[J].光谱学与光谱分析,2006,26(3):480-483.
[10]TIMASHEFF S N.Thermodynamics of protein interactions[M]∥PEETERS H.Proteins of Biological Fluids.Oxford:Pergam on Press,1972:511.
[11]ROSS D P,SUBRAMANIAN S.Thermodynamics of protein association reactions:Forces contributing to stability[J].Biochemistry,1981,20(11):3096 -3102.

