重组人促性腺激素-铜绿假单胞菌外毒素A蛋白的可溶性表达、纯化和对肿瘤细胞的抑制活性
郭凯,赵晓燕,周红姿,陈凯,李纪顺,陈泉,杨合同
(山东省科学院中日友好生物技术研究中心,山东省应用微生物重点实验室,山东 济南 250014)
导向治疗是一种有望代替化疗的新的治疗手段,应用免疫毒素或导向毒素是实现导向治疗的一个重要的发展方向,通过特异性抗体或细胞因子、激素等与毒素连接,前者作为导向部分即配体,可以引导分子到达肿瘤部位并与肿瘤细胞表面过量表达的该种受体结合;后者作为毒素部分,即杀灭肿瘤细胞的部分。部分免疫毒素,如 OVB3-PE、IgG-HD37-dgA、IgG-RFB4-dgA、B3-PE40、LHRH-PE40 等已进入临床观察,DAB389-IL-2(商品名为ONTAC)已通过FDA批准上市,显示出良好的疗效[1]。
绿脓杆菌外毒素A属于单转移酶家族,将NAD+的ADP-核糖基转移至底物使其ADP-核糖化[2-3]。绿脓杆菌外毒素A(PEA)的分子量为66.0 kD,主要功能结构域包括:Domain Ia(AA 1-252),与受体识别的结合的结构域;Domain Ib(AA 365-484);Domain II(AA 253-364),Domain II与毒素从细胞膜外到细胞内的跨膜转运相关;Domain III(AA 405-613),Domain III和Ib共同组成催化ADP-核糖化的催化结构域。在真核细胞内,绿脓杆菌外毒素A催化蛋白质延长因子eEF-2ADP,使其发生核糖基化作用从而丧失活性,最终阻断细胞内的蛋白质合成,导致细胞的死亡[2-3]。
人促性腺激素释放激素(GnRH)做为重组蛋白的导向部分,能够和癌细胞表面表达的GnRH受体特异性结合。大量实验表明,GnRH受体在某些癌细胞表面高度表达,而相应的正常细胞表面该受体几乎不表达[4-5]。
有文献报道PE毒素的AA 359-365缺失后,PE的活性会大幅度提高[6];此外,将PE末端5个氨基酸REDLK突变为KDEL后,也会使其活性大幅度提高[7]。所以本文选取PEA衍生物PE39KDEL作为靶向抗肿瘤蛋白的毒素部分。
目前文献报道的PEA衍生物的相关基因工程蛋白中,都是以包涵体形式表达[8-9],纯化后需要进行蛋白质复性操作,然而蛋白质的复性过程较为繁琐,且无法保证蛋白质的天然活性构象[10-11]。本文通过表达载体的构建和后期表达优化,最终得到可溶性表达的蛋白GnRH-PE39KDEL前体,经一步纯化后蛋白纯度达到95%以上,蛋白最终得率在2.6 mg/g菌体,解决了GnRH-PE39KDEL重组蛋白无法可溶表达的难题,为进一步工业化生产奠定了基础。
1 材料与方法
1.1 材料
1.1.1 质粒和菌株
大肠杆菌DH5α、BL21(DE3)和BL21(DE3)plysS为本实验室保存菌种,质粒pET-24b购自Navogen公司,基因GnRH-PE39KDEL和相关引物由北京鼎国昌盛生物技术有限责任公司合成。
1.1.2 试剂
Pfu Taq DNA聚合酶购自天为时代;限制性核酸内切酶、T4 DNA连接酶及DNA Marker购自TaKaRa公司;IPTG购自罗氏;蛋白质中等分子量marker、卡那霉素、凝胶电泳回收试剂盒购自生工生物工程(上海)有限公司;HisTrap HP(通用电器生命科学部);其它为国产分析纯试剂。
1.1.3 仪器
PCR仪:Bio-Rad MyCycler温度梯度PCR仪。
电泳及成像:Bio-Rad和G-BOX紫外凝胶成像系统。
蛋白质纯化及电泳:GE公司的AKTA purifier亲和层析系统,Bio-Rad SDS-PAGE垂直电泳系统。
1.2 方法
1.2.1 GnRH-PE39KDEL 基因的获得
依据大肠杆菌密码子偏好性优化GnRH-PE39KDEL核酸序列,通过基因合成的方法,获得全长序列,由上海鼎国生物技术有限公司合成。
1.2.2 pET-24b-GnRH-PE39KDEL 载体的构建和鉴定
含GnRH-PE39KDEL全长的Puc57的DH5α大肠杆菌经质粒回收试剂盒提取完整质粒作为PCR模板。设计的正向引物含有蛋氨酸起始密码子及 NdeI酶切位点,pET-24bForward:5′-ggaattc CATATGGAACACTGGTCTTACGGTC;反相引物中引入Factor Xa蛋白酶切割位点及EcoR I酶切位点,pET-24b Reverse:5″-ccgGAATTCGCGACCTTCCACCAGTTCGTCTTTCGGCGG。用Nde I和EcoR I限制性内切酶双酶切PCR-GnRH-PE39KDEL回收产物和质粒pET-24b,两者按摩尔比5:1混匀,使用T4 DNA连接酶4℃连接过夜。连接产物1 μL转化到大肠杆菌DH5α感受态细胞中,涂布于含卡那霉素的琼脂糖平板上,37℃培养过夜,挑取单克隆摇菌,提取质粒比较重组DNA分子量大小,限制性内切酶、PCR鉴定后进行重组质粒的测序,将阳性克隆命名为 pET-24b-GnRH-PE39KDEL-DH5α。
1.2.3 pET-24b-GnRH-PE39KDEL表达载体转化及在不同大肠杆菌中诱导表达条件的优化
将鉴定后的 pET-24b-GnRH-PE39KDEL表达载体转入制备好的感受态细胞株 BL21(DE3)和 BL21(DE3)plysS 中,分别记为 pET-24b-GnRH-PE39KDEL-DE3 和 pET-24b-GnRH-PE39KDEL-plysS。
诱导温度、诱导剂浓度及诱导时间:挑取 pET-24b-GnRH-PE39KDEL-DE3单菌落于 20mL含有100 μmol/L卡那霉素的LB+0.2 mg/mL葡萄糖液体培养基,37℃ 180 r/min过夜培养,按4%的接菌量转接至50mL含有100 μmol/L卡那霉素的LB+0.2 mg/mL葡萄糖培养基中,37℃ 180 r/min,继续培养3 h至 OD600为 0.6,加入异丙基-β-D-硫代半乳糖苷(IPTG)至终浓度 0、0.1、0.2、0.4、0.8mmol/L,分成 2 组,分别于30℃、37℃ 180 r/min培养5 h,每1 h取样一次。菌液12000 g离心2 min,使用1×loading buffer重悬菌体,99℃保温4 min,12000g离心2 min后-20℃保存待用。
宿主菌优化:挑取 pET-24b-GnRH-PE39KDEL-DE3 和 pET-24b-GnRH-PE39KDEL-plysS 单菌落于 20mL含有100 μmol/L卡那霉素的LB+0.2% 葡萄糖液体培养基,37℃ 180 r/min过夜培养,按4%的接菌量转接至50mL含有100μmol/L卡那霉素的LB+0.2 mg/mL葡萄糖培养基中,37℃ 180 r/min,继续培养3 h至OD600为0.6,IPTG至终浓度0.2 mmol/L,分成2组,于30℃ 180 r/min培养5 h,每 1 h取样一次。菌液12000 g离心2 min,使用1×loading buffer重悬菌体,99℃保温4 min,12000g离心2 min后-20℃保存待用。
1.2.4 变性 SDS-PAGE 电泳分析
配制12 mg/mL的分离胶和5 mg/mL浓缩胶,进行SDS-PAGE电泳分析蛋白表达。
1.2.5 GnRH-PE39KDEL融合蛋白的大量表达和初纯品的制备
接种单克隆 pET-24b-GnRH-PE39KDEL-plysS 含有100 μmol/L 卡那霉素的 LB+0.2 mg/mL 葡萄糖液体培养基中37℃ 180 r/min过夜培养,按5(V/V)接菌量接种种子液至500mL含有100 μmol/L卡那霉素的LB+0.2 mg/mL葡萄糖液体培养基中,约2.5 h OD600升为0.6时,降温至30℃ 加入IPTG至终浓度0.2 mmol/L,诱导重组蛋白表达2 h,高速离心收集菌体,按照菌体和破碎缓冲液(50mmol/L Tris pH=8.0,0.5 mol/L NaCl,5%Glycerol,20mmol/L Imidazole)1:5(V/V)的比例重悬菌体,超声波破碎,高速离心后收集上清。加入1 μg/mL DNase和RNase及1 mmol/L MgCl2,经0.22 μm 过滤膜过滤。
利用GE AKTA purifier系统平衡层析柱后,使用上样泵将样品加载入亲和层析柱上(流速≤4 mL/min,柱压≤0.3 MPa)。使用上样缓冲液(50mmol/L Tris pH=8.0,0.5 mol/L NaCl)冲洗层析柱至 UV280达到平衡。调节洗脱缓冲液(50mmol/L Tris pH=8.0,0.5 mol/L NaCl,500mmol/L Imidazole)的体积至 10%(50mmol/L Imidazole),洗脱结合在层析柱中的杂蛋白,设定UV280≥100收集。提高洗脱缓冲液体积比至50%(250mmol/L Imidazole),最后使用100%(V/V)洗脱缓冲液清洗层析柱[12-13]。层析柱平衡后保存至缓冲液中,将各组分进行SDS电泳分析。
1.2.6 活性检测
收集对数期细胞A549,调整细胞悬液浓度,每孔加入200 μL,铺板使待测细胞调密度至103~104个/孔。体积分数为5%的CO2,37℃孵育,至细胞单层铺满孔底(96孔平底板),加入浓度梯度的药物,孵育16~48 h。每孔加入20 μL 5 mg/mL的MTT溶液,继续培养4 h。终止培养,小心吸去孔内培养液。每孔加入150 μL二甲基亚砜(DMSO),置摇床上低速振荡10min。在酶联免疫检测仪490 nm处测量各孔的吸光值。
2 结果
2.1 pET-24b-GnRH-PE39KDEL 重组表达载体质粒的鉴定
使用单克隆菌落回收的质粒经 PCR、单酶切、双酶切结果证实(图1),在pET-24b-GnRH-PE39KDEL载体中含有正确插入的重组蛋白核酸序列。
琼脂糖电泳结果显示在1.2 kb处有特异目的条带,提取重组质粒后使用BamHI、EcoRI进行双酶切,在5.3 kb和1.2 kb处获得2个片段。经生工生物工程(上海)有限公司正反向测序后,核酸序列与合成的重组蛋白核酸序列一致。
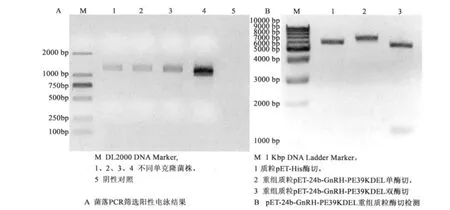
图1 重组质粒pET-24b-GnRH-PE39KDEL构建的琼脂糖凝胶电泳图Fig.1 Electrophoretic analysis of colony PCR products enzymatic digestion
2.2 pET-24b-GnRH-PE39KDEL表达产物的初步鉴定及表达条件的优化
融合蛋白表达含有395个氨基酸残基,理论分子量为42.8 kD。重组菌株中总蛋白经SDS-PAGE电泳显示在35~45 kD处有一明显的目的条带,同时在0.2 mmol/L IPTG诱导浓度下,蛋白表达达到最大值,增加IPTG并未增加诱导蛋白表达量(数据未列出)。在温度诱导条件下,37℃蛋白表达量较30℃明显增高,但是为包涵体表达形式,30℃时蛋白以可溶形式表达。故使用30℃进行重组蛋白大量生产。在IPTG诱导下,重组蛋白在BL21(DE3)plysS中2 h达到最大表达量,而在BL21(DE3)此过程需要4 h(图2)。BL21(DE3)plysS带有的pLysS质粒编码T7噬菌体溶菌酶,可以极大或完全抑制诱导剂(IPTG)加入前的重组蛋白的非诱导表达,而重组蛋白在菌体生长中的痕量表达有可能对IPTG诱导的蛋白过程起到一定的反馈抑制作用,这可能是BL21(DE3)plysS表达重组蛋白速度更快的原因。
使用Image Pro Plus对SDS-PAGE的结果分析显示,重组蛋白表达量占总蛋白的30%(w/w)左右,占可溶蛋白的40%(w/w)以上。
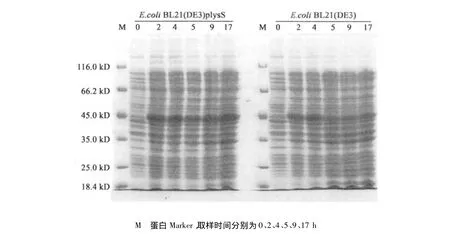
图2 pET-24b-GnRH-PE39KDEL 在 E.coli BL21(DE3)和 E.coli BL21(DE3)plysS 重组 SDS-PAGE电泳图Fig.2 SDS-PAGE analysis of recombinant protein of pET-24b-GnRH-PE39KDEL in E.coli BL21(DE3)and E.coli BL21(DE3)plysS
2.3 重组蛋白纯品的制备
经过HisTrap亲和层析柱纯化得到的蛋白纯度约为90%,使用脱盐柱缓冲液置换后,去除了小分子量的蛋白和一些线性蛋白,蛋白纯度达到95%以上,见图3。蛋白纯化过程中存在一些可以和镍柱亲和吸附的宿主菌蛋白,在图3中可见在25~30 kD有宿主蛋白条带。在后续的纯化过程中,这些非特异性吸附蛋白被去除掉(数据未列出)。
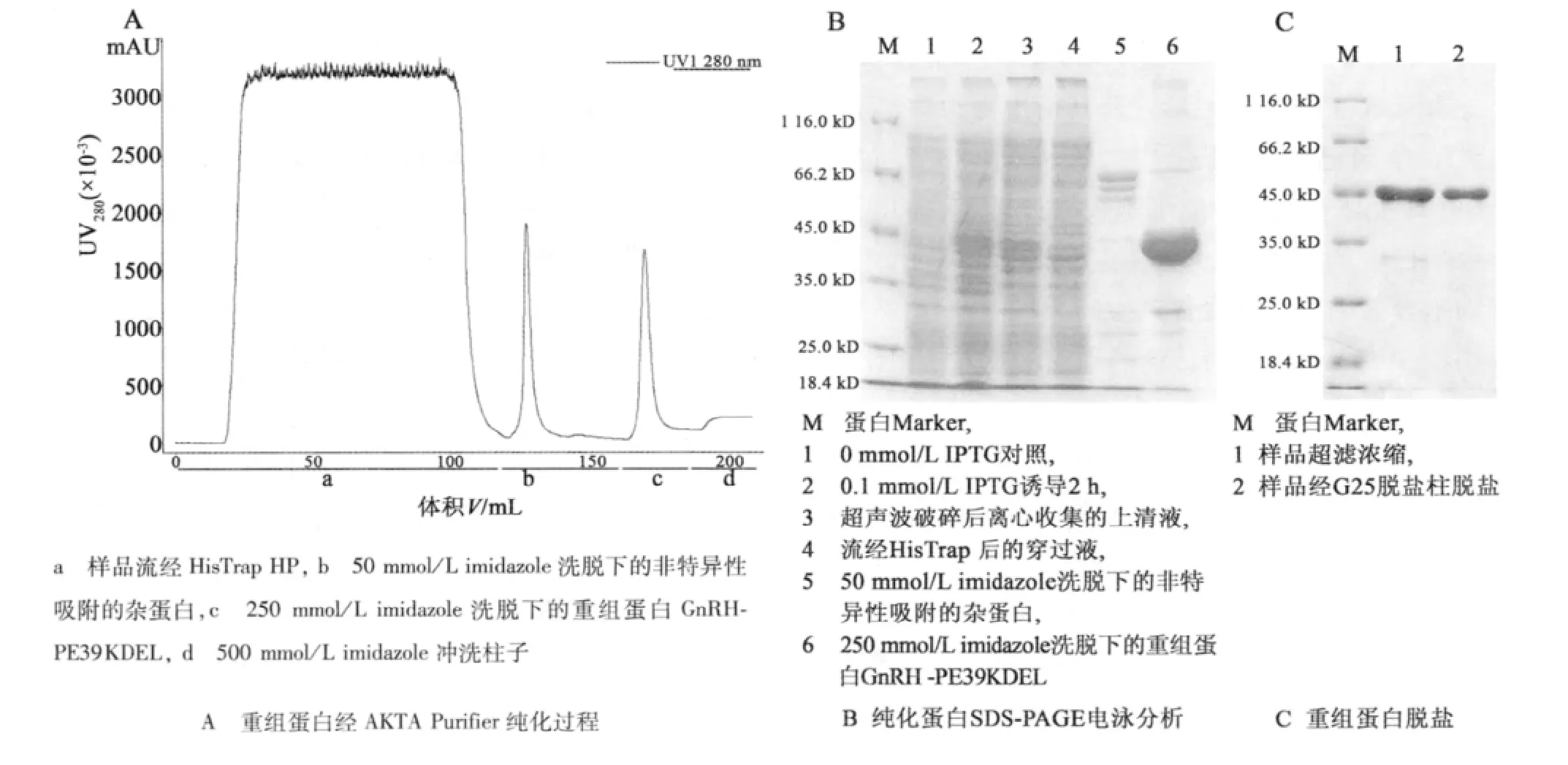
图3 重组蛋白纯化过程与SDS-PAGE电泳结果Fig.3 Purification of recombinant protein GnRH-PE39KDEL
2.4 质谱鉴定重组蛋白氨基酸序列
取蛋白样品 200 μg,溶于 50 μL 含有 8mol/L urea、10mmol/L DTT、50mmol/L NH4HCO3的溶液中,置37°C水浴中还原4 h,然后加入5 μL 0.5 mol/L碘乙酰胺放置暗处1 h进行烷基化,加250 μL 50mmol/L NH4HCO3溶液将尿素稀释到1 mol/L以下,最后加入5 μg的胰蛋白酶37℃保温反应16 h,取出后冷冻干燥成粉末,用流动相(体积分数0.1%的甲酸水溶液)复溶至200 μL待测。

使用Agilent串联快速分离液相-6520型四极杆飞行时间质谱(RRLC-Q-TOF)鉴定,肽段和数据库比较得出,此蛋白含有正确的PEA66蛋白序列。由于重组蛋白是一种毒性蛋白,在大肠杆菌中是否表达,是否表达全长序列需要检测。通过质谱分析并结合SDS电泳分析发现,在宿主菌中重组蛋白得以表达并且可以全长正确表达,结果图4所示。
2.5 重组蛋白对肿瘤细胞A549的增值抑制效果
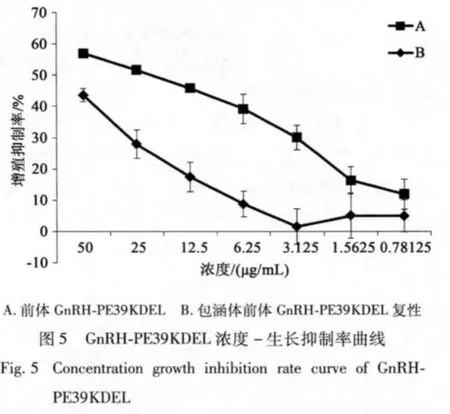
本实验室前期得到的包涵体蛋白复性后的活性检测结果表明,包涵体复性蛋白活性明显低于可溶性表达的重组蛋白。同时包涵体复性过程不仅增加了操作步骤和生产成本,同时由于操作步骤过多降低了蛋白的得率。
实验结果(图5)显示可溶性表达重组蛋白对于肺癌细胞株A549的增殖有很好的抑制作用,经计算IC50所需要的重组蛋白浓度为 20.70 μg/mL,相对应的包涵体复性蛋白浓度为192.42 μg/mL。由此可见可溶性表达的重组蛋白具有很好的抑制肿瘤细胞增殖的作用。
2.6 讨论
目前以GnRH或其衍生物为导向部分,以绿脓杆菌外毒素A(PE)的截短形式及其衍生物为毒素部分的靶向治疗剂已经有报道[14]。这种靶向治疗剂是利用GnRH受体在某些肿瘤细胞表面过量表达的现象,用融合蛋白中的GnRH部分与过度表达GnRH受体的肿瘤细胞表面的LHRH受体产生特异性的结合,然后将其毒素部分PE衍生物导入肿瘤细胞,同时对正常细胞作用较少或无影响。与传统的肿瘤治疗方法相比GnRH-PE衍生物的靶向性治疗以其特异性和高效性而占有无可争辩的优势[15-17]。
在已有的PE类衍生物的重组蛋白报道中,重组蛋白以包涵体形式表达,这为后期蛋白复性和工业化生产带来很多问题。本研究构建的pET-24b-GnRH-PE39KDEL-BL21(DE3)plysS能够实现重组蛋白的可溶性表达,在对重组蛋白表达条件进行初步优化后,利用AKTA purifier系统可以获得纯度达95%以上的目的蛋白,蛋白最终得率在2.6 mg/g菌体。并且通过IC50检测,证实了前体蛋白良好的毒杀肿瘤细胞活性。
本实验通过工程菌株的筛选和优化表达纯化工艺,得到了一套较为成熟和简便的GnRH-PE39KDEL纯化流程,为后续工业放大生产奠定了可靠的基础。
[1]AQEILAN R,KEDAR R,BEN-YEHUDAH A ,et al.Mechanism of action of interleukin-2(IL-2)-Bax,an apoptosis-inducing chimaeric protein targeted against cells expressing the IL-2 receptor[J].Biochem J,2003,370(Pt 1):129 -140.
[2]YATES S P,MERRILL A R.A catalytic loop within Pseudomonas aeruginosa exotoxin A modulates its transferase activity[J].J Biol Chem,2001,276(37):35029-35036.
[3]ARMSTRONG S ,YATES S P,MERRILL A R.Insight into the catalytic mechanism of pseudomonas aeruginosa exotoxin A[J].Biochem,2002,277(48):46669-46675.
[4]PATI D,HABIBI H R.Inhibition of human hepatocarcinoma cell pro-liferation by mammalian and fish gonadotrop in-releasing hormones[J].Endocrinology,1995,136(1):75 -84.
[5]罗海波,朱平,李兰娟.细菌毒素与临床[M].北京:人民卫生出版社,1999:91-99.
[6]TAUPIAC M P,BEBIEN M,ALAMI M,et al.A deletion within the translocation domain of Pseudomonas exotoxin A enhances translocation efficiency and cytotoxicity concomitantly[J].Mol Microbiol,1999,31(5):1385 -93.
[7]PASTAN I H,FITZGERALD D J.Recombinant pseudomonas exotoxin with increased activity:US,5602095[P].1997 -02 -11.
[8]朱海兵,黄轶,曾昭淳.F3重组毒素的克隆表达及纯化[J].科技导报,2009,27(12):19-22.
[9]朱海兵,黄轶,曾昭淳.F3-PE40基因的克隆、表达及纯化[J].生物学杂志,2010,27(4):49-52.
[10]钟晓力,黄华梁.假单孢菌外毒素A的介绍[J].生物学通报,2000,35(9):10-13.
[11]祁志荣.PE类重组免疫毒素的研究进展[J].微生物学免疫学进展,2006,34(1):50-53.
[12]BORNHORST J A,FALKE J J.Purification of proteins using polyhistidine affinity tags[J].Methods Enzymol,2000,326:245 -254.
[13]CROWE J,MASONE B S,Ribbe J.One-step purification of recombinant proteins with the 6xHis tag and Ni-NTA resin[J].Mol Biotechnol,1995,4(3):247 -258.
[14]李树民,李咏梅,冯书章,等.EGF-PE35KDEL嵌合毒素对Hela细胞的毒性作用[J].中国肿瘤生物治疗杂志,2005,12(02):120-123.
[15]H罗尔伯布姆-加尔斯基 ,A本-耶胡达,A内楚施坦,等.应用嵌合毒素诊断癌症的方法:中国,99806580.3[P].1999-09-30.
[16]聂李亚,马素永,文美玉.一种能特异杀死肿瘤细胞的基因工程重组蛋白:中国,03137587.1[P].2003-06-18.
[17]聂李亚,马素永,金美玉.高效低毒的系列功能蛋白:中国,200410033621.6[P].2004-04-13.

