浙江清凉峰地衣内生菌物种多样性及活性研究
刘静,胡玲,王海英,赵遵田
(山东师范大学生命科学学院,山东 济南 250014)
地衣(Iichens)是真菌和藻类的共生复合体,地衣内生菌可产生对多种病原菌具抑制活性的次生代谢产物,因此,许多地衣学家期望能通过人工培养手段尽快获得足够生物量的地衣内生菌及其代谢产物,为研究其活性及化学特性提供丰富的原材料。目前,几乎都是通过Yamamoto法[1]分离地衣内生菌,然而该方法污染率非常高,因此,我们采用刮皮层挑取菌丝的新方法以较高效地获得目标内生菌[2]。
对浙江省清凉峰10m×10m样方采集的地衣体标本进行分离培养,得到的55株地衣内生菌进行ITS序列和28S序列的分子鉴定,并通过GenBank数据库搜索,ClastalX 2.11多重序列比对以及MEGA 5.0最小进化法(ME)构建系统发育树[3],得知该地区地衣内生菌的物种多样性[4]。
该研究对55株地衣内生菌的次生代谢产物进行活性初筛,利用滤纸片法[5]检测其次生代谢产物的抗细菌、真菌活性。结果表明,其代谢产物具较强的抗细菌、白色念珠菌的生物活性,具抑菌活性的菌株占所测总菌株的14.55%。地衣内生菌产生的各种活性物质在生物制药、农业生产、工业发酵等方面都表现出很好的应用前景[6],受到世界各国专家的广泛关注。
1 材料与方法
1.1 材料
从分离培养的82株地衣内生菌中选取菌落的形态、颜色差异较大的55株作为受试菌株。
1.2 方法
对55株受试菌株进行ITS序列和28S序列测定[7]。
1.2.1 地衣内生菌的分子鉴定
采用CTAB法[8]提取内生菌总DNA,然后进行ITS序列和28S序列的扩增,ITS序列所用引物为E9:5′-TTGTACACACCGCCCGT-3′;CL2R:5′-TTTCTTTTCCTCCGCT TTATTGA-3′,28S 序 列 所 用 引 物 为 L1:5′-ACCCGCTGAACTTAAGCATA-3′;CL6R:5′-TGCTACTACCACCAAGATC-3′。扩增条件[9]为:95℃ 预变性3 min,94℃变性30 s;52℃复性30 s,72℃延伸30 s,共37个循环,72℃后延伸10min,4℃保存。扩增的PCR产物进行琼脂糖凝胶电泳检测之后进行测序。
1.2.2 地衣内生菌的活性初筛
1.2.2.1 培养基[10-12]
(1)PDA培养基:马铃薯200 g、葡萄糖20 g、琼脂18 g、去离子水1000mL、pH值7.0;
(2)LB 培养基:蛋白胨10 g、酵母膏5 g、NaCl 10 g、去离子水1000mL、pH 值7.4。
1.2.2.2 拮抗实验菌株
(1)供试细菌:大肠杆菌(Escherichia coli DH5αi)、金黄色葡萄球菌(Staphylococcus aureus)、枯草芽孢杆菌(Bacillus subtilis)、鳗弧菌(Vibrio anguillarum);
(2)供试真菌:白色念珠菌(Monilia albican)。
1.2.2.3 抗生素
氨苄青霉素(Ampicillin)、盐酸四环素(Tetracycline hydrochloride)。
1.2.2.4 内生真菌发酵及代谢产物的提取
分离到的地衣内生菌斜面培养物经活化后分别接种至200mL PDA发酵培养基中,22℃摇床上以110 r/min的转速培养21 d,发酵结束后将发酵物用乙醇超声30min后浸泡抽提1 d,旋蒸后的浸膏用乙酸乙酯萃取1 d,用2 mL甲醇将旋蒸干后的粗提物0.5 g溶解,配成0.25 g/mL的浓缩液[13]。
1.2.2.5 内生真菌代谢物抗细菌、抗真菌活性检测
采用滤纸片法进行抗菌活性检测:活化后的细菌培养液用无菌水稀释成105 cfu/mL的菌悬液[14],取0.1mL菌悬液涂布于LB平板上。将无菌小滤纸片(直径为6 mm,高温蒸汽杀菌后烘干)浸泡在浓度为10mg/mL粗提液中约30min,沥干贴于含菌平板上,以浸有0.1 mg/mL氨苄青霉素的滤纸片为阳性对照,以浸有甲醇的滤纸片为阴性对照,37℃培养24 h,观察抑菌圈的大小及有无。吸取200 μL白色念珠菌的稀释液(105cfu/mL)涂布于PDA平板上,28℃培养48 h,其余均与细菌相同,并用空白滤纸片吸取甲醇溶液作为阴性对照;用浸泡过盐酸四环素的滤纸片晾干后贴于平板上作为阳性对照,用十字交叉法测量抑菌圈直径,设置3个重复。
2 结果
2.1 菌株的分类学地位
对获得的ITS序列和28S序列通过GenBank数据库搜索,ClastalX 2.11多重序列比对以及MEGA 5.0最小进化法(ME)构建系统发育树,得到所有菌株的分类学地位如下:3个纲:即 Dothideomycetes、Tremellomycetes、Elaphocordyceps;6 个目:Pleosporales、Hypocreales、Chaetothyriales 、Myriangiales、Dothideales、Capnodiales;10 个 科:Nectriaceae、Herpotrichiellaceae、Teratosphaeriaceae、Massarinaceae、Pleosporaceae、Capnodiaceae、Montagnulaceae、Bionectriaceae、Xylariaceae、Dothideomycetes。
2.2 菌株次生代谢产物的抗菌活性
受试菌株中有4株抗白色念珠菌的活性很强,抑菌圈的最大直径达到3.0 cm,另外还有5株具较好的抗细菌活性,抑菌圈直径达到2.0 cm左右,菌株4734a的抗细菌和白色念珠菌活性都较强(见图1)。所有菌株对金黄色葡萄球菌均无明显抑制作用,抑菌活性较好的菌株数共8株,占总菌株的14.55%。8株地衣内生菌的抑菌活性照片见图1~3,抑菌效果见表1。
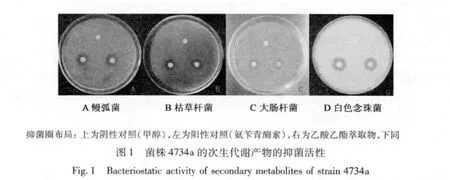
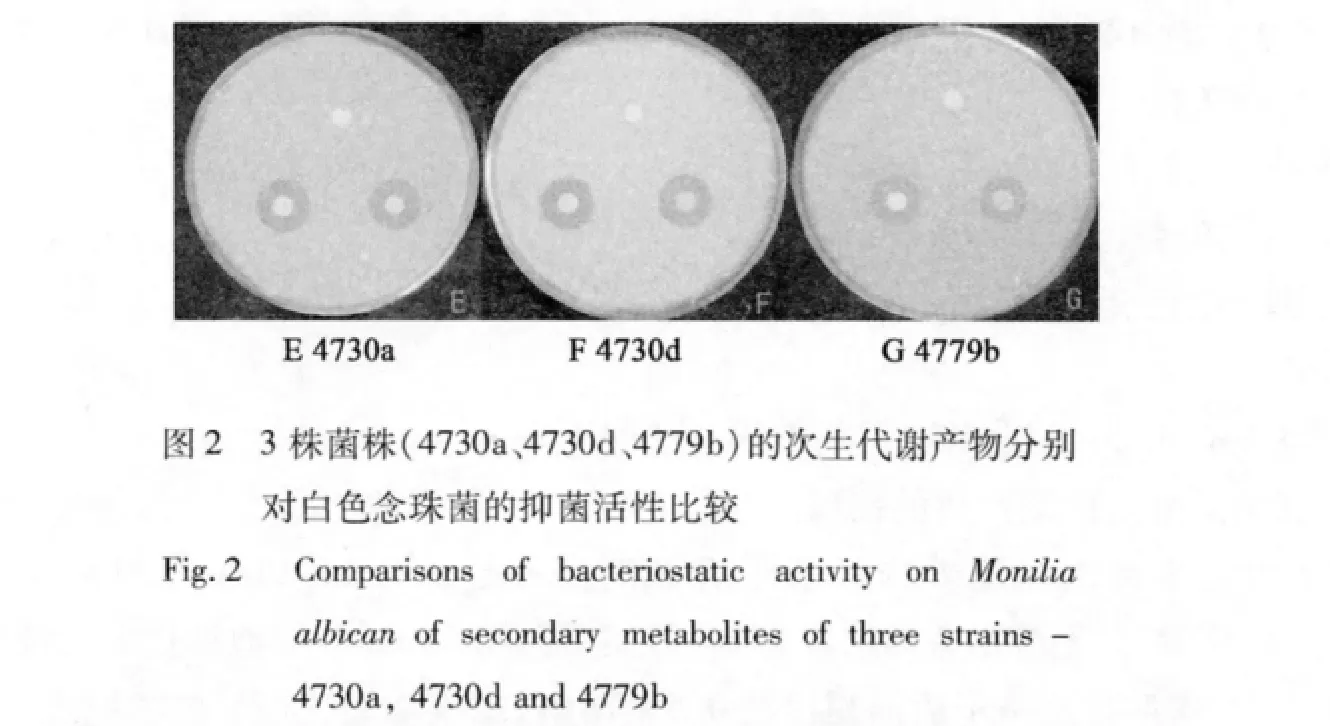
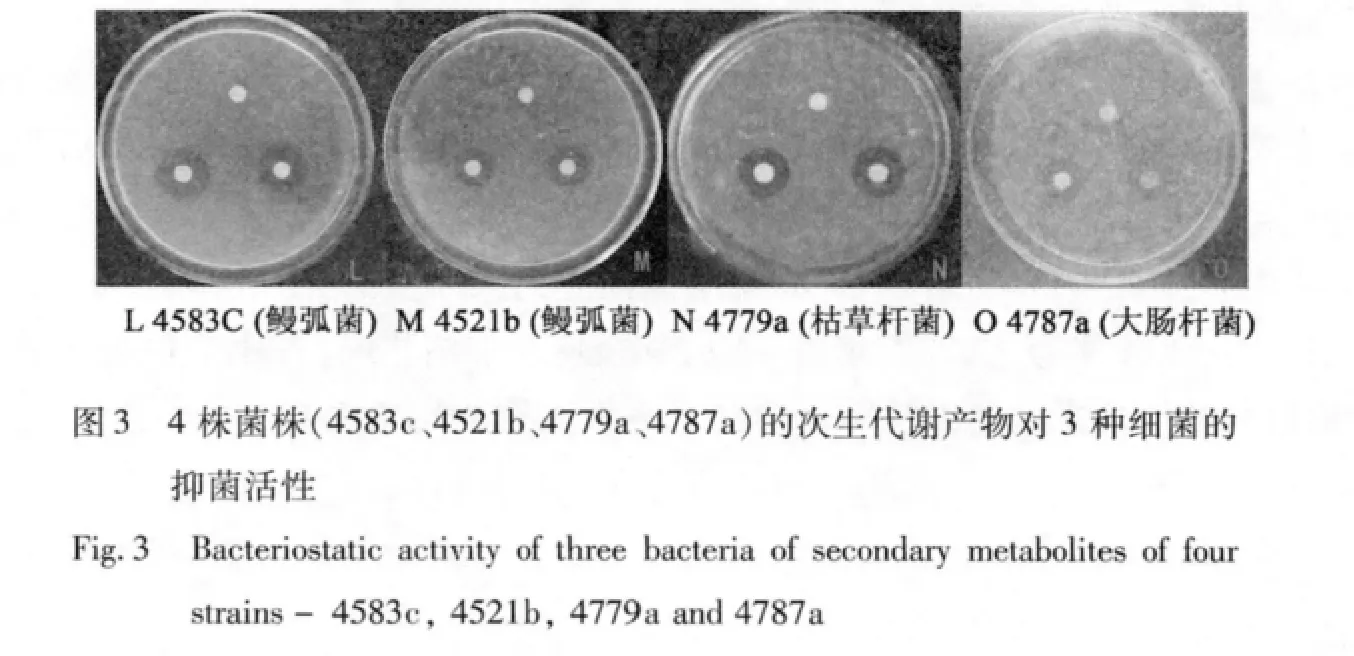

表1 8株地衣内生菌次生代谢产物的抑菌效果Table 1 Antimicrobial effect of secondary metabolites of eight endolichenic fungi
3 讨论
通过GenBank的相似性搜索和系统发育分析,确定了浙江省清凉峰该实验样方内地衣内生菌均属于子囊菌门。Hartmann等[15]的研究表明,利用多样性指数分析复杂微生物群落结构是非常有利的。本文采用Shannon-Weiner指数 (H′)=来描述地衣内生菌的物种多样性,得出该样方总的内生菌群落生物多样性指数为1.44,均匀度为0.25。数据分析显示,该实验样方内的地衣内生菌群落显示出了较丰富的生物多样性(1.44),且通过GenBank的相似性搜索得知该内生菌菌群多为未知菌群,充分地显示了该地衣内生菌是一个非常独特的微生物新类群,对该地区生态系统的群落研究具有一定的价值和意义。
抗菌活性研究结果显示,该样方内地衣内生菌的抗菌活性菌株占总菌株数的14.55%,且抗菌活性较强。本实验只是初步定性地研究了清凉峰的地衣内生菌次生代谢产物的抗细菌、真菌活性,对其抗菌活性的定量研究需要做进一步的分析,同时也应该研究其抵抗植物病原菌、抗肿瘤、抗病毒以及抗氧化能力,并通过化学的方法将活性较强的单体化合物分离提取出来[16]。总之,作为一种新型的植物研究资源,地衣内生菌的深入研究对新药的开发具有潜在的应用价值,为人们寻找各种具有较强生物活性的先导化合物开辟了新途径,从而可以使某些珍稀但濒临灭绝的高等药用植物得到进一步的保护。
[1]YAMAMOTO Y,MIZUGUCHI R,YAMADA Y.Tissue cultures of Usnea rubescens and Tamalina yasudae and production of usnic acid in their cultures[J].AgricBiol Chem,1985,49(11):3347 -3348.
[2]邱振鲁,王海英,赵遵田.地衣共生菌分离培养的新方法[J].山东科学,2011,24(2):14-20.
[3]李铭,王海英,赵遵田.石耳目地衣内生菌的系统发育学分析[J].山东科学,2011,24(1):33-35.
[4]PETRINIA O,FISHER P J.A comparative study of fungal endophytes in xylem and whole stem of Pinus sylvestris and Fagus sylvatica[J].British Mycological society,1988,91(2):233 -238.
[5]张佳,王莹,张峰,等.滤纸片法测定黄花蒿提取物对霉菌的抑制活性[J].湖北农业科学,2009,48(5):1153-1154.
[6]邱观荣.紫杉醇植物内生真菌来源及其生物多样性[J].国外医药:抗生素分册,1998,19(4):265-266.
[7]GUO L D,HUANG G R,WANG Y,et al.Molecular identification of white morphotype strains of endophytic fungi from Pinus tabulaeformi[J].Mycological Research,2003,107(6):680 -688.
[8]黄贵修,TAKAYAMA Y,KELEMU S.臂形草内生菌特异DNA片段的克隆及其分子鉴定[J].热带作物学报,2002,23(4):58-61.
[9]苗翠苹,胡娟,翟英哲,等.滇牡丹内生真菌PR20的鉴定及次生代谢产物的研究[J].天然产物研究与开发,2012,24(10):1339-1342.
[10]郭建新,张光宇,张荣,等.银杏内生真菌抗真菌活性菌株的分离和筛选[J].西北农业学报,2005,14(4):14-17.
[11]郑毅,陈有为,张传会,等.木本曼陀罗内生真菌抗菌活性的研究[J].菌物研究,2007,6(2):101-108.
[12]杜希萍,赵保兵,郑忠辉,等.红树内生真菌BYY-1中的一个酚类化合物的分离鉴定与抗肿瘤活性[J].集美大学学报,2011,16(6):424 -428.
[13]刘新利,鞠培殿,娄红祥.粘球菌产生的活性天然产物[J].国际药学研究杂志,2010,37(2):98-104.
[14]张秀娟,陈彤彤,宋晓研,等.绒毛白蜡果实提取物的抑菌作用研究[J].西北植物学报,2009,29(4):0824-0829.
[15]HARTMANN M,WINDMER F.Community structure analyses are more sensitive to differences in soil bacterial communities than anonymous diversity indices[J].Appl Environ Microbiol,2006,72(12):7804 -7812.
[16]YUAN C,ZHANG X J,DU Y D,et al.Antibacterial compounds and other constituents of Evernia divaricata(L.)Ach[J].J Chem Soc Pak,2010,32(2)189-193.

