光动力疗法对乳腺癌干细胞的作用研究
侯国芳,刘 艳,张霄蓓,刘晶晶,张 晟,张 瑾
1997年John Dick等人首次提出急性髓性白血病的发生、发展是由于一些具有自我更新、多系分化以及有成瘤能力的细胞所造成的,并将其命名为干细胞(CSCs)[1]。随后,2003年Al-Hajj等[2]采用CD44+CD24-/lowlin-表面标记分子分离出乳腺癌干细胞。鉴于肿瘤干细胞特殊的地位,其治疗成为当前研究的热点。随着医学的不断发展,癌症的治疗手段呈现多样化和规范化的趋势。在手术、化疗、放疗为主要治疗手段的大背景下,光动力疗法(PDT)近年逐渐进入人们的视野,其突出优点体现在无创性消灭局部肿瘤病灶,不良反应小,可重复性高,但其对肿瘤干细胞是否具有抑制作用,尚未可知。基于此目的,本研究采用PDT作用于MCF-7乳腺癌干细胞,通过检测生长浓度抑制曲线和分析细胞凋亡图形,探索PDT对肿瘤干细胞的作用。
1 对象与方法
1.1研究对象人MCF-7乳腺癌细胞系为天津市肿瘤医院公共实验室所保存。
1.2试剂光敏剂血卟啉单甲醚(HMME)购于上海先辉医药科技有限公司。RPMI1640、胎牛血清(FCS)、Hank′s液、四甲基偶氮唑盐(MTT)、胰酶、B27、DMEM购于GIBCO公司;分选荧光抗体购于SANTA CRUZ生物科技公司;Annexin V-FITC细胞凋亡检测试剂盒购自KeyGEN公司;胰岛素购于sigma公司;表皮生长因子(EGF)、碱性成纤维细胞生长因子(bFGF)购于Reprotech公司。其他试剂均由天津市肿瘤医院公共实验室提供。
1.3实验仪器37 ℃自动CO2恒温培养箱;无菌超净台;He-Ne激光器;酶联免疫检测仪、流式细胞仪等仪器由天津市肿瘤医院公共实验室提供。
1.4实验方法
1.4.1细胞培养及流式方法分选MCF-7乳腺癌干细胞将MCF-7细胞置于25 cm2培养瓶中进行培养,培养基为含10%FCS的RPMI1640。1~2 d换液,细胞长至80%左右进行传代,置于37 ℃,5%CO2饱和湿度孵化箱进行培养。取对数期生长MCF-7细胞,0.25%胰酶消化。终止消化后,1 000 r/m,5 min离心,离心半径为15 cm,Hank′s液冲洗2遍。用Hank′s液重悬后吹成单细胞悬液,分装于5个流式管,采用CD24-PE、CD44-APC、ESA-FITC抗体选取表面标记为CD44+CD24-/lowESA+细胞。分选出的肿瘤干细胞采用含有EGF 20 μg/L、bFGF 10 μg/L、胰岛素5 mg/L和B27(1∶50)的DMEM-F12培养液培养。
1.4.2MTT试验取对数期生长MCF-7细胞,0.25%胰酶消化,终止消化后收集细胞。同时收集经过流式筛选的表型为CD44+CD24-/lowESA+MCF-7乳腺癌干细胞。二者分别分为4组,即空白对照组、单纯照射组、单纯光敏剂组和PDT组。空白对照组不经过任何处理,单纯照射组仅采用激光照射,光照强度为5 J/cm2。单纯光敏剂组仅加入浓度为40 μg/ml的光敏剂避光孵育2 h。而PDT组加入浓度为40 μg/ml的光敏剂避光孵育2 h,PBS冲洗后分别加入新鲜的细胞培养液,再采用光照强度为5 J/cm2进行照射。照射波长为632.8 nm,激光功率密度为10 mW/ cm2,照射时间为5 min。
PDT整体过程均需避光操作。HMME孵育液采用DMEM液配制成所需浓度。MTT设置5个复孔,同时设置调零孔和对照孔,边缘空用无菌PBS填充。将分选后的MCF-7乳腺癌干细胞置于96孔板中,经过上述试验处理后孵育24 h。每孔加入20 μl MTT溶液(5 mg/ml),37 ℃,5%CO2饱和湿度孵化箱继续孵育4 h。将上清液离心去除,每孔二甲基亚砜(DMSO)150 μl重悬,摇床上震荡10 min,酶联免疫吸附仪上检测各孔的光吸收值(OD值),计算生长抑制率。试验重复3次。MCF-7乳腺癌细胞处理方式近似,在去除MTT溶液时不需要离心,直接吸除上清即可。
1.4.3细胞凋亡按照上述过程对MCF-7乳腺癌干细胞用干细胞培养液重悬后置于35 mm培养皿中,分为空白对照组、单纯光照组、单纯光敏剂组和PDT组。空白对照组加入0.5%DMSO。单纯照射组仅采用激光照射,光照强度为5 J/cm2。单纯光敏剂组仅加入浓度为40 μg/ml的光敏剂避光孵育2 h。PDT组加入40 μg/ml光敏剂避光孵育2 h。PBS冲洗后加入新鲜干细胞培养液,置于5.0 J/cm2能量密度下进行照射。经过试验处理后孵育24 h,收集细胞,加入Annexin V-FITC和propidium iodide 各5 μl,室温、避光条件下孵育15 min后,上机检测细胞凋亡率。
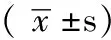
2 结果
2.1MCF-7乳腺癌干细胞比例试验通过流式分选得到CD44+CD24-/lowESA+表型MCF-7乳腺癌干细胞所含比例为(1.2±0.4)%(见图1)。
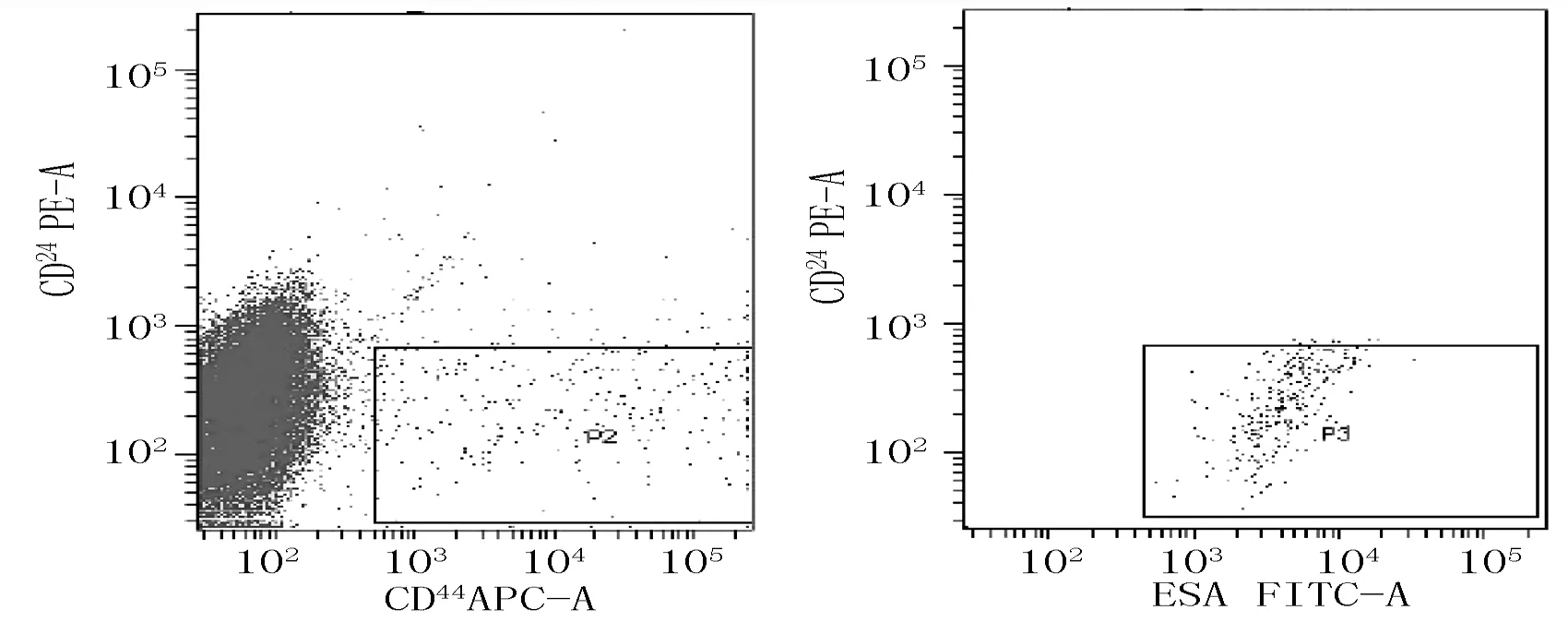
图1 MCF-7乳腺癌干细胞比例
2.2MTT试验结果空白对照组、单纯照射组、单纯光敏剂组及PDT组MCF-7乳腺癌干细胞生长抑制率比较,差异有统计学意义(P<0.05);其中PDT组较空白对照组、单纯照射组、单纯光敏剂组均升高,差异有统计学意义(P<0.05)。空白对照组、单纯照射组、单纯光敏剂组及PDT组未分选MCF-7乳腺癌干细胞生长抑制率比较,差异有统计学意义(P<0.05);其中PDT组较空白对照组、单纯照射组、单纯光敏剂组均升高,差异有统计学意义(P<0.05)。空白对照组、单纯照射组及PDT组MCF-7乳腺癌干细胞与未分选MCF-7乳腺癌干细胞采用生长抑制率比较,差异均有统计学意义(P<0.05,见表1)。
2.3流式细胞仪检测细胞凋亡空白对照组、单纯照射组、单纯光敏剂组与PDT组MCF-7乳腺癌干细胞凋亡率比较,差异有统计学意义(P<0.05);其中PDT组较空白对照组、单纯照射组、单纯光敏剂组均升高,差异有统计学意义(P<0.05,见表2、图2)。
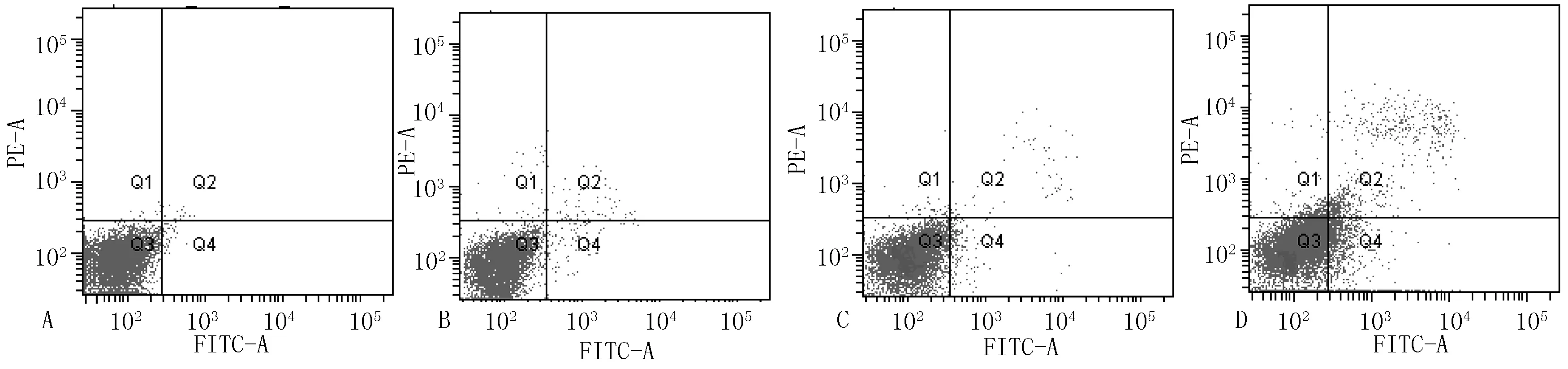
注A=空白对照组,B=单纯光照组,C=单纯光敏剂组,D=PDT组
图2不同治疗方法对MCF-7乳腺癌干细胞凋亡的影响
Figure2Apoptosis of MCF-7 breast cancer stem cells with different treatment
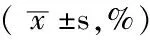
Table1Inhibitory effects of photodynamic therapy on unsorted MCF-7 breast cancer cells and breast cancer stem cells
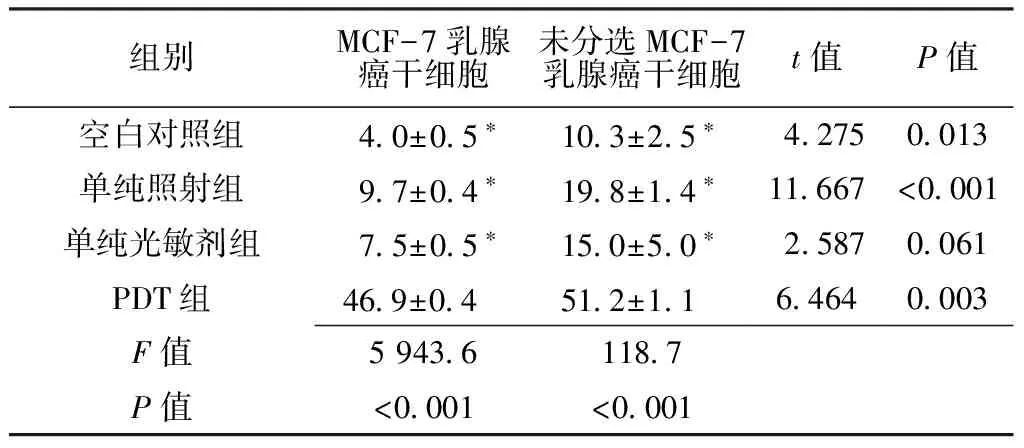
组别MCF-7乳腺癌干细胞未分选MCF-7乳腺癌干细胞t值P值空白对照组 40±05∗ 103±25∗ 4275 0013单纯照射组 97±04∗ 198±14∗11667<0001单纯光敏剂组 75±05∗ 150±50∗ 2587 0061PDT组469±04 512±11 64640003F值594361187P值<0001<0001
注:与PDT组比较,*P<0.05
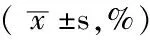
Table2Comparison of apoptosis of MCF-7 breast cancer stem cells with different treatment

组别凋亡率空白对照组 135±009∗ 单纯照射组 328±060∗ 单纯光敏剂组 208±039∗ PDT组1348±022 F值67682P值<0001
注:与PDT组比较,*P<0.05
3 讨论
由于乳腺癌干细胞特殊的性质,其对化疗、放疗、内分泌治疗均存在一定程度的耐受[3-5]。PDT最为近年来新兴的一种无创性治疗手段,其对乳腺癌干细胞是否具有作用报道较少。本研究选取乳腺癌干细胞为研究对象,通过检测生长浓度抑制曲线和分析细胞凋亡图形,检测了光动力的治疗作用。
研究显示无论是未分选MCF-7乳腺癌干细胞还是分选出的肿瘤干细胞,不同处理组组间的抑制作用均具有差异,PDT组的抑制率均明显高于其他几组。但是相同光敏剂浓度和光照强度下,未分选MCF-7乳腺癌干细胞受抑制更明显。该结论同之前的研究结果相似,乳腺癌干细胞对多种治疗方式均存在耐受现象[3-5]。HMME作为我国研制的第二代光敏剂,临床试验已经证实了其对恶性消化道肿瘤的治疗作用[6]。体外实验发现其对乳腺癌细胞也具有抑制作用[7-8]。从本研究结果来看,虽然HMME PDT体现了对MCF-7乳腺癌干细胞的抑制作用,但仍然不可避免的存在耐受。研究人员认为肿瘤干细胞对化疗的耐受与ABCG2将化疗药物转运出细胞有密切关系[9]。光敏剂作为一种化学物质,是否ABCG2也将其转运出细胞从而影响其作用效果?研究显示结肠癌细胞系ABCG2表达影响了金丝桃素介导的光动力效应的发挥[10]。同样,肺癌细胞也存在类似的现象[11]。此外,皮肤角质细胞在加入ABCG2抑制剂后,其对光动力治疗的敏感性显著提高[12]。这些研究结果提示我们乳腺癌干细胞对光动力治疗的耐受性也可能与ABCG2表达有关。因此今后的研究可以联合抑制ABCG2表达或作用的药物,以期进一步提高治疗效果。
虽然光动力治疗对乳腺癌干细胞的作用并未展现出绝对的优势,但是仍然显示了一定的疗效。其作用方式究竟是直接杀伤还是诱导凋亡?本研究认为光动力治疗对乳腺癌干细胞的抑制作用主要是通过诱导细胞凋亡来实现的。Annexin V/PI双染结果显示光动力治疗组乳腺癌干细胞凋亡率明显高于对照组。Liu等[7]选取犬乳腺癌细胞及光敏剂HMME作为研究对象,结果显示光动力治疗以诱导肿瘤细胞发生凋亡为主。此外,以其他物质作为光敏剂的光动力治疗结果也支持该结果。但是否由caspase家族始动凋亡过程,目前报道尚未达成一致。可能与选择光敏剂种类不同或细胞定位不同有关[13-16]。因此,进一步研究应当检测光敏剂细胞定位及凋亡相关因子。
综上所述,PDT对乳腺癌干细胞具有一定程度的抑制作用,但是仍然存在耐受。其抑制乳腺癌干细胞生长的机制可能与诱导细胞凋亡有关,但确切机制仍需进一步检测凋亡相关因子等来验证。耐受的原因可能与ABCG2高表达有关,可以联合相关药物以提高疗效。
1 Bonnet D,Dick JE.Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell[J].Nat Med,1997,3(7):730-737.
2Al-Hajj M,Wicha MS,Benito-Hernandez A,et al.Prospective identification of tumorigenic breast cancer cells[J].Proc Natl Acad Sci USA,2003,100(7):3983-3988.
3Lagadec C,Vlashi E,Della Donna L,et al.Survival and self-renewing capacity of breast cancer initiating cells during fractionated radiation treatment[J].Breast Cancer Res,2010,12(1):R13.
4Creighton CJ,Li X,Landis M,et al.Residual breast cancers after conventional therapy display mesenchymal as well as tumor-initiating features[J].Proc Natl Sci USA,2009,106(33):13820-13825.
5Li X,Lewis MT,Huang J,et al.Intrinsic resistance of tumorigenic breast cancer cells to chemotherapy[J].J Natl Cancer Inst,2008,100(9):672-679.
6刘慧龙,刘端祺,介雅慧,等.三种光敏剂介导的光动力疗法治疗上消化道肿瘤的疗效比较研究[J].中国激光医学杂志,2011,20(6):359-365.
7Liu Y,Ma XQ,Jin P,et al.Apoptosis induced by hematoporphyrin monomethyl ether combined with He-Ne laser irradiation in vitro on canine breast cancer cells[J].Vet J,2011,188(3):325-330.
8阴慧娟,李晓原,刘建中,等.以532nm激光为光源的HMME-PDT对人类乳腺癌细胞的杀伤作用[J].中国医学物理学杂志,2006,23(4):258-261.
9Nguyen NP,Almeida FS,Chi A,et al.Molecular biology of breast cancer stem cells:potential clinical applications[J].Cancer Treat Rev,2010,36(6):485-491.
10 An R,Hagiya Y,Tamura A,et al.Cellular phototoxicity evoked through the inhibition of human ABC transporter ABCG2 by cyclin-dependent kinase inhibitors in vitro[J].Pharm Res,2009,26(2):449-458.
11 Usuda J,Ichinose S,Ishizumi T,et al.Molecular determinants of photodynamic therapy for lung cancers[J].Lasers Surg Med,2011,43(7):591-599.
12 Bebes A,Nagy T,Bata-Csörgo Z,et al.Specific inhibition of the ABCG2 transporter could improve the efficacy of photodynamic therapy[J].J Photochem Photobiol B,2011,105(2):162-166.
13 Li B,Chu X,Gao M,et al.Apoptotic mechanism of MCF-7 breast cells in vivo and in vitro induced by photodynamic therapy with C-phycocyanin[J].Acta Biochim Biophys Sin (Shanghai),2010,42(1):80-89.
14 Vittar NB,Awruch J,Azizuddin K,et al.Caspase-independent apoptosis,in human MCF-7c3 breast cancer cells,following photodynamictherapy,with a novel water-soluble phthalocyanine[J].Int J Biochem Cell Biol,2010,42(7):1123-1131.
15 Sarrazy V,Garcia G,MBakidi JP,et al.Photodynamic effects of porphyrin-polyamine conjugates in human breast cancer and keratinocyte cell lines[J].J Photochem Photobiol B,2011,103(3):201-206.
16 Hoi SW,Wong HM,Chan JY,et al.Photodynamic therapy of Pheophorbide a inhibits the proliferation of human breast tumour via both caspase-dependent and-independent apoptotic pathways in in vitro and in vivo models[J].Phytother Res,2012,26(5):734-742.

