花生醋浸过程中蛋白质、多酚及其抗氧化性的变化
刁文睿 琚裕杰 刘小静 徐建国,
(山西师范大学生命科学学院1,临汾 041004)
(山西师范大学食品科学与工程系2,临汾 041004)
花生(Arachis hypogaeaL.)属豆科一年生草本植物,是我国重要的油料、经济作物,也是重要的出口农产品之一。花生籽仁不但含有丰富的蛋白质、脂肪及维生素、钙、磷、卵磷脂等多种营养成分,而且含有多酚、黄酮类化合物等植物化学成分,具有一定的生理活性作用[1]。在食品工业中,花生除了作为油脂油料被榨取油脂外,也常常通过蒸煮、油炸、烘烤等手段加工成一些休闲食品或风味食品[2]。醋花生是以整粒花生为原料,经食醋浸渍而成。我国民间有关于服用醋花生预防疾病的说法,它集合了大豆和食醋的营养和保健作用,使得醋花生的功效更加突出[3-4]。但关于花生在食醋浸渍过程中营养成分及生物活性成分变化的相关信息较为缺乏。本试验拟进一步分析花生在山西老陈醋浸渍过程中蛋白质、多酚物质及其抗氧化性的变化,旨在为花生的加工利用提供参考。
1 材料与方法
1.1 材料与试剂
红皮花生:农贸批发市场;山西老陈醋(总酸≥5.0 g/100 mL):山西紫林食品有限公司;DPPH(1,1-苯基-2-苦肼基自由基)、2,2-联氮-3-乙苯-二噻唑 -6磺酸(ABTS)、水溶性维生素 E(Trolox)、没食子酸:Sigma公司;Folin-Ciocalteu试剂、还原型谷胱甘肽:西安舟鼎国生物技术有限责任公司;牛血清白蛋白、考马斯亮蓝试剂G-250、三羟甲基氨基甲烷(Tris):国药集团化学试剂有限公司。
1.2 仪器与设备
5840R冷冻离心机:Gene有限公司;RE-52旋转蒸发器:上海亚荣生化仪器厂;UV-1100紫外可见分光光度计:上海美谱达仪器有限公司;SC-5A超级恒温槽:上海比朗仪器有限公司。
1.3 试验方法
1.3.1 花生的预处理
在室温(26℃)下,500 g干燥的红皮花生经挑选除杂后浸泡在1 000 mL的山西陈醋中,分别在浸泡3、5、7、10、13、17 d后取样,取出的样品在 40℃下鼓风干燥,-20℃保存直到样品分析。
1.3.2 可溶性蛋白提取及蛋白含量测定
称取样品2.0 g,粉碎,脱脂后加入25 mL 50 mmol/L Tris-HCl缓冲液(pH 7.8),混合均匀,室温下搅拌提取30 min,然后在8 000 r/min,4℃条件下离心15 min,提取2次,合并上清液即为可溶性蛋白质提取液。粗蛋白含量采用凯氏定氮法测定;可溶性蛋白含量采用考马斯亮蓝法测定,在595 nm波长处测定其吸光度值。以牛血清白蛋白为标准品作标准曲线,建立的回归方程:y=0.005 1x+0.013 1(0~100μg/mL,R2=0.994 4),式中:y为吸光度;x表示蛋白质含量,单位为μg/mL。
1.3.3 肽含量测定
肽的提取及含量测定参照文献[5]进行。称取2.0 g样品,粉碎后放入锥形瓶中,正己烷脱脂处理。干燥后加入 25 mL、0.1 mol/L Tris-HCl缓冲液(pH 8.8)提取1 h,在4℃,5 000 r/min离心15 min取上清液。上清液中加入等体积12%三氯乙酸,混合后静置30 min,在4℃,10 000 r/min离心15 min沉淀大分子蛋白质,所得上清液即为肽提取液。肽含量测定采用双缩脲法,在540 nm波长处测定其吸光度值,以还原型谷胱甘肽为标准品,建立回归方程为:y=0.511 6x+0.000 8(0~2 mg/mL,R2=0.998 1),式中:y为吸光度;x为肽含量/mg/mL。
1.3.4 多酚提取及含量测定[6]
多酚提取及含量测定参照文献[6]所述方法进行。准确称取样品2.0 g,粉碎、正己烷脱脂后用50 mL乙醇在室温下密封搅拌(250 r/min),避光提取2 h,然后在4℃,4 000 r/min的条件下离心15 min分离得到上清液,提取重复2次。合并上清液,40℃真空旋转蒸发至干,然后用乙醇复溶,定容至10 mL,即为多酚提取液,低温保存。取0.5 mL适当浓度的多酚提取液于试管中,加入0.5 mL 1.0 mol/L Folin-Ciocalteu试剂和2.5 mL去离子水,混合均匀。静置8 min后加入1.5 mL 7.5%碳酸钠溶液,密封室温下置于避光处,2 h后于765 nm处测定吸光值,以乙醇做空白,没食子酸做标准曲线,建立回归方程为:y=0.002 8x+0.004 2(0~250μg/mL,R2=0.999 6),式中:y为吸光度值;x为没食子酸浓度。多酚含量以每克干燥样品中所含的相当于没食子酸的含量进行计算。
1.3.5 DPPH自由基清除能力的测定[6]
分别取样品溶液0.5 mL和60μmol/L的DPPH乙醇溶液2.5 mL,充分混匀后于室温下密封避光静置30 min,以乙醇做空白,于517 nm下测吸光值。DPPH自由基清除率计算公式为:清除率=(A0-A1)/A0×100%,式中:A0为 0.5 mL甲醇 +2.5 mL DPPH溶液的吸光度值;A1为0.5 mL样品溶液+2.5 mL DPPH溶液的吸光度值。
1.3.6 ABTS自由基清除能力的测定
参照Jemai等[7]方法稍作修改。使用前将浓度为7 mmol/L的ABTS溶液与2.45 mmol/L过硫酸钾溶液混合,在室温、避光条件下放置16~24 h,制得ABTS+自由基溶液,用甲醇稀释至734 nm处吸光度为0.700±0.050的应用液。移取50μL适当稀释的样品溶液(控制清除率在20%~80%),加入1.9 mL的 ABTS+应用液,室温下避光反应6 min,立即测定吸光度。ABTS+自由基清除率 =(1-A1/A2)×100%,式中:A1为样品管的吸光值;A2为对照管的吸光值。以 Trolox溶液(100~1 000μmol/L)为阳性对照,绘制标准曲线,其回归方程为y=0.088 2x-5.562 2(200~1 000μmol/L,R2=0.998 2)。ABTS+自由基的清除能力结果以每100 g样品相当于Trolox的微摩尔数表示。
2 结果与分析
2.1 醋浸过程中花生蛋白的变化
花生在陈醋浸渍过程中粗蛋白和可溶性蛋白的含量变化结果见图1。由图1可以看出,随着浸渍时间的延长,花生粗蛋白含量显著地降低。浸泡第7天,花生粗蛋白质量分数降低了31.8%,此后,随着时间的延长,粗蛋白含量没有明显的变化。可溶性蛋白质量分数的变化与粗蛋白的变化相似,浸渍第7天,可溶性蛋白含量降低了30.18%,浸渍第13天可溶性蛋白降低了40.87%,此后含量没有明显变化。刘曼西等[8]在醋豆的研究中也发现了相似的结果。由此可见,醋浸过程中花生粗蛋白含量的降低主要来自于可溶性蛋白的降低,原因可能是部分可溶性蛋白溶于醋液中。除此之外,可溶性含氮物质的溶解也是其含量降低的一个原因。

图1 可溶性蛋白和粗蛋白含量的变化
2.2 醋浸过程中花生多肽的变化
花生在老陈醋浸渍过程中多肽含量的变化结果见图2。由图2可以看出,在浸渍的前3 d,花生多肽含量略有降低,其原因可能是部分肽溶于醋液中。此后,花生多肽含量显著增加,相比于未经浸渍的花生,浸渍10 d的花生,其多肽含量增加了40.8%。之后,随着浸渍时间的延长,多肽含量并没有明显的变化。花生在陈醋浸渍过程中,随着浸渍时间的增加,花生蛋白质能被醋酸水解,使得花生多肽含量增加。
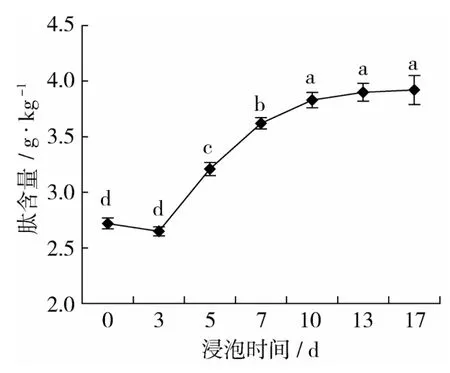
图2 花生多肽含量的变化
2.3 醋浸过程中花生多酚含量的变化
花生在老陈醋浸渍过程中多酚含量的变化结果见图3。由图3可以看出,相比于未经浸渍的花生,在浸渍的前7 d内,多酚含量降低;此后多酚含量稍有增加,在浸渍后的第10天、第13天,分别增加了15.62%和17.39%,但在浸渍后的第17天,多酚含量降低,比未经处理的花生降低了8.51%。陈芬等[9]在研究大豆时发现,醋浸能导致大豆总黄酮的含量降低。多酚含量的变化可能来自于两个方面的原因,一方面花生中的部分多酚成分溶于醋液中导致其含量的降低,另一方面,老陈醋较长时间的浸渍也会有助于花生中不溶性酚类物质的溶出,同时老陈醋中的某些多酚成分也可能渗透至花生中,这会使得醋花生的多酚含量增加,但这有待于进一步研究。
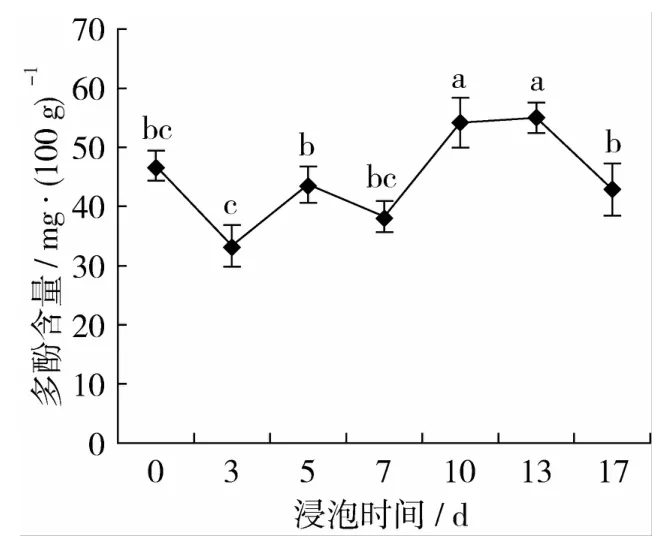
图3 花生多酚含量的变化
2.4 醋浸过程中花生多酚抗氧化性的变化
花生在老陈醋浸渍过程中多酚抗氧化性的变化结果见表1。由表1可以看出,与未经处理的花生相比,在老陈醋浸渍过程中花生多酚抗氧化性随着时间的延长而呈增加趋势。在浸渍第10天,花生多酚对DPPH、ABTS自由基的清除能力分别增加了69.5%和95.3%,此后,清除能力虽逐渐增加,但增加趋势并不明显。试验结果说明,陈醋浸渍时间对花生多酚提取物的抗氧化能力有明显的影响。一般来说,抗氧化能力与多酚含量具有较高的相关性[6,10-12],但在本试验中,这一相关性并未发现。因此,醋浸过程中抗氧化性的增加很可能与花生多酚组成成分的变化有关。

表1 多酚提取物抗氧化性的变化
3 结论
试验结果表明,花生在山西老陈醋浸渍过程中,粗蛋白、可溶性蛋白含量显著降低;多酚含量的变化较为复杂,但总体上呈降低趋势,而多肽含量在陈醋浸渍过程中呈增加趋势;花生多酚提取物对DPPH、ABTS自由基的清除能力在浸渍前期显著增加,而到浸渍后期趋于稳定。从试验结果来看,经老陈醋浸渍后的花生可消化程度得到提高,同时也提高了其抗氧化性,这对人体的营养和健康有着重要的影响。
[1]姚云游,乔玉兰.花生功能成分及营养价值的研究进展[J].中国油脂,2005,30(9):31-33
[2]Chukwumah Y,Walker L,Vogler B,et al.Changes in the phytochemical composition and profile of raw,boiled,and roasted peanuts[J].Journal of Agricultural and Food Chemistry,2007,55(22):9266-9273
[3]张桂英,王宝贵,刘娅,等.醋花生、食醋的降血脂作用比较[J].吉林大学学报,2003(6):58-61
[4]程小萍,李爱荣.醋浸后花生脂肪酸的变化及其营养学意义[J].湖北职业技术学院学报,2005,8(4):74-76
[5]徐建国,郝艳芳,介琳霞,等.天然燕麦肽的提取工艺优化及生物活性初探[J].中国粮油学报,2012,27(1):20-24
[6]Xu JG,Tian CR,Hu Q P,et al.Dynamic changes in phenolic compounds and antioxidant activity in oats(Avena nudaL.)during steeping and germination[J].Journal of Agricultural and Food Chemistry,2009,57:10392-10398
[7]Jemai H,Bouaziz M,Sayadi S.Phenolic composition,sugar contents and antioxidant activity of Tunisian sweet olive cultivar with regard to fruit ripening[J].Journal of Agricultural and Food Chemistry,2009,57:2961-2968
[8]刘曼西,陈芬.醋浸后大豆成分的变化及其营养学意义[J].食品与发酵工业,2004,30(2):66-71
[9]陈芬,万国华,徐国海.醋浸后大豆异黄酮的变化及其营养学意义[J].湖北职业技术学院学报,2005,8(4):71-73
[10]Zielinski H,Kozlowska H.Antioxidant activity and total phenolics in selected cereal grains and their morphological fractions[J].Journal of Agricultural and Food Chemistry,2000,48,2008-2016
[11]Adom K K,Liu R H.Antioxidant activity of grains[J].Journal of Agricultural and Food Chemistry,2002,50:6182-6187
[12]Xu J-G,Hu Q-P,Wang X-D,et al.Changes in the main nutrients,phytochemicals,and antioxidant activity in yellow corn grain during maturation[J].Journal of Agricultural and Food Chemistry,2010,58:5751-5756.

