转基因水稻Bt63的外源基因相对含量分析
孙长坡 邓婷婷 伍松陵 路子显
(国家粮食局科学研究院1,北京 100037)
(中国检验检疫科学研究院食品安全研究所2,北京 100025)
转基因水稻研究始于1988年,日本东北大学的Toriyama等[1]和英国诺丁汉大学的 Zhang等[2]分别以水稻原生质体为材料,利用电击法获得了水稻再生植株。同时,美国康乃尔大学的Zhang等[3]以水稻原生质体为材料,利用PEG介导法获得了水稻再生植株。1991年,Christou等[4]利用基因枪法转化水稻取得成功,随后,这种转化方法成为水稻遗传转化的常规方法之一。1993年,我国台湾Chan等[5]采用农杆菌介导法获得转基因水稻。1994年,日本的Hiei等[6]利用水稻成熟种子诱导的愈伤为受体,建立了农杆菌介导的粳稻高效转化体系。Hiei等[7-8]在2006年和2008年先后改进了这个高效转化体系,使农杆菌介导法变成水稻遗传转化的最常用方法。
Tu等[9]在 2000年将转cry1Ab/Ac融合基因水稻进行田间试验,在不喷洒杀虫剂条件下,发现转抗虫基因水稻对二化螟、三化螟和稻纵卷叶螟具有高度杀伤作用。曾千春等[10]把cry1Ac基因导入籼稻明恢81获得抗虫纯合系。Ghareyazie B等[11]将cry1Ab/2A转化水稻,发现转基因水稻对二化螟、三化螟和稻纵卷叶螟高度杀伤力。
转基因水稻中外源基因拷贝数的研究方法很多,其中Southern Blot方法[12]是最常用的转基因植株的外源基因拷贝数分析方法,其他方法还有CGH,FISH[13]和 Micro array[14]等。但是,这些方法存在不足之处如下:需要DNA量多、量大、费时、使用放射性同位素、发生重排的外源基因测定不准确等。随着转基因的谷物的种植和流通,转基因成分的检测和监测技术研究也不断发展和创新。一种快速、敏捷和高效的实时荧光定量PCR技术已经受到越来越广泛的应用。2009年,我国农业部为转基因水稻Bt63颁发了生物安全证书,其抗虫能力与外源基因的拷贝数密切相关。本研究之目的是利用实时荧光定量PCR技术,分析不同的转基因稻米Bt63的外源基因相对含量,为建立转抗虫基因水稻抗虫能力评价体系和转基因稻谷进入粮食流通渠道提供检测和监测技术。
1 材料与方法
1.1 材料与设备
1.1.1 试验材料
待测样品(转基因Bt63稻米粉末)U1和U2各1 g/瓶,校准品(质粒DNA含有目的基因)1瓶,内源标准基因上下游引物(RBE-4-F和RBE-4-R)与内源标准基因探针(RBE-4-MGB-P)各1支,外源基因上下游引物(Bt63-F和Bt63-R)与外源基因探针(Bt63-P)各1支,以上材料均由中国计量科学研究院提供。
1.1.2 试验试剂
植物基因组DNA提取试剂盒:天根生化科技(北京)有限公司。TaqMan®2×PCR Mater Mix:罗氏公司。
1.1.3 试验仪器
实时定量PCR分析系统(7900HT快速实时PCR系统);DNA浓度测定仪器为Nanodrop 1000分光光度计(热科学基因有限公司)。
1.2 试验方法
1.2.1 转基因水稻基因组DNA提取
根据试剂盒操作手册提取和纯化待测样品(转基因Bt63稻米粉末)U1和U2的DNA。利用DNA浓度测定仪器测定DNA含量。
1.2.2 Taqman探针法反应条件
外源基因PCR反应体系25μL,其中2×Taqman Universal MasterMix缓冲液12.5μL,10μmol/L上下游引物各1μL,10μmol/L外源基因探针 0.5μL,DNA模板(<30 ng/μL)5μL。内源基因PCR反应体系也是25μL,其中2×Taqman Universal MasterMix缓冲液12.5μL,10μmol/L上下游引物各0.5μL,10μmol/L内源基因探针 0.25μL,DNA模板(<30 ng/μL)5μL。反应条件:50℃,2 min;95℃,10 min;40个循环(95℃,15 s;60℃,60 s)。ABI Prism®7900型荧光定量PCR仪在60℃复性和延伸时收集荧光信号。
1.2.3 标准曲线的建立及数据分析
外源基因的标准曲线的制作是将带有目的基因的质粒 DNA按10、100、1 000、10 000和100 000倍稀释,并以这些稀释的DNA为模板进行PCR反应,得到各自的Ct值,通过Ct值与起始模板数的对数值之间存在的线性关系,获得标准曲线。水稻内源的标准曲线的制作是以基因组 DNA做100、1 000、10 000、100 000和1 000 000倍稀释,用与外源基因标准曲线相同的方法获得。
2 结果与分析
2.1 标准曲线的制作
2.1.1 内源标准曲线
RBE-4基因的标准曲线如图1所示:RBE-4基因的标准曲线的相关系数R=0.996 6,说明已经满足了荧光定量的标准曲线的精度要求。该基因Ct值与起始模板之间的相关性方程为:y=2.734 3x+41.268,方程式中y代表Ct值,x代表log COPY。

图1 RBE-4基因real-time PCR标准曲线
2.1.2 外源标准曲线
Bt63基因的标准曲线如图2所示:Bt63基因的标准曲线的相关系数R=0.995 4,说明相关性很高。该基因Ct值与起始模板之间的相关性方程为:y=-2.326 0x+39.319,方程式中y代表Ct值,x代表log COPY。
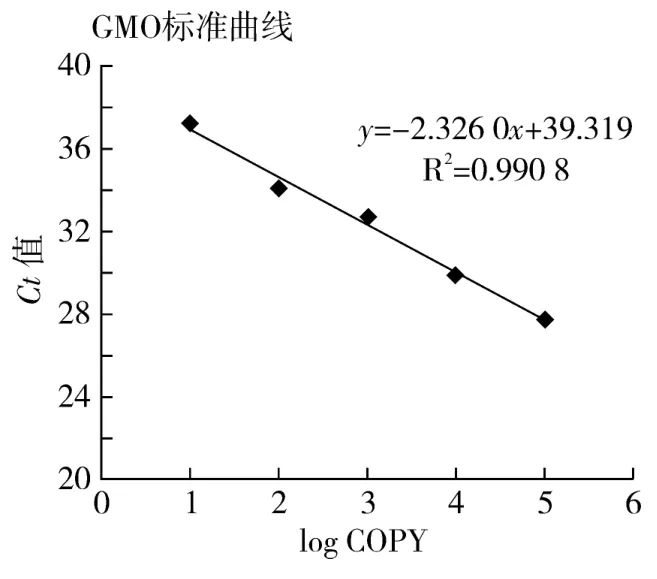
图2 Bt63基因(B)real-time PCR标准曲线
2.2 转基因水稻Bt63的内外源基因的Ct值
在本试验中,对两个不同的转基因样品U1和U2分别进行3次荧光定量PCR反应,每次设3个重复。获得样品的Ct值如表1。

表1 RBE-4基因和Bt63基因在U1和U2中的Ct值

表2 RBE-4基因和Bt63基因在U1中拷贝数和比值

表3 RBE-4基因和Bt63基因在U2中拷贝数和比值
从表1可知,在内外源基因之间,外源基因(Bt63)Ct值高于内源基因(RBE-4)Ct值。在 U1和U2样品之间,虽然二者的内源基因(RBE-4)Ct值差异不显著,但是,U1的外源基因(Bt63)Ct值高于U2的外源基因(Bt63)Ct值。
2.3 转基因水稻Bt63的内外源基因的拷贝数
根据内外源基因的标准曲线方程,计算出它们各自对应的基因拷贝数,进一步计算出外源基因在两个转基因水稻中的相对含量见表2和表3。
从表2中数据算出:U1的外源基因平均含量为0.28%,SD为0.001 4,RSD为0.498 1。
从表3中数据算出:U1的外源基因平均含量为0.018%,SD为0.009 8,RSD为0.544 4。
3 讨论
随着国内外转基因水稻的商品化步伐提速和我国对转基因粮油及其制品的进口规模的加大,相应的外源基因含量检测技术的研究也不断深入。最近几年,我国利用实时荧光定量PCR技术在转基因水稻的外源基因拷贝数或含量研究上正方兴未艾。杨立桃等[15]比较了实时荧光定量PCR和Southern blot两种技术在水稻转GUS和HPT基因拷贝数研究中的差异,发现实时荧光定量 PCR的分析结果与Southern blot分析结果基本一致,仅个别样品稍高。然而,利用外标准曲线的实时荧光定量PCR是迄今为止定量最准确,重现性最好的定量方法。因此,实时荧光定量PCR方法已得到全世界的公认,广泛用于基因表达研究、转基因研究,药物疗效考核、病原体检测等诸多领域。王育花等[16]通过SYBR实时荧光定量PCR法检测了转基因水稻中NAS1的拷贝数。林波等[17]利用实时荧光定量PCR技术测定了不同转基因水稻中Bar和CaMV35S相对含量。敖金霞等建立了检测转基因水稻深加工产品的外源基因的TaqMan和SYBR Green I方法的定量检测技术,两者的检测灵敏度均达到0.01%[18]。
针对转基因水稻Bt63检测技术的研究目前鲜见报道。我们的研究结果表明:两个转基因Bt63稻米样品U1和U2的外源基因含量存在一定的差异。由于本次试验样品较少,仅重复3次,不仅U1和U2的内源基因Ct值没有很好落在内标曲线上,而且U2的外源基因Ct值也没有很好落在外标曲线上。这些问题将在以后的试验中加以改进和提高。
通过荧光定量PCR技术能够完成转基因成分的定量分析。2009年11月27日 ,农业部批准发放转基因抗虫水稻“华恢1号”和“Bt汕优63”安全证书。虽然尚未允许商业化生产,但提前研究和开发相应的检测技术将为转基因稻谷进入流通行业储备技术支持。
4 结论
本试验较早地利用荧光定量PCR技术研究了两个转基因Bt63稻米样品U1和U2的外源基因含量,发现它们的外源基因含量存在显著差异。这项研究的继续深入将为建立转基因水稻抗虫能力评价体系和转基因稻谷进入粮食流通渠道提供检测和监测技术基础。
志谢:感谢中国检验检疫科学研究院食品安全研究所陈颖研究员和黄文胜研究员给予的帮助。感谢中国计量科学研究院董莲华博士、隋志伟和李亮提供转基因水稻样品(稻米粉末)和有关生物试剂。
[1]Toriyama K,Arimotoa Y,Uchimiyaa H,et al.Transgenic riceplants after direct gene transfer into protoplasts[J].Nature Biotechnology,1988,6:1072-1074
[2]Zhang HM,Yang H,Rech EL.Transgenic rice plants produced by electroporation-mediated plasmid uptake into protoplasts[J].Plant Cell Report,1988,7:379-384
[3]Zhang W,Wu R.Efficient regeneration of transgenic plants from rice protoplasts and correctly regulated expression of foreign gene in the plants[J].Theory Application Genetics,1988,76:835-840
[4]Christou P,Ford T,Kofron M.Production of transgenic rice(Oryza SativaL.)plants from agronomically important indica and japonica varieties via electric discharge particle acceleration of exogenous DNA into immature zygotic embryos[J].Nature Biotechnology,1991,9:957-962
[5]Chan MT,Chang HH,Ho SL.Agribacterium mediated production of transgenic rice plants expressing chimericα-amylase promoter/β-glucuronidase gene[J].Plant Molecular Biology,1993,22:491-506
[6]Hiei Y,Ohta S,Komari T,et al.Efficient transformation of rice(Oryza SativaL.) mediated by Agribacterium and squence analysis of the boundaries of T-DNA[J].Plant Journal,1994,6:271-282
[7]Hiei Y,Komari T.Improved protocols for transformation of indica rice mediated by Agribacterium tramefaciens[J].Plant Cell Tissue Organ Culture,2006,85:271-283
[8]Hiei Y,Komari T.Agribacterium-mediated transformation of rice using immature embryos or calli induced from mature seed[J].Nature Protocol,2008,3:824-834
[9]Tu J,Zhang G,Datta K,et al.Field performance of transgenic elite commercial hybrid rice expressing bacillus thuringiensis delta-endotoxin[J].Nature Biotechnology,2000,18(10):1101-1104
[10]曾千春,吴茜,周开达,等.修饰的cry1Ac基因导入籼稻明恢81获得抗虫纯合系[J].遗传学报,2002,29:519-524
[11]Ghareyazie B,Alinia F,Menguito C A,et al.Enhanced resist-ance to two stem borers in an aromatic rice containing a synthetic cry1A(b)gene[J].Molecular Breed,2009,3:401-414
[12]Gendloff EH,Bowen B,Buchholz WG.Quantitation of chloramphenicol acetyl transferase in transgenic tobacco plants by ELISA and correlation with gene copy number[J].Plant Molecular Biolology,1990,14(4):575-83
[13]Thompson CT,Gray JW.Cytogenetic profiling using fluorescence in situ hybridization(FISH)and comparative genomic hybridization(CGH)[J].Journal of Cell Biochemstry Supplement,1993,17G:139-43
[14]Bilke S,Chen QR,Whiteford CC,et al.Detection of low level genomic alterations by comparative genomic hybridization based on cDNA micro-arrays[J].Bioinformatics,2005,21(7):1138-45
[15]杨立桃,赵志辉,丁嘉羽,等.利用实时荧光定量PCR方法分析转基因水稻外源基因拷贝数[J].中国食品卫生杂志,2005,17(2):140-144
[16]王育花,赵森,陈芬,等.利用实时荧光定量PCR方法检测转基因水稻外源基因拷贝数的研究[J].生命科学研究,2007,11(4):301-305
[17]林波,谭支良,肖国樱,等.稻谷中转Bar基因水稻含量的实时荧光定量检测[J].农业现代化研究,2008,29(5):618-621
[18]敖金霞,高学军,权东升,等.转基因水稻深加工产品两种荧光定量方法的比较研究[J]东北农业大学学报,2011,42(1):34-39
[19]EC Regulation 1998/11391 Council Regulation(EC)No 1139/98 of 26 May 1998 Concerning the Compulsory Indication of the Labeling of Certain Foodstuffs Produced from Genetically Modified Organisms of Particulars other than Those Provided for in D79/112/EEC1 Brussels,Belgium 1L159:4-7.

