ADMA/DDAH 通路在脑缺血再灌注致肺微血管内皮细胞损伤中的作用
吴云虎,王殿华
ADMA/DDAH 通路在脑缺血-再灌注机制中研究较多,但在脑缺血-再灌注致肺损伤中对PMVECs通透性的作用机制仍未见有报道。本研究探讨ADMA/DDAH 通路调控PKCα 和MCK 蛋白表达对PMVEC 的影响,进一步揭示ADMA/DDAH 通路在脑I/R 致ALI 中的机制。
1 材料与方法
1.1 材料 实验动物:雌雄各半SD 大鼠36只,每体重200~260g,购自广西医科大学实验动物中心。主要试剂:ADMA 标准品购自Sigma 公司;MTT 试剂购自Biomol 公司;逆转录试剂盒购自美国Promega 公司;2×Taq PCR MasterMix 购自北京天根生化科技有限公司;RIPA 裂解液、PKC 和MLCK 蛋白浓度测定试剂盒购自江苏碧云天公司;RT-PCR试剂盒,批号:9440-94A。
1.2 方法
1.2.1 大鼠脑缺血再灌注模型的建立 参照Zea-Longa 改良线栓法制作大脑中动脉缺血模型(MCAO);参照Zea-Longa 大鼠神经功能缺损评分标准对MCAO 进行评分。
1.2.2 脑缺血再灌注损伤大鼠血清的采集各组大鼠按设定处死时间,以氯胺酮麻醉后颈动脉置管,取1.0ml 血置于柠檬酸抗凝管摇匀,3000 转/min 离心,留取上清。分为灭活血清组和非灭活血清组处理:选用与血清瓶同规格的对照瓶一个,对照瓶内放入与血清等体积的水,调节水浴箱温度控制钮,使温度保持在56℃,定时30min 进行血清灭活,灭活后-20℃~-70℃保存。
1.2.3 大鼠PMVECs 的培养 取体健康雄性Wistar 大鼠1 只,麻醉固定后,取出肺脏至DMEM 培养液中,切割至约1mm3大小的组织块,均匀放置在25ml 培养瓶中,静置培养60h 后去除组织块,于80%~90%细胞单层汇合时用0.25%胰蛋白酶消化后1∶2 传代。
1.2.4 细胞传代 当EC 对数生长至细胞密度达80%左右传代,用D-Hank’s:液漂洗3 次,加0.25%胰养蛋白酶1ml 于瓶中,使细胞充分接触消化液,用吸管吹打细胞悬液,将此瓶细胞悬液分成二份加入新瓶中,放入培养箱中继续培养。以下实验采用2~5 代细胞进行。
1.2.5 实验分组 将大鼠PMVECs 放在100ml 培养瓶内,待80%单层汇合时进行实验,随机分为5 组:正常细胞组、正常灭活血清组、正常非灭活血清组、模型灭活血清组、模型非灭活血清组、ADMA 干预组和DDAH 抑制剂干预组。以上各组在培养箱中孵育4h,检测各项指标。
1.2.6 RT-PCR 法检测PKC 和MLCK mRNA的表达 按Trizol 法提取总mRAN,按照一步法RTPCR 试剂盒说明书操作,获得目的基因DNA 片段。引物序列:上游引物 5’-TGTCCAAAACCTACCCCACCATAT-3’,下游引物5’-CCCTTCTTACATCAGCCCTACTG-3’,扩增片段为73bp 大小(引物合成由日本TaKaRa 公司合成)。琼脂糖凝胶电泳检测扩增产物,Gel-Doc 紫外凝胶成像分析系统计算各条带的灰度值。
1.2.7 Western blot 检测细胞PKC 和MLCK 的表达 在细胞培养瓶中在37℃,5%CO2条件下培养,当细胞密度近80%时,oxLDL 刺激6h 后加不同试剂,培养40min 检测信号蛋白表达,12h 后检测PKCα 和MLCK 表达,用PBS(pH7.4)洗3 遍,加入0.5ml RIPA buffer,用细胞刮子将细胞刮下来,放到1.5ml 的EP 管中,冰上放置30min;在超速冷冻离心机中14000rpm 离心20min,保留上清;用Lorry 法对不同的细胞裂解产物定量其总蛋白浓度;按1∶1的比例加入2×蛋白上样缓冲液,沸水煮5min;SDSPAGE 电泳125g/L 使用聚丙烯酰胺凝胶。封闭液在室温下封闭1h,加入抗myc 抗体4℃过夜。加入辣根过氧化物酶标记的抗兔IgG 抗体形成免疫复合物,DAB 显色后摄像。
1.2.8 MTT 法细胞增殖/抑制活性测定 取经不同浓度处理24h 的细胞孔,加入体积分数为0.05g/L MTT 10μl/孔继续培养4h,取板,吸尽上清,各孔加DMSO 100μl,室温避光震荡10min,读取A492 值(OD)/孔。依据实验分组,对各干预组测定3 个平行孔A490 值(OD),细胞增殖率(%)=[实验组490A 值(OD)/正常对照组490A 值(OD)]×100%,其结果均以增殖指数>100% 表示细胞刺激增殖作用。同样方法测定A570 值(OD)。
2 结果
2.1 PMVEC 中PKCα、MLCK 蛋白的表达 实验结果显示:与其余3 组比较,模型灭活血清组、模型非灭活血清组和ADMA 组PMVEC 中PKCα 和MLCK 蛋白水平明显升高(P<0.05),差异有统计学意义,其余3 组之间PKCα 和MLCK 蛋白水平比较差异无统计学意义(P>0.05)(见表1、图1)。
2.2 PMVEC 中PKCα、MLCK mRNA 的表达实验结果显示:与其余3 组比较,模型灭活血清组、模型非灭活血清组和ADMA 组PMVEC 中PKCα、MLCK mRNA 表达明显升高(P<0.05),差异有统计学意义,其余3 组之间PKCα 和MLCK 蛋白水平比较差异无统计学意义(P>0.05)(见表2、图2)。
2.3 PMVEC 细胞增殖活性 与其余4 组OD值(λ=490 波长)比较,模型灭活血清组和ADMA组有统计学意义(P<0.05),细胞代谢活力显著降低;与ADMA 组相比较,DDAH 组OD 值显著增高,细胞代谢活力显著增强(P<0.05),差异有统计学意义(见表3)。
表1 PMVEC 中PKCα、MLCK 蛋白表达灰度值(±s)
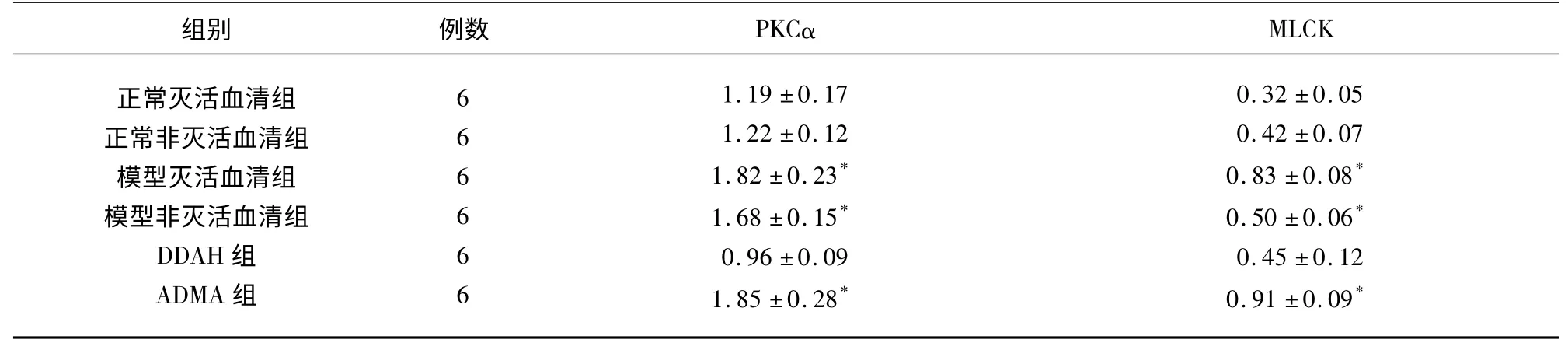
表1 PMVEC 中PKCα、MLCK 蛋白表达灰度值(±s)
与正常灭活血清组、正常非灭活血清组和DDAH 干预组比较* P<0.05
表2 PMVEC 中PKC、MLCK mRNA 表达灰度值(±s)
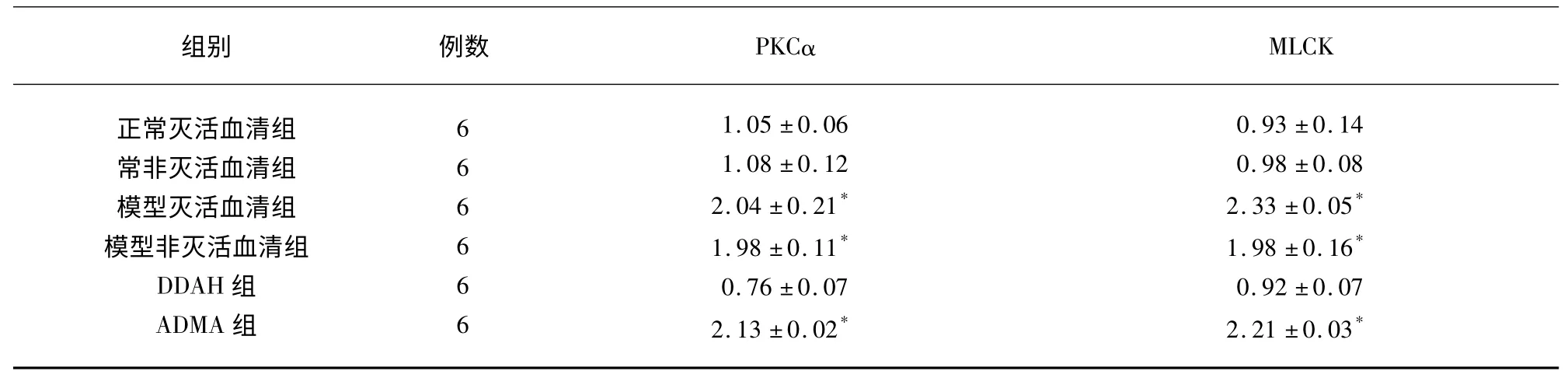
表2 PMVEC 中PKC、MLCK mRNA 表达灰度值(±s)
与正常灭活血清组、正常非灭活血清组和DDAH 干预组比较* P<0.05
表3 各组的细胞增殖(±s)
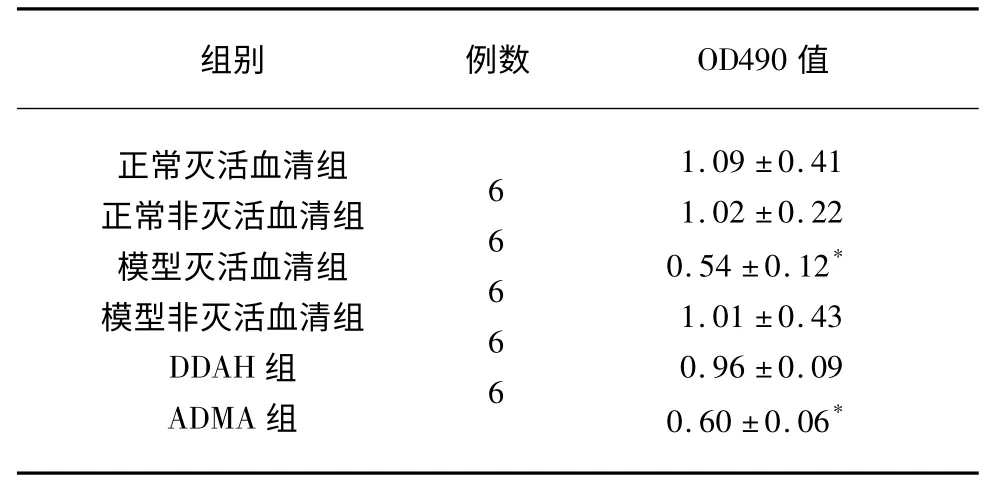
表3 各组的细胞增殖(±s)
与其余4 组比较* P<0.01
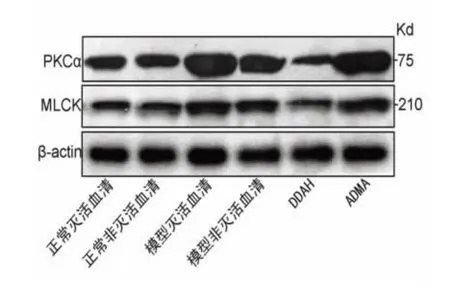
图1 脑I/R 损伤致ALI 细胞模型中PMVEC 中PKCα、MLCK 蛋白表达。与正常灭活血清组、正常非灭活血清组和DDAH 干预组比较* P<0.05

图2 脑I/R 损伤致ALI 细胞模型中PMVEC 中PKCα、MLCK mRNA 表达。与正常灭活血清组、正常非灭活血清组和DDAH 干预组比较* P<0.05
3 讨论
新近研究证实[1,2]ADMA/DDAH 通路在体内多个器官的细胞中存在,该通路参与多种生理和病理过程,在许多疾病的发生发展中起重要作用。
ADMA 在蛋白精氨酸甲基转移酶(protein arginine methytransferases,PRMT)作用下,以S-腺苷甲硫氨酸(S-adenosylme-thionine,SAM)为甲基供体,使各种多肽中的L-精氨酸残基甲基化,甲基化的蛋白质水解以后产生。ADMA 的主要降解及排泄系统是在二甲基精氨酸二甲氨水解酶(dimethylargininedimethy laminohydrolase,DDAH)作用下分解为瓜氨酸和二甲胺经肾脏排出,所以PRMT 及DDAH 控制着ADMA 在体内的浓度,ADMA 的代谢途径即ADMA/DDAH 通路[3,4]。研究发现,有多种细胞能生成ADMA,包括血管内皮细胞,健康人血浆中ADMA 的浓度为(1.15±0.13)μmol/L,内皮细胞中的精确浓度尚未得知,但细胞内ADMA 的浓度大约是培养液中的8~12 倍[5,6]。
ADMA 是内源性NOS 抑制剂。大量的研究证实ADMA 能竞争性抑制NOS,阻止NO 合成,增加氧自由基的生成和引发血管炎症。近年来的研究发现ADMA 聚集是内皮功能不全的一个重要原因,其增高预示心血管疾病的患病风险和死亡率增高[7]。DDAH 的表达增强可以起到抑制ADMA 生成的作用,使用维甲酸上调DDAH 表达可以使血管内皮细胞ADMA 表达减少,含量下降,NO 合成增加。因此,DDAH 是一种比较理想的血管保护因子,ADMA/DDAH 通路可能在氧化应激反应和内皮保护作用之间产生有意义的影响,合理调整DDAH 含量,增强其表达,抑制ADMA 含量的增加,降低其表达,可以对缺血再灌注损伤起到很好的保护作用[8,9]。
PKC 的持续高表达和异常激活是导致肺微血管内皮细胞形态学变化的最主要原因。PKC 激活后对肌动蛋白肌丝相关蛋白进行磷酸化,并能够使肌球蛋白ATP 酶活性增加,从而使肌动蛋白和肌球蛋白相互结合维持持续的肌丝的收缩[10];PKCα 亦可参与促进丝裂素活化蛋白激酶(MAPK)的激活过程,而MAPK 的激活在维持平滑肌的持续收缩和胶原纤维增生中起重要作用[11];另外,PKCα 还可通过调节蛋白酪氨酸激酶(PTK)Rho 蛋白的磷酸化来调节肌丝的收缩[12];MLCK 介导了血管内皮细胞的损害,导致通透性增加,引起血管内皮细胞间隙的形成和屏障功能障碍[13]。
经ADMA 干预后,MLCK 的蛋白表达进一步增强,提示ADMA 可以增加内皮细胞通透性,导致MLCK 活性不断升高,MLCK 催化MLC 磷酸化程度加大,导致EC 的向心性收缩增强,细胞间隙形成程度加大,从而在一定程度上加重了氧化应激反应和炎症反应的发展。经过DDAH 干预后,血管内皮细胞的渗透程度有所下降,细胞的通透性得到修复,内膜增厚,此修复的结果使得MLCK 的蛋白表达和蛋白含量明显下降,并能降低MLCK 的转录,阻止缺血再灌注肺损伤的进一步发展,在一定程度上起到了肺保护的作用。
本部分研究主要发现:体外培养的PMVEC 在给予脑缺血-再灌注大鼠灭活的血清和外源性ADMA干预后,由于PMVEC 培养液中ADMA 含量增高,PKCα、MLCK 蛋白和mRNA 表达增加,细胞增殖和生长明显下降。这些发现提示ADMA/DDAH 通路在脑缺血-再灌注损伤所致ALI 可能起着重要作用,可以作为防治缺血再灌注药物新的潜在的干预靶点,研究药物干预ADMA 的生成代谢,干预ADMA/DDAH 系统,上调DDAH 的表达,抑制ADMA 的生成,因此推测药物干预ADMA 的代谢或将是防治缺血再灌注疾病导致ALI 的一个新的治疗目标。
[1]Antohe F.Endothelial cells and macrophages,partners in atherosclerotic plaque progression[J].Arch Physiol Biochem,2006,112(4):245-253.
[2]Kharitonova MA,Levina CM,Rovenskii IA.Cytoskeletal control of cell length regulation[J].Ontoqenez,2002,33(1):50-59.
[3]Benz PM,Blume C,Moebius J,et al.Cytoskeleton assembly at endothelial cell-cell contacts is regulated by alphaII-spectrin-VASP complexes[J].Cell Biol,2008,180:205-219.
[4]Mellor H,Parker P.The extended protein kinase C superfamily[J].Biochem,1998,332:281-292.
[5]Ron D,Kazanietz MG.New insight into the regulation of protein kinase C and novel phorbol cster receptors[J].FASEB,1999,13:1658-1678.
[6]Furman,C,Sieminski AL,Kwiatkowski A,et al.Ena/VASP is required for endothelial barrier function in vivo[J].Cell Biol,2007,179:761-775.
[7]Stull JT,Kamm KE,Krueger JK,et al.Ca2+/calmodulin-dependent myosin light chain kinases[J].Adv Second Messenger Phosphoprotein Res,1997,31:141-150.
[8]Klinger JR,Warburton R,Carino S,et al.Natriuretic peptides differentially attenuate thrombin-induced barrier dysfunction in pulmonary microvascular endothelial cells[J].Exp Cell Res,2006,15:401-410.
[9]陈 铎,石玉秀,西泽茂,等.实验性脑血管痉挛中PKC 活性表达及其意义[J].中国医科大学学报,2000,29:91-93.
[10]Boushey CJ,Beresford SAA,Omen GS,et al.A quantitative assessment of plasma homocysteine as a risk factor for vascular disease[J].JAMA,1995,274:1049-1053.
[11]Schlegel N,Burger S,Golenhofen N,et al.The role of VASP in regulation of cAMP-and Rac 1-mediated endothelial barrier stabilization[J].Am Physiol Cell Physiol,2008,294:178-188.
[12]Wojciak-Stothard B,Torondel B,Tsang LY,et al.The ADMA/DDAH pathway is a critical regulator of endothelial cell motility[J].Cell Sci,2007,120:929-942.
[13]Kwiatkowski A.Pressure-related increase of asymmetric dimethylarginine caused by hyperbaric oxygen in the rat brain:a possible neuroprotective mechanism[J].Cell Biol,2009,171:762-778.

