EPO 干预后大鼠脑缺血再灌注区域STAT1 和STAT3 蛋白表达与细胞凋亡
姜春娟,许 倩,徐 凯,代海洋,吴文娟,张追阳
缺血性脑血管病以其高发病率、高死亡率、高致残率严重危害人类身心健康。脑缺血再灌注损伤是缺血性脑血管病重要的病理生理过程。我们探讨信号转导与转录激活子(signal transducer and activator of transcription,STAT)在这一过程中的作用。STATs参与细胞生长、转化、凋亡等生理功能的调节[1]。STATs 在脑缺血再灌注过程中被激活,以其磷酸化的形式(phosphorylated STAT,P-STAT)发挥相应的生物学作用[2]。STATs 家族包括7 种转录因子,但不同的STATs 在脑缺血再灌注损伤中起到不同的作用,脑缺血再灌注损伤可以激活STAT1、STAT3。STAT1 与脑缺血再灌注后神经细胞死亡有关,其作用机制包括诱导神经细胞凋亡和激活其他细胞死亡基因等。STAT3 通过营养因子和细胞因子与脑缺血再灌注后神经保护作用相关[3]。
研究表明,EPO 对神经细胞具有营养和抗凋亡的双重作用[4]。EPO 的神经保护作用已经在动物脑缺血模型、机械性损伤、刺激性毒性损伤、神经炎和1,2,3,6-tetrahydropyridine 诱导的老鼠的帕金森病中所证实[5]。而Kretz 等[6]发现EPO 发挥脑保护作用的靶点为STAT3。我们建立大鼠局灶性脑缺血再灌注损伤模型,观察EPO 对脑缺血再灌注损伤区STAT1、STAT3 及其磷酸化水平的表达与脑梗死体积及细胞凋亡的影响。
1 材料和方法
1.1 研究对象 雄性Sprague Dawley(SD)大鼠120 只,体重300~330g,由江苏省徐州医学院动物中心提供。动物完全随机分为4 组,分别为A 假手术组、B 单纯脑缺血再灌注组、C 脑缺血再灌注+生理盐水组和D 脑缺血再灌注+EPO 组,每组30只动物,B、C、D 组均缺血2h 和再灌注24h。
1.2 主要试剂 TTC 染色试剂盒购自Biosharp 公司,Western blot 检测试剂盒购自美国Upstate Biotechnology,Inc,免疫组织化学STAT1 抗体及磷酸化STAT1 抗体购自Bioworld Technology 公司,STAT3 抗体及磷酸化STAT3 抗体购自Cell Signalling 公司,原位细胞凋亡检测试剂盒(TUNEL)购自美国罗氏公司,重组人促红细胞生成素注射液购自沈阳三生制药有限公司。
1.3 动物模型制备 采用改良的Longa 法[7]将SD 大鼠制成一侧大脑中动脉阻断(MCAO)模型。用10%水合氯醛(30mg/kg)麻醉大鼠,颈部正中切口,手术显微镜下分离左侧颈总动脉、颈内动脉和颈外动脉,动脉夹夹闭颈内动脉,在距颈总动脉0.8~1.0cm 处结扎颈外动脉,将处理过的线栓从小口分叉处轻轻推入颈内动脉,当线插入距颈总动脉分叉17.5~18.5mm 处并有轻微阻力时,表示线已经插入Willie’s 环大脑中动脉起始部,阻塞了大脑中动脉主干的血流,活结结扎颈内动脉内的线栓。术后切口缝合包扎,大鼠放回笼内给予食物及水源,用灯泡保持大鼠体温在37℃左右。2h 时拔线,再灌注24h 时进行后处理。假手术组将线栓插入5mm,其余步骤同脑缺血再灌注组。D 组于脑缺血刚开始时腹腔注射EPO(5000IU/kg),C 组腹腔注射等量0.9%生理盐水。
1.4 TTC 染色 各组动物缺血2h 再灌注24h后立即断头取脑,于-20℃冰箱中速冻20min,冠状位切成2mm 厚的切片,置于2% 的TTC 溶液中,37℃避光染色30min,每隔5min 翻动脑片使均匀接触到染色液,4%多聚甲醛固定24h。染色后,正常脑组织呈鲜红色,梗死脑组织呈白色。数码相机拍照后输入计算机,用病理图像分析系统计算测量TTC 失染区体积。为了降低因脑水肿所产生的误差,通过以下公式进行校正,梗死体积=对侧半球体积-梗死侧正常脑组织体积。
1.5 Western blot 分析 大鼠断头取脑,迅速分离缺血区脑组织,抽提并测量蛋白,等量蛋白样品经10%SDS-聚丙烯凝胶电泳分离后,以湿转法电转移至NC 膜上,用新鲜配制的含3%脱脂奶粉的PBS液封闭,将STAT1 兔多克隆抗体(1∶500)、P-STAT1兔多克隆抗体(1∶500)、STAT3 兔多克隆抗体(1∶1000)、P-STAT3 兔多克隆抗体(1∶1000)及βactin 抗体(1∶1000)稀释在新鲜配制的含3%脱脂奶粉的PBS 液中,4℃过夜后,加入相应的二抗。以NBT-BCIP 显色,结果以Image J 图像分析软件分析条带,测相对灰度值(rOD),计算公式为相对灰度值(rOD)=缺血的ROI 的OD 值/假手术组OD 值。
1.6 免疫组织化学染色(SP 法)石蜡切片常规脱蜡至水,在柠檬酸盐缓冲液(pH6.0)中微波修复10~15min,自然冷却至室温,PBS 洗3 次,3%过氧化氢37℃孵育10min 以阻断内源性过氧化物酶活性,PBS 冲洗3 次,滴加正常山羊血清封闭抗原25min,加入STAT3 抗体(1∶100)、P-STAT3 抗体(1∶50),4℃孵育过夜,PBS 冲洗3 次,滴加生物素标记羊抗兔37℃孵育25min,滴加辣根酶标记链霉卵白素工作液,DAB 显色,苏木精复染、脱水、透明、封片。阴性对照用0.01mol/L PBS 代替一抗。光镜下观察,以胞浆或胞核染成棕色的细胞为阳性细胞。
1.7 细胞凋亡检测 采用TUNEL 原位细胞凋亡检测试剂盒,大鼠脑组织固定后,用proteinase K工作液处理组织,加入TUNEl 反应混合物暗湿盒中37℃反应1h,然后加入POD 37℃暗湿盒中反应30min,最后加入DAB 显色及在苏木素中复染。取4 张切片,每张切片随机选取5 个视野(×400),计算每mm2内凋亡阳性细胞的核数。
1.8 统计学处理方法 应用SPSS 16.0 统计学软件,各组实验结果以均数±标准差(±s)表示。将所有数据进行正态性和方差齐性检验,组间比较采用单因素方差分析(One-way ANOVA),多个实验组之间比较采用SNK 法,采用双侧检验作为判定标准,以P<0.05 为差异有统计学意义。
2 结果
2.1 TTC 染色显示脑缺血再灌注后脑梗死体积变化情况 A 组可见到两侧大脑半球呈均匀一致红染;B、C、D 组于左侧大脑半球左侧大脑中动脉供血区可见大小不等梗死灶。B 组及C 组于左侧大脑半球皮质及纹状体均可见大片状脑缺血失染区呈白色,其梗死体积分别为287±22mm3、291±27mm3。D组左侧大脑半球仅皮质处可见斑片状失染区,其梗死体积为151±24mm3,与B、C 组相比,EPO 组脑梗死体积明显缩小(P<0.05),B 组和C 组比较失染区体积差异无统计学意义(P>0.05)(见表1)。
2.2 EPO 干预后脑缺血再灌注损伤区域STAT1、P-STAT1、STAT3、P-STAT3 表达情况 Western blot 结果显示STAT1 蛋白表达在4 组中的rOD值分别为2.07±0.18、1.99±0.12、2.00±0.20、1.94±0.23,组间比较结果显示4 组间差异无统计学意义(F=0.806,P>0.05);同样,STAT3 蛋白表达在4 组中的rOD 值分别为:1.99±0.14、2.03±0.13、2.05±0.14、1.92±0.11,组间比较差异无统计学意义(F=1.558,P>0.05),这表明STAT1、STAT3 蛋白在正常脑组织中表达,且缺血2h 再灌注24h 及EPO 干预后对二者表达水平均无显著影响。而P-STAT1、P-STAT3 在正常脑组织中表达较低,脑缺血再灌注后P-STAT1、P-STAT3 蛋白表达增加,EPO 干预后,与B、C 组比较,D 组的P-STAT3 表达明显增加(F=40.719,P<0.05),P-STAT1 表达有所减少(F=3.274,P>0.05),B 组与C 组之间无显著差异(P>0.05)(见表1)。
表1 大鼠脑缺血再灌注后脑梗死体积、STAT1、P-STAT1、STAT3、P-STAT3表达rOD 值及凋亡细胞数(n=30,±s)
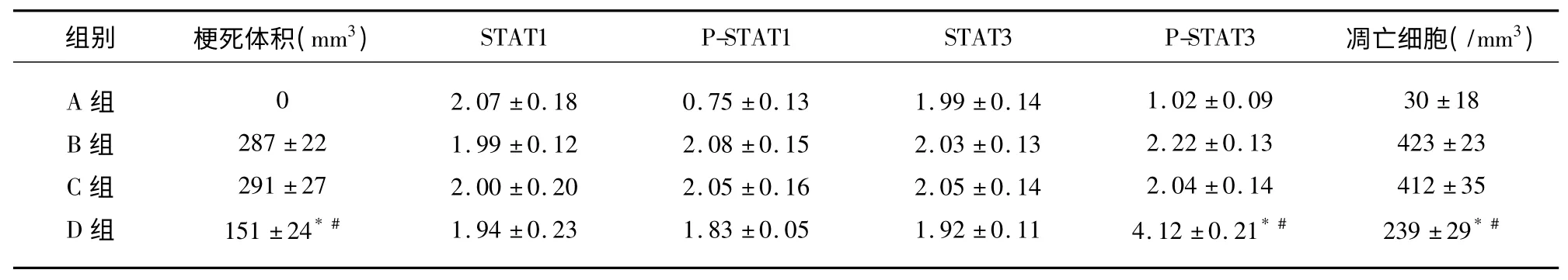
表1 大鼠脑缺血再灌注后脑梗死体积、STAT1、P-STAT1、STAT3、P-STAT3表达rOD 值及凋亡细胞数(n=30,±s)
与B 组比较* P<0.05;与C 组比较#P<0.05
免疫组织化学染色结果显示STAT1、STAT3 蛋白在正常脑组织中表达,阳性细胞表现为细胞呈棕褐色着色,缺血再灌注及EPO 干预的STAT1、STAT3蛋白表达水平均无明显变化。在正常脑组织中可见少量P-STAT1、P-STAT3 免疫阳性细胞,脑缺血再灌注后P-STAT1、P-STAT3 蛋白表达增加,EPO 干预后,与B、C 组比较,D 组的P-STAT3 阳性表达明显增加,P-STAT1 表达有所减少。总体而言,免疫组织化学染色结果与Western blot 结果呈一致性。
2.3 EPO 对大鼠脑缺血再灌注损伤区域细胞凋亡的影响 假手术组见个别散在凋亡细胞,凋亡细胞数为30±18/mm3,脑缺血再灌注组及生理盐水组可见大量凋亡细胞,表现为细胞核呈棕色或棕褐色着染,核形呈碎点状,不规则,大小不一,凋亡细胞数分别为423±23/mm3、412±35/mm3。EPO 组凋亡细胞数量明显减少,其凋亡细胞数为239±29/mm3,经统计学处理D 组与B、C 组之间差异有统计学意义(P<0.05),B 组与C 组之间无显著差异(P>0.05)(见表1)。
3 讨论
STATs 蛋白的表达在神经元的存活中起到重要作用,脑缺血再灌注后可以激活STAT1、STAT3,但同时观察EPO 干预后脑缺血再灌注损伤区域STAT1、STAT3、P-STAT1、P-STAT3 4 种蛋白表达情况国内外未见报道。本实验建立脑缺血再灌注损伤动物模型,研究该损伤区域JAK/STAT 信号转导通路中STATs 蛋白表达与脑梗死体积及细胞凋亡数目的变化。
脑缺血造成的神经元死亡(neuronal death)可分为坏死(necrosis)和凋亡(apoptosis)两种。大量实验报道,神经元坏死主要发生于缺血严重的核心区,而凋亡则多发生于缺血的周边区和脑内某些缺血易感部位。神经元缺血性坏死难于逆转,然而凋亡可通过对其上游信号的调节进行干预,脑缺血治疗策略正是以这些坏死边缘的凋亡细胞为目标进行的[8,9]。研究表明,STAT1 通过转录依赖性及非依赖性途径在促进细胞凋亡过程中有重要的作用[10]。而STAT3 的激活可以通过抗细胞凋亡发挥脑保护作用。
3.1 EPO 干预后脑缺血再灌注区域STAT1、PSTAT1、STAT3 及P-STAT3 变化 本研究利用Western blot 和免疫组织化学染色检测方法,结果显示STAT1、STAT3 蛋白在正常脑组织中表达,而PSTAT1、P-STAT3 在正常脑组织中蛋白表达和免疫反应阳性细胞均较低,说明在正常生理状态下脑组织中STAT1、STAT3 是以无活性的非磷酸化形式存在的。脑缺血再灌注损伤后P-STAT1、P-STAT3 蛋白表达增加,说明脑缺血再灌注时STAT1、STAT3 被激活。本实验Western blot 和免疫组织化学染色结果显示EPO 干预后,P-STAT3 蛋白表达和免疫反应阳性细胞进一步明显增加,而P-STAT1 表达有所减少,说明EPO 可促进JAK/STAT 信号转导通路中STAT3的磷酸化和活化。Kretz 等[6]发现EPO 发挥脑保护作用的靶点为STAT3,本实验结果显示EPO 干预后P-STAT1 表达水平有所降低,结合之前研究及本实验结果,提示应用EPO 后可促进P-STAT3 的活化,激活的P-STAT3 的表达增加在一定程度上可能降低了P-STAT1 的激活,说明STAT1 与STAT3 之间可能存在一定的相互作用机制。我们推测可能有两方面原因,一方面可能与EPO 激活STAT3 有关,活化的STAT3 可能上调SOCS3 基因[11,12],对STAT1 的表达起到了一定的抑制作用;另一方面,STAT1 与STAT3可能竞争相同的受体,活化的STAT3 能够代替STAT1促使特定的IFN-γ 依赖性基因的转录,从而活化的STAT3 能够对抗IFN-γ 介导STAT1 活化所引起的凋亡。
3.2 EPO 干预后脑缺血再灌注区域P-STAT1、P-STAT3 激活与脑梗死体积及细胞凋亡的关系 本实验结果显示EPO 干预后,TTC 染色所示大鼠脑梗死体积较未干预组明显缩小,Western blot 及免疫组织化学染色显示P-STAT3 表达明显增加,P-STAT1表达水平有所降低,TUNEL 染色显示凋亡细胞数目明显减少,以上结果提示EPO 可促进JAK/STAT 信号转导通路中STAT3 的磷酸化和活化,而P-STAT3的激活可挽救脑缺血再灌注损伤区域中细胞的凋亡,减少其凋亡的数量,从而促进损伤修复,缩小梗死区。同时也表明P-STAT1 表达的降低有助于阻止脑缺血再灌注损伤后神经功能缺损的恶化,减少细胞凋亡。以上研究结果与Li 等[13]发现在小鼠持续性局灶性脑缺血模型缺血前30min 和缺血后24h 腹腔注射大剂量EPO(5000IU/kg)可使脑梗死体积明显缩小,和抑制神经细胞凋亡等结论相一致。
综上所述,本研究经腹腔注射EPO 后,大鼠脑梗死体积明显缩小,TUNEL 检测结果证实脑缺血再灌注损伤区神经细胞凋亡数目明显减少,其保护作用可能与EPO 干预后促进P-STAT3 表达的增加及一定程度上抑制P-STAT1 的表达有关。但对于EPO发挥脑保护作用的确切生物学作用机制尚有待进一步研究。
[1]ErdaF,Trapp T,Mies G,et al.Immunohistochemical analysis of protein expression after middle cerebral artery occlusion in mice[J].Acta Neuropathol,2004,107(2):127-136.
[2]Amantea D,Tassorelli C,Russo R,et al.Neuroprotection by leptin in a rat model of permanent cerebral ischemia:effects on STAT3 phosphorylation in discrete cells of the brain[J].Cell Death Dis,2011,2:238.
[3]Dziennis S,Alkayed NJ.Role of signal transducer and activator of transcription 3 in neuronal survival and regeneration[J].Rev Neurosci,2008,19(4~5):341-361.
[4]Velly L,Pellegrini L,Guillet B,et al.Erythropoietin 2nd cerebral protection after acute injuries:a double-edged sword[J].Pharmacol Ther,2010,128(3):445-459.
[5]杨彦玲,朱文侠,陈雅慧,等.促红细胞生成素对脑缺血/再灌注损伤的保护作用[J].中国应用生理学杂志,2010,26(2):152-153.
[6]KretzA,Happold CJ,Marticke JK,et al.Erythropoietin promotes regeneration of adult CNS neurons via Jak2/Stat3 and PI3K/AKT pathway activation[J].Mol Cell Neurosci,2005,29(4):569-579.
[7]Kisseleva T,Bhattacharya S,Braunstein J,et al.Signaling through the JAK-STAT pathway:recent advances and future challenges[J].Gene,2002,285(1):1-24.
[8]Zechariah A,Elali A,Hermann DM.Combination of tissue-plasminogen activator with erythropoietin induces blood-brain barrier permeability,extracellular matrix disaggregation,and DNA fragmentation after focal cerebral ischemia in mice[J].Stroke,2010,41(5):1008-1012.
[9]Ferrer I,Plans AM.Signaling of cell death and cell survival following focal cerebral ischemia:life and death struggle in the penumbra[J].J Neuropatho Experi Neuro,2003,62(4):329-339.
[10]Kim HS,Lee MS.STAT1 as a key modulator of cell death[J].Cell Signal,2007,19(3):454-465.
[11]Lim CP,Cao X.Structure,function,and regulation of STAT proteins[J].Mol Biosyst,2006,2(11):536-550.
[12]Qin H,Niyongere SA,Lee SJ,et al.Expression and functional significance of SOCS-1 and SOCS-3 in astrocytes[J].J Immunol,2008,181(5):3167-3176.
[13]Li Y,Lu Z,Keogh CL,et al.Erythropoietin-induced neurovascular protection,angiogenesis,and cerebral blood flow restoration after focal ischemia in mice[J].J Cereb Blood Flow Metab,2007,27(5):1043-1054.

