血管性痴呆模型大鼠NOS、NO 的表达
井 沆,肖 雁,官志忠
血管性痴呆(vascular dementia,VaD)是老年期痴呆的主要类型之一,是由一系列脑血管因素(脑组织梗死、低灌注或出血等)导致脑组织损害引起的以认知功能障碍为特征的综合征[2]。关于血管性痴呆的众多发病机制中钙超载学说占主流地位,钙超载后引起钙信号通路的过度激活从而触发了Ca2+依赖的级联反应,导致神经元的损伤甚至死亡[3]。一氧化氮合酶(Nitric oxide synthase,NOS)是此通路中的一个关键酶,NOS 是催化L-精氨酸产生NO 和L-胍氨酸的专一酶[4],NOS 有2 种类型:诱导型NOS(inducible nitric oxide synthase,iNOS)和结构型NOS(constitutive nitric oxide synthase,cNOS),有研究表明iNOS 参与了VaD 引起的迟发性脑损伤[5]。本实验首先观察NOS 和NO 在VaD 模型大鼠和假手术大鼠血清及海马中的表达,然后对造模后1月组和造模后2 月组的NOS 和NO 结果进行分析,探讨NOS 和NO 在造模不同时间段的表达差异,探讨其在VaD 发病进程中的作用机制。
1 材料与方法
1.1 材料
1.1.1 动物 成年健康SD 大鼠60 只(购自重庆第三军医大),体重200~250g,雌雄各半,随机分为模型组和假手术组。
1.1.2 试剂 NOS、NO 试剂盒由南京建成生物工程公司提供。鼠抗β-actin 单克隆抗体、鼠抗NOS 单克隆抗体、HRP 标记的抗鼠二抗购自美国Santa Cruz 公司。5×蛋白上样缓冲液,RIPA 裂解液,SDS-PAGE 凝胶配制试剂盒均购于碧云天生物试剂公司。聚乙烯二氟(PVDF)膜、ECL-Plus 发光试剂、高效显影胶片购于Amersham 公司。显影液、定影液购于柯达公司。BCA 法蛋白定量测试盒购于上海捷瑞生物工程有限公司。
1.2 方法
1.2.1 动物筛选及分组 60 只SD 大鼠,雌雄各半。适应性喂养1w 后,进行Morris 水迷宫定向航行实验和空间探索实验[6],第1~4 天进行定向航行试验:每日将大鼠按Ⅰ、Ⅱ、Ⅲ、Ⅳ象限顺序从各入水点靠池壁放入水中,记录60s 内大鼠从入水到爬上平台(固定于第象限)所需时间即逃避潜伏期。每只大鼠每天训练4 次。第5 天撤去平台,进行空间探索实验:记录大鼠2min 内穿过原站台位置的次数。选取学习、记忆力相近的大鼠随机分为假手术组与VaD模型组,模型组再分1 月组及2 月组,每组15 只。
1.2.2 大鼠VaD 模型的制备[7]大鼠术前12h 禁食,4h 禁水。大鼠称重后用10% 水合氯醛(0.3ml/100g)腹腔注射,麻醉成功后俯卧位固定、备皮、碘伏和75%乙醇消毒,行背侧颈正中切口,暴露双侧第一颈椎横突翼小孔,用直径0.5mm 电凝针插入双侧翼小孔凝闭双侧椎动脉,逐层整理好皮下组织,局部伤口缝合前涂以适量青霉素粉以防止感染,间断缝合皮肤。24h 后行颈前正中切口,分离各层组织暴露双侧颈动脉后穿线待用,拉起穿线用微动脉夹夹闭双侧颈总动脉5min,共夹闭3 次,每次间隔1h。假手术组只分离椎动脉和颈总动脉,不进椎动脉凝闭和夹闭。1 月后大鼠死亡12 只,存活18 只,其中假手术组10 只,模型组8 只。2 月后大鼠死亡15 只,存活15 只,其中假手术组9 只,模型组6 只。
1.2.3 学习记忆能力测定 分别于造模后1月、2 月,用Morris 水迷宫检测模型大鼠的学习记忆能力,方法同1.2.1。
1.2.4 组织样本的制备 水迷宫测试结束后进行取材。将大鼠脱颈处死,冰盘上快速剖取全脑,弃去嗅球及小脑,取海马组织,用冰生理盐水冲洗血液,再用滤纸拭干,电子天平称重后迅速投入1.5ml的EPP 管中,加入9 倍冷生理盐水,在玻璃匀浆器中研磨成10% 匀浆,低温高速离心机上4℃、12000r/min 离心5min,提取上清液,-80℃冻存待检。以10%水合氯醛(0.3ml/100g)腹腔注射麻醉后,立即股动脉取2ml 血液于肝素抗凝管中,再将抗凝管中血液迅速离心分离出血浆,-80℃冻存待检。
1.2.5 tNOS、iNOS 活性和一氧化氮(NO)含量的测定 取出血浆,用NOS 和NO 测定试剂盒对其进行测定。于550nm 测定NO 含量;530nm 波长下测定吸光度,根据吸光度大小可计算NOS 活力。根据cNOS 依赖钙而iNOS 不依赖钙进行分型。具体步骤参照试剂盒说明操作。
1.2.6 海马NOS 蛋白水平 取海马组织,加入冰预冷的RIPA 裂解液(PMSF 和裂解液比例为1∶100)用电动匀浆器于冰上制成10%的脑组织匀浆。并置于冰上1h[8],使脑组织细胞充分溶解。12000r/min 4℃离心25min,小心吸取上清液至1.5 ml 的EPP 管中,BCA 法蛋白定量测试盒对上清液进行蛋白定量,操作按照蛋白定量试剂盒说明书进行。取10%海马组织匀浆进行Western blotting 检测NOS 和β-actin 蛋白表达。
1.2.7 结果分析 Western blotting 结果用GDS-8000 型UVP 凝胶成像系统照相,以Labworks软件分析结果,以β-actin 蛋白条带作为内参照,以NOS 蛋白条带与β-actin 蛋白条带像素灰度的百分比值作为NOS 蛋白质表达的相对水平。
1.2.8 统计学方法 采用SPSS 13.0 统计分析软件,数据以均数±标准差(±s)表示,组间比较采用单因素方差分析或非参数检验,P<0.05 表示差异有统计学意义。
2 结果
2.1 行为学结果 模型1 月组大鼠平均逃避潜伏期明显长于对照组(P<0.05),表明VaD 大鼠定向航行能力降低,第5 天,观察空间探索时移走平台,以在原平台象限(第1 象限)的活动时间为指标,与对照组比较,模型组第1 次穿越平台所用时间延长(P<0.05),穿越站台次数明显减少(P<0.05)。表明VaD 大鼠学习能力降低。1 月组和2月组之间无统计差异(P>0.05)(见表1)。
2.2 血浆NO 和海马组织NO 表达含量 与假手术相比较,1 月和2 月模型组大鼠血浆和海马组织中的NO 含量明显增高(P<0.05),差异有统计学意义,与模型组中NOS 活性高于假手术组的结果相符。对比1 月组和2 月组NO 情况可见,1 月组NO 的含量明显多于2 月组,差异明显(P<0.05),有统计学意义(见表2)。
2.3 血浆和海马组织tNOS 和iNOS 酶活性对1 月组和2 月组进行血浆及海马组织tNOS 和iNOS 酶活性的测定发现,与假手术组相比较,模型组大鼠血浆和海马组织中tNOS 和iNOS 酶活性明显增高,差异有统计学意义(P<0.05)。1 月模型组和假手术组血浆及海马组织tNOS 和iNOS 活性和2 月组分别进行对比,显示1 月组tNOS 和iNOS 活性高于2 月组,差异明显(P<0.01),有统计学意义(见表3)。
2.4 模型组和对照组海马NOS 蛋白表达水平与对照组相比较 模型组海马组织NOS 蛋白表达水平明显偏高(P<0.05)差异有统计学意义。1 月组海马NOS 蛋白表达高于2 月组(P<0.05)(见图1)。
表1 VAD 组及假手术组大鼠定向航行实验及空间探索实验结果的比较(±s)

表1 VAD 组及假手术组大鼠定向航行实验及空间探索实验结果的比较(±s)
与假手术组比较* P<0.05

表2 血浆和海马组织NO 表达情况(血浆NO 单位:μmol/L;海马组织NO 单位:μmol/g prot)
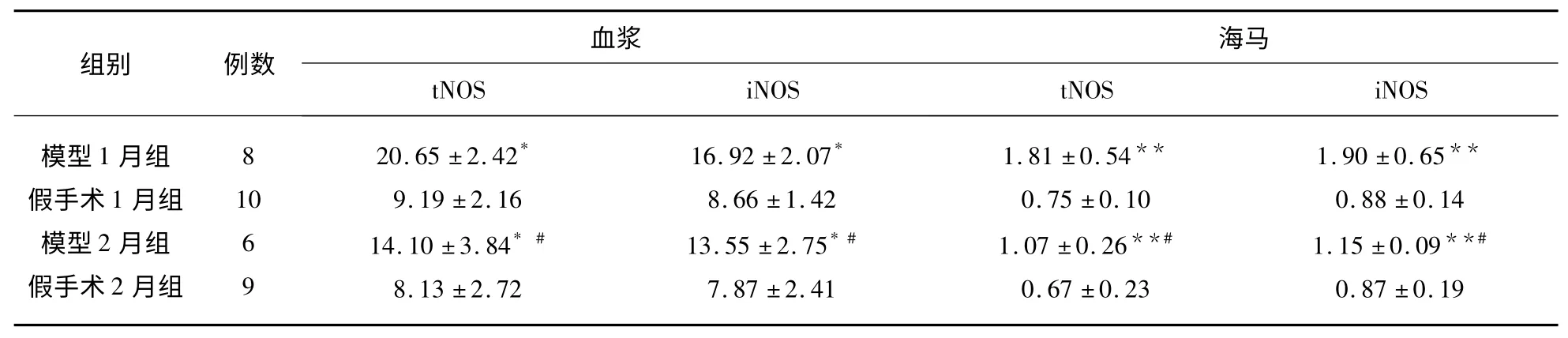
表3 1 月组和2 月组血浆及海马组织tNOS 和iNOS 酶活性(血浆 单位:U/ml;海马单位:U/mg prot)

图1 NOS 蛋白表达水平
3 讨论
VaD 是老年痴呆最常见病因之一,而关于VaD的发病机制有多种学说。钙超载被认为是VaD 发病机制中的一个重要致病因素,但是钙超载在VaD 记忆和认知功能低下中的机制尚未阐明。近年来,一氧化氮在中枢神经系统中的病理生理作用成为神经科学的研究热点之一,有研究发现一氧化氮可参与突触可塑性、神经元兴奋毒性及炎症损害等多种过程,且与学习和记忆密切相关。VaD 发病时兴奋性氨基酸释放增多,激活N-甲基-D-天门冬氨酸(NMDA)受体,使海马神经元细胞内Ca2+浓度超载,NOS被大量激活并产生过量NO,过量的NO 不仅参与了脑损害,且在痴呆发病机制中可能有重要的作用[9]。
NO 性质活泼,半衰期极短,在体内生物半衰期仅数秒钟,是一种正常生理状态下存在的信息分子,在维持神经元功能等方面有着重要作用。最近研究更表明,NO 在神经系统内既有潜在的脑保护作用又有神经毒性的危害作用,犹如一把双刃剑[10]。NO的作用与NOS 水平密切相关[11],对NOS 蛋白表达变化的研究是对NO 进行深入探讨的重要环节。NOS 主要有2 种类型,结构型(cNOS)和诱导型(iNOS),它们执行不同的生理和病理功能,cNOS 是生理存在形式,依赖Ca2+或钙调蛋白,作用快速短暂,生成NO 少;iNO 在脑缺血状态下过度表达,作用时间长,NO 生成量多[12]。脑缺血发生后,NOS 短暂急剧升高,此时的NOS 主要来源于cNOS。cNOS 平时以非活性形式存在,并受Ca2+/CaM 调节,cNOS 的大量激活引起NO 的升高。但随着缺血时间的延长,脑组织中O2和L-精氨酸供给减少,NOS 活性会逐渐下降。而由iNOS 介导引起的神经毒性作用,主要参与VaD 引起的缺血晚期脑损伤。随着时间的延长,可使iNOS 激活,而iNOS 一旦生成就会持续产生NO而不受胞内Ca2+浓度的影响,过量的iNOS 产生大量具有神经毒性作用的NO,在海马迟发型神经元凋亡和痴呆形成中均发挥了一定的作用。NO 作为细胞内信使参与长时程增强(LTP)的诱导和形成,NOS与NO 可影响学习记忆等过程,iNOS 被认为是影响学习记忆的关键酶[13]。
本研究不仅对血管性痴呆大鼠血浆及脑组织内NOS 活性和一氧化氮进行了研究,还对比分析了痴呆大鼠缺血后1 月和2 月血浆和海马组织内NOS、NO 的活性含量,探索了NOS 以及NO 在痴呆发病中的一个动态变化情况。结果显示,经4-VO 造模后,血管性痴呆模型大鼠平均逃避潜伏期明显长于假手术组,撤去平台后,模型组第1 次穿越平台所用时间延长,穿越站台次数明显减少,表明VaD 大鼠模型构建良好,但是1 月组和2 月组之间的差异无统计学意义。模型1 月组和2 月组血浆和海马组织NOS 酶活性及NO 含量显著高于假手术组,并且与行为学上的变化相一致。大鼠缺血2 月后血浆和海马组织iNOS 的活性仍然比较高,推测随着缺血时间的延长,NOS 主要来源于iNOS。iNOS 活性持续时间较长,可引起长时间的NO 的晚期释放。通过对比1 月组和2 月组血浆和海马组织NOS 和NO 含量发现,1月组血浆和海马组织NOS 活性和NO 含量均高于2月组,表现为随着病程的延长,2 月组的NOS 活性和NO 含量趋于下降,这一方面可能与前期释放的cNOS 活性的下降导致tNOS 的总活性减弱有关,另外也可能与自身缺血疾病的缓慢缓解和改善有关。
综上所述,NOS 活性和NO 含量可能与脑缺血后引起的神经损伤密切相关,可能在血管性痴呆疾病形成过程中发挥了重要的作用。
[1]李文东,姜洪波,连晓清,等.Pulsinelli 四血管法大鼠全脑缺血模型制作方法的改进[J].新乡医学院学报,2010,27(3):237-239.
[2]Benisty S.Current concepts in vascular dementia[J].Geriatr Psychol Neuropsychiatr Vieil,2013,11(2):171-180.
[3]Szdnoki Z,Havasi V,Bene J,et al.Endothelial nitricoxide synthase gene in teractions and the risk of ischaemie stroke[J].Acta Neurol Scand,2005:3(1):29-33
[4]Seyidova D,Aliyev A,Rzayev N,et al.The role of nitric oxide in the pathogenesis of brain lesions during the development of Alzheimer’s disease[J].In Vivo,2004,18(3):325-333.
[5]Aliev G,Palacios HH,Lipsitt AE,et al.Nitric oxide as an initiator of brain lesions during the development of Alzheimer’s disease[J].Neurotox Res,2009,16(3):293-305.
[6]况时祥,刘继刚,肖 燕,等.脑通胶囊对血管性痴呆大鼠学习记忆能力及脑组织NO、SOD 含量的影响[J].中国中医急症,2010,19(8):1368-1370.
[7]肖 雁,吴昌学,官志忠.血管性痴呆大鼠海马神经型胆碱能受体的变化[J].临床神经病学杂志,2009,22(6):426-429.
[8]肖 雁,王晓亮,邓 婕,等.脑通复方对大鼠海马尼古丁受体的影响[J].时珍国医国药,2010,21(6):1305-1307.
[9]Aliyev A,Seyidova D,Rzayev N,et al.Is nitric oxide a key target in the pathogenesis of brain lesions during the development of Alzheimer's disease[J].Neurol Res,2004,26(5):547-553.
[10]Min D,Guo F,Zhu S,et al.The alterations of Ca2+/calmodulin/CaMKII/CaV1.2 signaling in experimental models of Alzheimer's disease and vascular dementia[J].Neurosci Lett,2013,22(538):60-65.
[11]Van Oijen M,Witteman JC,Hofman A,et al.Fibrinogen is associated with an increased risk of Alzheimer disease and vascular dementia[J].Stroke,2005,36(12):2637-2641.
[12]Salerno L,Sorrenti V,Di Giacomo C,et al.Progress in the development of selective nitric oxide synthase(NOS)inhibitors[J].Curr Pharm Des,2002,8(3):177-200.
[13]Kullmann DM,Lamsa KP.LTP and LTD in cortical GABAergic interneurons:emerging rules and roles[J].Neuropharmacology,2011,60(5):712-719.

