血清IL-6、IL-10 及IFN-α 水平对首发抑郁患者双侧海马区细胞代谢影响的磁共振波谱研究
朱 颖,王冬青,朱 彦,李月峰,朱海涛,殷瑞根,赵 亮
炎症因子学说是抑郁症发病机制中的一种重要的假说,其中促炎性细胞因子及抗炎性细胞因子种类繁多,且作用各不相同。而大量病理学及影像学证据亦表明抑郁症患者海马存在功能结构的变化。虽然炎症因子学说与脑结构功能异常学说研究点不一样,但实际上是相互联系及影响的。
以往的研究很少对这两种学说所研究的对象进行联系比较,我们针对这种潜在的联系性,利用氢质子磁共振波谱技术(1H-MRS)检测双侧海马细胞代谢功能变化的同时测定外周血血清中几种炎症因子的水平高低,探讨炎症因子对首发抑郁患者海马区细胞代谢的影响,有机地结合两种学说去研究抑郁症的发病机制。
1 材料与方法
1.1 实验对象收集 收集20 例2010 年4 月~2013 年4 月经江苏大学附属医院及附属第四人民医院精神科诊断为首发抑郁症的患者并符合以下条件:(1)首次发作并且未经过抗抑郁药物干预,同时未服用过其它精神类药物;(2)未接受过电休克等物理治疗;(3)未使用影响脑内乙酰胆碱等神经递质的药物;(4)排除其他精神障碍或药物依赖、患有严重的躯体疾病或严重药物过敏、患过脑器质性疾病或其他可能影响脑结构与功能的疾病;(5)近2w 无感冒、发热及其他感染性病史。其中男8 例,女12 例,最大者35 岁,最小者17 岁,平均年龄(26±4)岁;受教育年限8~16(13.4±3.8)年;身高154~177(160±19)cm;体重46~80(63±10)kg;均为右利手。
20 例健康志愿者均为本院职工或其家属,其中男9 例,女11 例;最大者37 岁,最小者20 岁,平均年龄(28±6)岁;受教育年限9~19(15.2±2.9)年;身高:156~179(164±22)cm,体重:44~78(58±11)kg,均为右利手。
本研究经医院伦理委员会批准,全部志愿者对本研究项目知情并签署知情同意书。
1.2 磁共振波谱检测 采用西门子公司Magnetom Trio Tim 3.0T 高场磁共振成像系统及MRS 专用头颅线圈作为检测设备。以TSE 序列MRI 常规扫描排除脑部器质性病变,并采用3 轴(X 轴、Y 轴、Z 轴)对双侧海马进行1H-MRS 定位。VOI:(16×16);体素大小:1cm×1cm×1.5cm。采用(MVS)3D-CSI 序列对受试者进行1H-MRS 扫描(TR=1700ms,TE=135ms)。波谱扫描时避开颅骨、脂肪、气腔及脑脊液等结构,并使用饱和带以避免周围组织对检查结果的影响。体素内匀场、水抑制均由扫描程序自动完成。扫描完成后使用随机LEONARDO 程序进行基线、相位校正。工作站记录相关代谢指标并以Cr 为标准计算Glx/Cr、NAA/Cr、Cho/Cr、MI/Cr 的比值(Cr 由于其浓度在各种状态下量化相对恒定,常被作为参照物)。所有数据均光盘刻录储存,之后由两名副高以上职称医师统一时间同时独立进行统计分析。
1.3 血清炎症因子水平测量 所有受试者均在早晨6:30~8:00 时间段1H-MRS 扫描前空腹抽取肘静脉血3ml,不抗凝,自然状态下放置30min 后离心(3000r/min,10min)分离血清后置于-20℃低温保存。采用ELISA 法对保存的血清样本进行IL-6、IL-10 及IFN-α 水平的检测。
1.4 统计学分析 测得数据符合正态性分布,数据用Stata12.0 软件包进行统计分析,计量资料以均数±标准差(±s)表示。采用t 检验的统计学方法,P<0.05 为有统计学意义。采用Spearman 相关分析检验双侧海马区多种代谢指标与血清中多种炎性因子水平的相关性,P<0.05 为有统计学意义。
2 结果
2.1 两组双侧海马各代谢指标变化 相对于正常组,首发抑郁组患者左侧海马的Glx/Cr 及NAA/Cr 显示下降(Glx/Cr:t=2.69,<0.05;NAA/Cr:t=2.81,P<0.05);而Cho/Cr 显示升高(t=2.36,P<0.05),MI/Cr 变化不明显(t=1.19,P>0.05),右侧海马仅仅出现Glx/Cr(t=2.43,P<0.05)的下降,其余指标未见有统计学意义的升高(见表1、见图1)。
2.2 两组血清中炎症因子水平变化 相对于正常组,首发抑郁组患者外周血血清中IL-6 及IFNα 水平出现有统计学意义的升高(IL-6:t=4.53,P<0.05;IFN-α:t=4.49,P<0.05),IL-10 水平变化不明显(t=0.26,P>0.05)(见表2)。
2.3 双侧海马各代谢指标与血清中各种炎症因子水平的相关性分析 双侧海马的Glx/Cr 水平与IL-6、IFN-α 水平呈明显负相关[左侧:(IL-6:r=-0.555,P<0.05;IFN-α:r=-0.604,P<0.05);右侧:(IL-6:r=-0.575,P<0.05;IFN-α:r=-0.511,P<0.05)],左侧海马的NAA/Cr 水平与IL-6、IFN-α 水平亦呈显著负相关(IL-6:r=-0.582,P<0.05;IFN-α:r=-0.593,P<0.05),左侧海马的Cho/Cr 水平与IL-6、IFN-α 水平成明显正相关(IL-6:r=0.601,P<0.05;IFN-α:r=0.548,P<0.05)。其余代谢指标与血清炎症因子水平相关性不明显(见表3)。

表1 正常组与抑郁组的双侧海马各1H-MRS 代谢指标比较

表2 正常组与抑郁组的血清炎症因子水平比较(pg/ml)
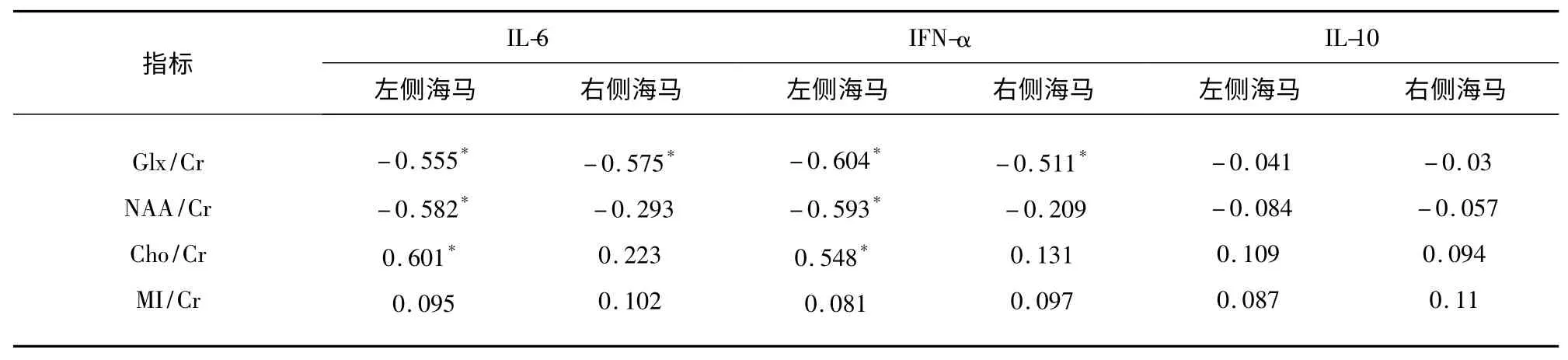
表3 双侧海马1H-MRS 各代谢指标检测结果与血清炎症因子水平高低的相关性

图1 正常组与抑郁组双侧海马的1H-MRS 波谱图对比(左为正常组,右为抑郁组)
3 讨论
Dowlati[1]认为慢性炎症是产生抑郁症的一个重要因素,Lee[2]的研究也表明产生抑郁状行为的大鼠其血清中炎症因子的水平与正常大鼠有较大区别。笔者所在研究小组的前期研究通过检测抑郁大鼠模型的脑脊液炎症因子水平也发现其中几种因子水平的升高[3]。由于对抑郁症炎症因子假说的研究大多只是集中在某些载体内(如:外周血清、脑脊液或脑组织液)炎症因子的水平高低,所以究竟这些炎症因子对于神经细胞代谢的影响是怎样很少有涉及。且动物模型与临床病例发病机制并不完全一致[4]。因此本研究选择首发抑郁患者作为研究对象,以排除不同类型、不同病程、不同年龄、性别以及首发复发等干扰因素。首发抑郁患者由于是从正常逐渐变化为抑郁状态,不受病程、治疗或年龄等因素的干扰[5],能更单纯地研究抑郁症始发的发病原因。海马是如今公认的导致产生抑郁状态的核心核团,调控着情感、情绪变化甚至学习记忆能力[6],其中神经细胞的代谢变化极可能参与了整个抑郁症发生的过程。笔者利用1H-MRS 这种无创的检测神经细胞代谢变化的手段去活体研究首发抑郁症患者敏感脑区受炎症因子水平的影响,充分结合两种不同手段去探讨抑郁症的发病机制。
L-6 促进B 淋巴细胞分化及增殖,这些物质能抑制神经细胞新生、发育,且能同步激活下丘脑-垂体-肾上腺轴,增加皮质激素分泌,促进细胞凋亡[7]。IFN-α 引起将色氨酸转化为犬尿氨酸的IDO(吲哚胺2,3-双加氧酶)的升高,导致色氨酸供应减少,从而减少5-HT 的合成,同时犬尿氨酸的代谢产物能引起神经元细胞的损失,导致抑郁症[8]。IL-10 作为一种免疫抑制因子能够调节免疫系统,对抗促炎性细胞因子的作用。笔者分别选择这3 种对机体有着不同作用的炎症因子做研究比较,发现在首发抑郁患者出现血清炎症因子水平变化的同时,海马的某些神经细胞代谢指标亦出现了有统计学意义的波动。IL-6、IFN-α 水平在首发抑郁患者的血清中都有较明显的升高,做相关性分析发现同时双侧海马的Glx/Cr都出现了下降,而NAA/Cr 及Cho/Cr 的变化仅仅出现在左侧海马,代表着肌醇磷酸循环的MI/Cr 值[9]却并未出现明显变化。由于存在大脑优势半球的影响[10],我们推测在早期的首发抑郁症中IL-6、IFN-α水平升高影响最大的是海马神经细胞的谷氨酸循环代谢,促炎症细胞能够破坏正常的神经细胞谷氨酸循环,使神经递质代谢出现紊乱,这或许是抑郁症产生的始发环节。紧接着的左侧海马NAA/Cr 及Cho/Cr 变化代表了神经元数目与神经细胞包膜完整性的变化,推测由于受到谷氨酸循环异常影响而出现了神经细胞的损害,是始发环节的一个发展,加深了神经元与神经细胞的破坏。IL-10 在本次研究中并未出现有意义的变化,猜测与抑郁症的病程有关,它在早期的首发抑郁症中并未激活起作用。
随着更大样本量的采集及BOLD[11]等脑功能成像的应用,我们将进一步做动态及药物干预研究继续探讨炎症因子对神经细胞代谢循环的影响。
[1]Dowlati Y,Herrmann N,Swardfager W,et al.A meta-analysis of cytokines in major depression[J].Biol Psychiatry,2010,67:446-457.
[2]Lee T,Jarome T,Li SJ,et al.Chronic stress selectively reduces hippocampal volume in rats:a longitudinal magnetic resonance imaging study[J].Neuroreport,2009,20:1554-1558.
[3]朱 彦,王冬青,李月峰,等.抑郁模型大鼠额叶及海马对脑脊液炎症因子敏感性的磁共振质子波谱研究[J].中华行为医学与脑科学,2013,22:303-305.
[4]Yuksel C,Ongur D.Magnetic resonance spectroscopy studies of glutamate-related abnormalities in mood disorders[J].Biol Psychiatry,2010,68:785-794.
[5]王冬青,朱 彦,李月峰,等.首发抑郁症患者敏感脑结构的磁共振质子波谱分析[J].中华行为医学与脑科学杂志,2011,20:19-21.
[6]张朝辉,宋景贵.卒中后抑郁单胺类递质与睡眠的研究[J].中风与神经疾病杂志,2008,25(2):188-190.
[7]Einvik G,Vistnes M,Strom HH,et al.Circulating cytokine concentrations are not associated with major depressive disorder in a communitybased cohort[J].Gen Hosp Psychiatry,2012,34:262-267.
[8]Matthew H,Arun S,Meera S,et al.γ-H2AX+CD8+T lymphocytes cannot respond to IFN-α,IL-2 or IL-6 in chronic hepatitis C virus infection[J].J Hepatol,2013,58:868-874.
[9]Venkatraman TN,Krishnan RR,Steffens DC,et al.Biochemical abnormalities of the medial temporal lobe and medial prefrontal cortex in late-life depression[J].Psychiatry Res,2009,1:49-54.
[10]罗一烽,王冬青,李月峰,等.抑郁模型大鼠行为学及海马体积变化的动态研究[J].中华行为医学与脑科学杂志,2010,19:1102-1104.
[11]Menno P,Lucie H,Anne Z,et al.Blockade of the renin-angiotensin system and renal tissue oxygenation as measured with BOLD-MRI in patients with type 2 diabetes[J].Diabetes Res Clin Pract,2013,99:136-144.

