响应面法优化超临界CO2萃取玉米蛋白粉中叶黄素工艺
佟万兵,曹龙奎*,宋 亮
(黑龙江八一农垦大学食品学院,黑龙江 大庆 163319)
响应面法优化超临界CO2萃取玉米蛋白粉中叶黄素工艺
佟万兵,曹龙奎*,宋 亮
(黑龙江八一农垦大学食品学院,黑龙江 大庆 163319)
为获得纯度较高的叶黄素,以玉米蛋白粉为原料,对玉米叶黄素的超临界CO2萃取工艺条件进行研究,采用高效液相色谱法(HPLC)测定叶黄素纯度。用响应面分析法优化超临界CO2萃取叶黄素的工艺参数,在单因素试验基础上选取萃取时间、萃取温度、萃取压力3个主要因素,以叶黄素纯度为响应值,对其提取工艺参数进行优化,得出了最优提取工艺条件为:萃取时间2.3h、萃取温度42℃、萃取压力30MPa、夹带剂为90%乙醇、添加量5mL/100g。在该条件下,由响应面模型预测的玉米叶黄素纯度为46.50%。
叶黄素;超临界CO2萃取;响应面法
玉米蛋白粉是湿法生产玉米淀粉过程中的主要副产物,其中含有丰富的叶黄素[1]。如用来提取叶黄素不仅可以大大提高其附加值还可解决环境污染问题。叶黄素又名“植物黄体素”,是一种广泛存在于蔬菜、花卉、水果等植物中的天然色素,具有色泽鲜艳、着色力强、安全无毒、抗氧化能力强、可预防人体衰老、富有营养无副作用等优点,所以越来越受到人们的关注[2-5]。超临界CO2萃取技术是最近在食品工业上新兴的一项萃取和分离技术。与传统的溶剂萃取相比,其优越性在于无化学溶剂消耗和残留,无污染,减少萃取物在高温下的劣变,保护生物活性物质的活性,工艺简单、能耗低、萃取剂无毒、易回收[6-7]。
国内外对叶黄素的研究较多,但利用玉米蛋白粉为原料提取叶黄素的研究并不多,卢艳杰等[8]研究了利用溶剂萃取法提取玉米蛋白粉中的黄体素和玉米黄素;李秀霞等[9]研究了采用酶法预处理玉米蛋白粉辅助常规溶剂提取叶黄素的工艺,但都不可避免地存在有机溶剂的残留,影响产品质量。綦丹华等[10]研究了超临界流体萃取玉米蛋白粉中类胡萝卜素(叶黄素、玉米黄质和β-胡萝卜素)的提取工艺,得出了超临界萃取类胡萝卜素最佳提取工艺,研究中将萃取物与万寿菊提取物中叶黄质含量进行了比较,结果表明利用玉米蛋白粉作为原料具有较大经济价值,但本研究以含量作为考察指标,3个目标产物含量均较低。王世宽等[11]研究了溶剂法与超临界CO2萃取玉米蛋白粉中黄色素的工艺比较并得出结论:超临界CO2法萃取玉米黄色素的得率明显高于溶剂法,但黄色素为一种含有叶黄素的色素混合物,不能很好的满足食品医药等行业的需要。马志虎等[12]研究了利用超临界法萃取栝楼皮中叶黄素的工艺条件,对工艺参数进行了优化并进行了栝楼皮叶黄素的稳定性研究,但未研究夹带剂浓度对叶黄素萃取效果的影响,且采用分光光度计法定量,由于各种类胡萝卜素在紫外-可见光波长范围有不同程度的吸收,因此分光光度法测的是混合物的吸光度,不适宜作为叶黄素的定量定性方法。本实验以叶黄素纯度为考察指标,采用C30柱作为固定相的HPLC法[13]对玉米叶黄素的纯度进行了测定分析[14],对玉米蛋白粉中叶黄素的提取工艺参数进行研究,旨在得到一种快速、高效、绿色环保且叶黄素纯度较高的提取工艺,以满足食品医药等行业对叶黄素的需求。
1 材料与方法
1.1 材料与试剂
玉米蛋白粉 黑龙江昊天玉米开发有限公司;CO2气体(纯度99.99%) 大庆雪龙气体股份有限公司;乙醇、丙酮均为国产分析纯;甲基叔丁基醚、甲醇为色谱纯。
1.2 仪器与设备
hA121-50-01超临界萃取装置 南通市华安超临界萃取有限公司;JD100-38电子天平 沈阳龙腾电子有限公司;1200高效液相色谱装置 美国安捷伦公司;TGL-16B高速台式离心机 上海安亭科学仪器厂。
1.3 超临界CO2萃取
在超临界CO2萃取分离过程中,对工艺影响较大的因素主要有压力、温度、时间、CO2流量、夹带剂体积分数、物料与夹带剂的比例。玉米叶黄素分子中含有两个羟基,因此具有一定的极性。为了增加超临界流体CO2的极性,提高叶黄素的纯度,增强萃取效果,需要在实验过程中添加一定量的夹带剂,常用的夹带剂有甲醇、乙醇、丙酮、丙烷等,丙酮或乙醇均可得到满意的提取效果,但丙酮易挥发、易燃,从食品安全性考虑,选用乙醇作为夹带剂,添加量为5mL/100g[15]。
准确称取300g玉米蛋白粉,加入超临界萃取釜中,称取15mL乙醇作为夹带剂,在温度45℃、压力30MPa条件下萃取3h,收集分离釜中的萃取液,进行前处理用高效液相色谱检测其纯度。固定其他条件,分别考察萃取压力(20~40MPa)、萃取温度(30~50℃)、萃取时间(1~5h)、夹带剂乙醇的体积分数(80%~99.7%)对叶黄素纯度的影响。在单因素试验基础上,以叶黄素纯度为响应值,利用响应面分析优化得出超临界萃取玉米叶黄素最佳工艺参数。
1.4 样品的前处理及其测定
准确称取一定量萃取液,加入相同体积丙酮,待萃取液澄清后进行高速离心,吸取上清液以0.45μm的微孔滤膜过滤,待测。
1.5 叶黄素纯度的高效液相色谱分析
根据赵显峰等[16]的描述的方法改进。色谱条件:流动相:A相:甲基叔丁基醚;B相:甲醇-水(体积比为81:4);洗脱梯度为:0~40min内B由81%逐渐减少为11%, 0~40min内A由15%逐渐增加为85%;水全程为4%。色谱柱为C30柱(250mm×4.6mm,5μm),检测波长:450nm;流速:0.85mL/min;进样量:20μL;柱温:25℃。
2 结果与分析
2.1 不同条件对叶黄素纯度的影响
2.1.1 萃取温度对叶黄素纯度的影响

图1 萃取温度对叶黄素纯度的影响Fig.1 Effect of extraction temperature on lutein purity
由图1可知,在萃取压力30MPa的条件下,当温度为30~40℃时玉米叶黄素的纯度随温度的增加而升高,40℃时达到最大值(42.72%),并显著高于其他温度下的纯度(P<0.05)。40℃后,随着温度的升高,纯度逐渐下降。这是因为萃取温度对超临界流体溶解能力影响比较复杂,一方面升高温度,分子热运动加快,溶质的传质系数、挥发度和扩散速度提高,而且叶黄素挥发性增加,这样就增加了被萃取物在超临界气相中的浓度,从而使萃取量增大,提取率逐渐升高。另一方面,温度升高,超临界流体密度降低,导致流体溶解能力降低,从而使化学组分溶解度减小,对萃取不利,导致萃取数减少,因此在40℃以后叶黄素纯度降低。因此选取萃取温度为40℃,提取效果最好[17-18]。
2.1.2 萃取压力对叶黄素纯度的影响

图2 萃取压力对叶黄素纯度的影响Fig.2 Effect of extraction pressure on lutein purity
由图2可知,在萃取温度为45℃、时间为3h的条件下,在15~20MPa范围内叶黄素纯度随萃取压力的增加而升高,这是由于随着萃取压力的增加超临界流体密度增大,对叶黄素的溶解能力增强。当萃取压力上升到20MPa时叶黄素的纯度达到最高(39.68%),当压力超过20MPa时,叶黄素纯度又呈下降趋势,这是由于压力过大,扩散系数减小,阻碍传质,并且压力增大流体流量会升高,减小了超临界CO2在物料中的传质时间,这在一定程度上影响叶黄素纯度[18]。因此,超临界CO2萃取叶黄素较好的萃取压力为20MPa。
2.1.3 萃取时间对叶黄素纯度的影响

图3 萃取时间对叶黄素纯度的影响Fig.3 Effect of extraction time on lutein purity
由图3可知,在萃取温度45℃、压力30MPa的条件下,在初始阶段,玉米叶黄素纯度较低,到2h时达到最大值(48.37%),2h后随着时间延长,叶黄素纯度有所下降,3~5h提取时间下的叶黄素纯度差异不显著(P>0.05),从节约成本,提高提取效率方面考虑,选择萃取时间为2h。
2.1.4 夹带剂体积分数对叶黄素纯度的影响

图4 乙醇体积分数对叶黄素纯度的影响Fig.4 Effect of ethanol concentration on lutein purity
由图4可知,在萃取温度45℃、压力30MPa的条件下,随着夹带剂体积分数的增加,叶黄素纯度先增大后减小,当乙醇体积分数为90%时叶黄素纯度最高(43.56%),显著高于其他浓度条件下的叶黄素纯度(P<0.05)。原因是乙醇体积分数较低时水分较多,带出了许多水溶性杂质,故使纯度偏低,而当乙醇体积分数过高时,随着乙醇体积分数的进一步增加,可能是由于一些醇溶性杂质等溶出量增加,这些成分与叶黄素竞争同乙醇分子结合从而导致纯度下降[19]。因此综合经济效益和现实可行性,选择夹带剂乙醇的体积分数为90%。
2.2 响应面分析法优化玉米叶黄素萃取工艺条件
2.2.1 分析因素的选取及分析方案
根据Box-Behnken试验设计原理,综合单因素试验结果,固定夹带剂体积分数为90%,选取萃取时间、萃取温度和萃取压力对叶黄素提取影响的3个显著因素,分别以A、B和C代表,每一个自变量的低、中、高实验水平分别以-1、0、1进行编码,如表1所示,实验方案及结果见表2。

表1 叶黄素提取响应面分析因素与水平Table1 Factors and levels used in response surface analysis
2.2.2 模型方程的建立与显著性检验

表2 叶黄素提取响应面分析方案及结果Table2 Experimental design and results for response surface analysis
利用Design Expert软件,通过表2中叶黄素纯度试验数据进行多元回归拟合,获得叶黄素纯度对编码自变量萃取时间、萃取温度和萃取压力的回归方程为:Y=-202.87810+23.93660A+10.25202B+0.27270C-0.069500AB-0.13750AC+0.027900BC-2.77985A2-0.13139B2-0.018794C2。由表3可知,整体模型的P值小于0.01,表明该二次方程模型高度显著。萃取时间和萃取温度影响高度显著,而萃取压力较不显著。在所选取的各因素水平范围内,按照对结果的影响排序,萃取温度>萃取时间>萃取压力。
由表3可知,回归方差分析显著性检验表明,该模型回归显著(P<0.0001),失拟项不显著,并且该模型的R2=0.9806,说明该模型与实际实验拟合较好,自变量与响应值之间线性关系显著,可以用于玉米叶黄素提取实验的理论预测。
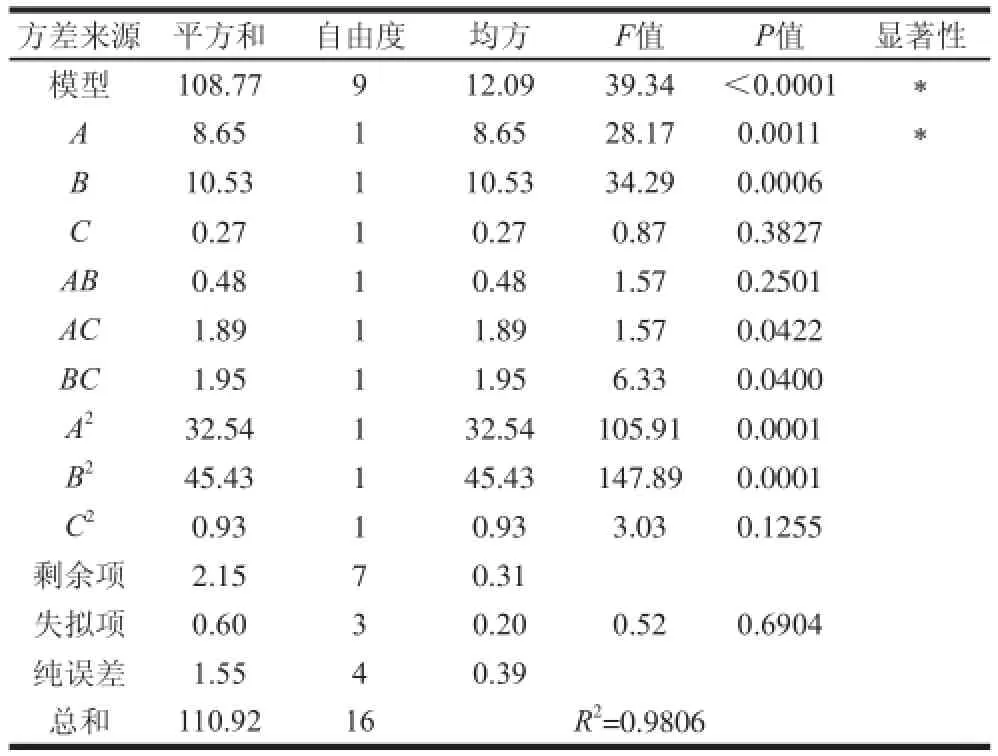
表3 回归模型方程的方差分析Table3 Analysis of variance for the fitted regression model
2.2.3 因素间的交互影响


图5 各因素交互影响的等高线和响应曲面Fig.5 Response surface and contour plots showing the effects of temperature, pressure and time on lutein purity
图5直观地反映了各因素交互作用对响应值的影响。比较3组图可知,萃取时间和萃取温度对叶黄素纯度的影响显著,表现为曲线较陡;萃取压力对叶黄素纯度的影响不显著,其表现为曲线较为平缓;由萃取时间和萃取温度对叶黄素纯度的交互效应可知,随萃取时间的延长和萃取温度的升高,叶黄素纯度逐渐提高,但当两者增大到一定程度(萃取时间约2.3h左右,萃取温度约42℃左右)时,叶黄素纯度反而下降。从其等高线图可以直观地看出该两个因素的交互作用不显著,在编码值为0以上的萃取温度在萃取时间的一定范围内都能够得到较大的响应值。萃取时间和萃取压力交互效应显示了萃取温度为25℃时,随萃取时间的增加和萃取压力的升高,叶黄素纯度逐渐提高,但当两者增大到一定程度(萃取时间约2.3h左右,萃取压力约30MPa左右)时,叶黄素纯度反而下降。从其等高线图可以直观地看出该两个因素的交互作用不大,在编码值为0以上的萃取压力在萃取时间的一定范围内都能够得到较大的响应值。萃取温度和萃取压力显示了萃取时间为3h时,随萃取温度的升高和萃取压力的增大,叶黄素纯度逐渐提高,但当两者增大到一定程度(萃取温度约42℃左右,萃取压力约30MPa左右)时,叶黄素纯度反而下降。从其等高线图可以直观地看出该两个因素的交互作用不大,在编码值为0以上的萃取压力在萃取温度的一定范围内都能够得到较大的响应值。
2.2.4 叶黄素提取工艺条件的确定
通过软件Design-Expert 8.0.4求解方程,得出了最优提取工艺条件为:萃取时间2.29h、萃取温度41.56℃、萃取压力29.74MPa。在该条件下由响应面模型预测的叶黄素纯度为46.48%。考虑到实际操作的可行性并取得最佳效果的目的,将叶黄素的提取工艺条件修正为:萃取时间2.3h、萃取温度42℃、萃取压力30MPa。为检验结果的可靠性,采用修正条件进行3次验证实验,结果得出叶黄素的实际纯度为46.50%,与理论预测值基本吻合。因此,利用响应面分析法得到的叶黄素提取工艺参数真实可靠,具有实用价值。
3 结 论
3.1 本研究所选取的夹带剂为乙醇,萃取效果最好,且价格低廉,毒性小,提取后的玉米蛋白粉仍可继续作为饲料使用,有效的提高了玉米蛋白粉的附加值。
3.2 应用响应面分析法优化叶黄素的提取工艺,结果显示,以纯度为指标的叶黄素提取最佳工艺参数为:萃取时间2.3h、萃取温度42℃、萃取压力30MPa。
3.3 超临界CO2萃取玉米叶黄素的最佳工艺条件为:夹带剂90%乙醇、添加量5mL/100g、萃取时间2.3h、萃取温度42℃、萃取压力30MPa,此时叶黄素的纯度为46.50%。
3.4 在萃取实验过程中,未用到对人体有害的有机溶剂,避免了有害溶剂的微量残留,提取到的叶黄素产品更加安全。因此,超临界CO2萃取玉米叶黄素是一种快速、高效、绿色环保的提取方法。
[1] 李秀霞, 孙协军, 韩鲁佳. 玉米蛋白粉中叶黄素的提取和纯化[J]. 食品科学, 2010, 31(16): 72-77.
[2] 幸宏伟. 抗氧化剂: 叶黄素[J]. 重庆工商大学学报: 自然科学版, 2006(5): 477-480.
[3] 任红, 杨洋, 史德芳. 叶黄素在功能性食品中的应用进展[J]. 食品研究与开发, 2006(4): 144-146.
[4] BONE R A, LANDRUM J T, GUERRA L H, et al. Lutein and zeaxanthin dietary supplements raise macular pigment density and serum concentrations these carotenoids in humans[J]. J Nutr, 2003, 133(4): 992-998.
[5] GRUBER M, CHAPPELL R, MILLEN A, et al. Correlates of serum lutein+zeaxanthin: findings from the third national health and nutrition examination survey[J]. J Nutr, 2004, 134(9): 2387-2394.
[6] 刘大川. 对高新技术在油脂与植物蛋白工业中应用的评述[J]. 中国油脂, 2004(3): 8-12.
[7] RIZVI S S. Supercritical fluid processing of food and biomaterials[M]. London: Blackie Academic and Processional, 1994: 44-61.
[8] 卢艳杰, 展海军, 周展明, 等. 玉米黄色素提取工艺的研究: 二[J]. 中国粮油学报, 2003, 18(1): 37-40.
[9] 李秀霞, 韩鲁佳. 玉米蛋白粉叶黄素酶解辅助提取工艺优化研究[J].中国粮油学报, 2009, 24(9): 27-31.
[10] 大庆石油管理局, 大庆石油管理局技术开发实业公司. 用超临界CO2萃取叶黄素提取物工艺: 中国, CN02106381.8[P]. 2002-09-04.
[11] 王世宽, 郭春晓, 周永进, 等. 溶剂法与超临界二氧化碳法萃取玉米黄色素生产工艺的比较[J]. 粮食与饲料工业, 2006(10): 27-28.
[12] 马志虎, 侯喜林, 陈红霞, 等. 栝楼皮叶黄素的超临界CO2萃取及其稳定性研究[J]. 精细化工, 2009, 26(12): 1215-1220.
[13] CHEN Sibao, LIU Heping, TIAN Runtao, et al. High-performance thin-layer chromatographic fingerprints of isoflavonoids for distinguishing between Radix Puerariae Lobate and Radix Puerariae Thomsonii.[J]. J Chromatogr A, 2006, 1121(1): 114-119.
[14] 惠伯棣. 类胡萝卜素化学及生物化学[M]. 北京: 中国轻工业出版社, 2005: 258
[15] 曹龙奎, 包鸿慧, 周睿. 玉米黄色素超临界CO2流体萃取技术及稳定性研究[J]. 粮食与饲料工业, 2008(3): 10-16.
[16] 赵显峰, 潘丽莉, 孟晶, 等. 高效液相色谱法测定蔬菜中类胡萝卜素组分[J]. 卫生研究, 2008(2): 228-230.
[17] 蒋崇文. 超临界流体色谱法分离与制备天然维生素E的研究[D]. 杭州: 浙江大学, 2003.
[18] TAKAHASHI M, WATANABE H, KIKKAWA J, et al. Carotenoids extraction from Japanese persimmon (Hachiyakaki) peels by supercritical CO2with ethanol[J]. Analytical Sciences, 2006, 22(11): 1441-1447.
[19] 张杨. 超临界CO2萃取柚子鲜花挥发成分和SAS研究[D]. 芜湖: 安徽师范大学, 2003.
Optimization of Supercritical CO2Extraction of Lutein from Corn Protein Powder by Response Surface Methodology
TONG Wan-bing,CAO Long-kui*,SONG Liang
(College of Food Science, Heilongjiang Bayi Agricultural University, Daqing 163319, China)
The supercritical CO2extraction of lutein from corn protein powder was optimized by response surface methodology. Lutein purity was determined by HPLC. Extraction time, temperature and pressure were identified by onefactor-at-a-time method as main variables that influence extraction efficiency. The optimal extraction conditions were found to be extraction at 42 ℃ and 30 MPa for 2.3 h using 90% ethanol as the entrainer at a dosage of5 mL/100 g. The predicted lutein content (i.e., purity) of extracts under these conditions was 46.50%.
lutein;supercritical CO2extraction;response surface methodology
TS210.1
A
1002-6630(2013)04-0037-05
2011-10-13
“十一五”国家重大科技专项(2009GB2B200100)
佟万兵(1987—),男,硕士,研究方向为农产品加工。E-mail:bingge19870820@163.com
*通信作者:曹龙奎(1965—),男,教授,博士,研究方向为农产品加工。E-mail:longkuicao@yahoo.com.cn

