响应面法优化蓝莓叶多酚提取工艺
冯 进,曾晓雄,李春阳*
(1.江苏省农业科学院农产品加工研究所,江苏 南京 210014;2.南京农业大学食品科技学院,江苏 南京 210095)
响应面法优化蓝莓叶多酚提取工艺
冯 进1,2,曾晓雄2,李春阳1,*
(1.江苏省农业科学院农产品加工研究所,江苏 南京 210014;2.南京农业大学食品科技学院,江苏 南京 210095)
采用乙醇提取蓝莓叶中多酚。在单因素试验的基础上,通过Plackett Burman试验筛选出对蓝莓叶多酚提取具有显著影响的因子:乙醇体积分数(P=0.0025)、提取温度(P=0.0091)、料液比(P=0.0236)、提取时间(P=0.0156);采用响应面法优化,得到最佳工艺条件为乙醇体积分数62.05%、提取温度67.54℃、料液比1:23.65、提取时间2.06h,在此条件下,多酚提取率为90.49%。同时,建立了醇提蓝莓叶多酚的二次数学模型,对蓝莓叶多酚提取具有良好的预测作用。
蓝莓叶多酚;提取工艺;Plackett Burman试验设计;响应面法
蓝莓又名笃斯越橘、蓝浆果等,原产于北美[1],按照植物学分类,属于杜鹃花科(Ericaceae)越橘亚科越橘属(Vaccinium.spp)多年生落叶或常绿灌木。蓝莓叶具有药用价值,其性温、味苦,有解毒之功效[2]。蓝莓叶中含有大量的酚类物质[3],多酚具有较强的抗氧化作用,以及抗癌,抗老化等功效[4],对人体健康具有积极的意义。Matsuo等[5]发现蓝莓叶中多酚主要为低聚原花青素,另外还含有咖啡酰奎宁酸、黄酮苷、黄酮烷-三醇、儿茶素等。Takeshita等[6]研究证明蓝莓叶中聚合度为8和9的原花青素对丙肝病毒 RNA表达能力有很强的抑制作用。Squpień等[7-8]研究发现蓝莓叶提取物对白血病敏感细胞HL60及其两种抗药亚种具有抑制作用。此外,研究发现蓝莓叶多酚提取物有降血脂[9]、降血压的生理活性[10]。目前,国内对蓝莓果实进行了大量的研究,但是对蓝莓叶的开发利用却鲜见报道。本实验采用单因素试验、Platkett Burman 试验设计和响应面分析对蓝莓叶多酚提取工艺进行优化,为蓝莓叶中多酚物质的开发利用提供理论依据和实验基础。
1 材料与方法
1.1 材料与试剂
蓝莓叶采于江苏省南京市溧水县,烘干备用。
无水乙醇、丙酮、浓盐酸、正丁醇、无水碳酸钠、β-巯基乙醇、SDS、Tris碱 国药集团化学试剂有限公司;葡萄籽原花青素标准品(纯度≥99%) 天津尖峰天然产物研究开发有限公司;Folin-Ciocalteu试剂 美国Sigma公司。
1.2 仪器与设备
THZ-Q 台式冷冻恒温振荡器 太仓市华美生化仪器厂;DD-5M湘仪离心机 长沙湘仪离心机仪器有限公司;KQ-500DV数控超声清洗器 昆山市超声仪器有限公司;FW-177型中草药捣碎机 天津泰斯特仪器有限公司;SK-1快速混匀机 江苏省金坛市荣华仪器有限公司;752S紫外-可见分光光度计 上海棱光技术有限公司;PHS-2C数显pH计 上海仪器仪表有限公司;电热恒温鼓风干燥箱 上海新苗医疗器械制造有限公司。Eyela FDU-1200冷冻干燥机 东京理化器械株式会社。1.3 方法
1.3.1 蓝莓叶中游离态多酚含量的测定
以原花青素为标准品,根据正丁醇-盐酸法绘制标准曲线。用70%丙酮分别配制质量浓度0.1、0.2、0.3、0.4、0.5mg/mL的原花青素溶液,各取1mL加入6mL 95%的正丁醇-盐酸溶液,沸水浴中反应60min,在550nm处测定吸光度。得到标准曲线方程为:Y=1.8377X+0.0496,R2=0.9951。
蓝莓叶游离态多酚的提取与测定参照Porter等[11]的方法略有改动。取蓝莓叶200mg,加入20mL 70%的丙酮,在50℃下搅拌提取2h,提取3次,合并滤液,定容后取待测液适当稀释后显色,方法同上。
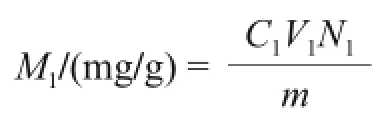
式中:C1为根据标准曲线计算出待测液中多酚质量浓度/(mg/mL);V1为待测液体积/mL;N1为稀释倍数;m为蓝莓叶质量/g。
1.3.2 蓝莓叶蛋白质结合态多酚含量的测定
以原花青素为标准品,根据正丁醇-盐酸法绘制标准曲线。用SDS-β巯基乙醇混合液分别配制质量浓度为0.1、0.2、0.3、0.4、0.5mg/mL的原花青素溶液,各取1mL加入6mL 95%的正丁醇-盐酸溶液,沸水浴中反应60min,在550nm波长处测定吸光度。得到标准曲线方程为:Y=1.6583X-0.0342,R2=0.9951。
蛋白质结合态多酚的提取与测定参照Terril等[12]的方法。在1.3.1节残渣(冷冻干燥)中加入20mL SDS-β巯基乙醇混合液,室温振荡提取15min,转入沸水浴中提取45min,提取3次,合并上清液,取1mL显色,方法同上,用95%正丁醇-水溶液代替95%正丁醇-盐酸做空白对照。

式中:C2为根据标准曲线计算出待测液中多酚质量浓度/(mg/mL);V2为待测液体积/mL;N2为稀释倍数;m为蓝莓叶质量/g。
1.3.3 蓝莓叶纤维素结合态多酚含量的测定
标准曲线的制作同1.3.2节,标准方程为:Y=1.2261X-0.0274,R2=0.9913。
纤维素结合态多酚的提取与测定参照Giner等[13]的方法,在1.3.1节的残渣(冷冻干燥)中加入22mL混合溶液A,在沸水浴中提取60min,提取两次,冷却,离心,合并上清液,定容后取待测液适当稀释后显色,测定方法参照同上,用95%正丁醇-水代替95%正丁醇-盐酸做空白对照。
式中:C3为根据标准曲线计算出待测液中多酚含量/ (mg/mL);V3为待测液体积/mL;N3为稀释倍数;m为蓝莓叶质量/g。
1.3.4 蓝莓叶总酚的提取与测定
称取一定质量的蓝莓叶干粉,加入乙醇溶液,在台式冷冻恒温振荡器中振荡提取,离心后合并上清液,定容,滤液过滤膜后取1mL用80%乙醇适当稀释,进行多酚含量的测定。
根据Folin-Ciocalteu法[14]测定提取液中的多酚含量。得到标准曲线方程为:Y=7.2110X+0.0152,R2=0.9994。
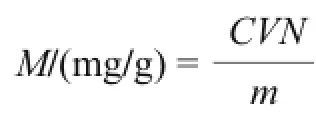
式中:C为根据标准曲线计算出待测液中多酚含量/ (mg/mL);V为待测液体积/mL;N为稀释倍数;m为蓝莓叶质量/g。
多酚提取率计算公式如下:

式中:M为提取液中多酚含量/(mg/g);M1为游离态多酚含量/(mg/g);M2为蛋白质结合态多酚含量/(mg/g);M3为纤维素结合态多酚含量/(mg/g)。
1.3.5 单因素试验
称取2g蓝莓叶粉,加入体积分数60%的乙醇溶液(pH4)60mL,在50℃恒温箱中振荡2h,提取1次,过滤,滤液浓缩、定容,进行测定。固定其他条件,分别考察乙醇体积分数(20%~100%)提取温度(30~80℃)、料液比(1:10~1:80)、提取时间 (0.5~4.5h)、pH值(2~10)、提取次数(1~4次)对蓝莓叶多酚提取率的影响。
1.3.6 Plackett Burman试验设计
选用N=8的Plackett Burman试验设计,对上述6个指标进行研究,评价指标为多酚提取率,根据单因素的试验结果,每个因素取3个水平,编码水平见表1。
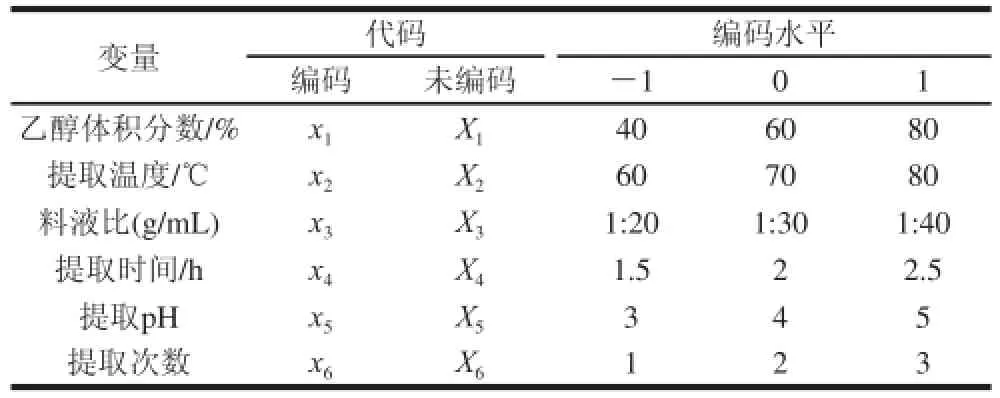
表1 Plakett Burman试验设计因素水平及编码Table1 Coded values and corresponding real values of the extraction parameters used in Plackett Burman design
1.3.7 响应面法试验设计
通过1.3.6节设计筛选出显著性影响因素之后,采用Box-Behnken模型,以显著性影响因素作为考察因子进行四因素三水平共29组试验。根据获得的回归模型方程,可分析各因子的主效应和因子之间的交互效应,同时,可用响应面图和等高线图对模型进行直观的描绘,预测处蓝莓叶多酚提取率最高的因子组合。编码水平设计见表2。

表2 响应面设计因素水平及编码Table2 Coded values and corresponding real values of the extraction parameters used in response surface analysis
2 结果与分析
2.1 单因素试验结果
2.1.1 乙醇体积分数对蓝莓叶多酚提取率的影响
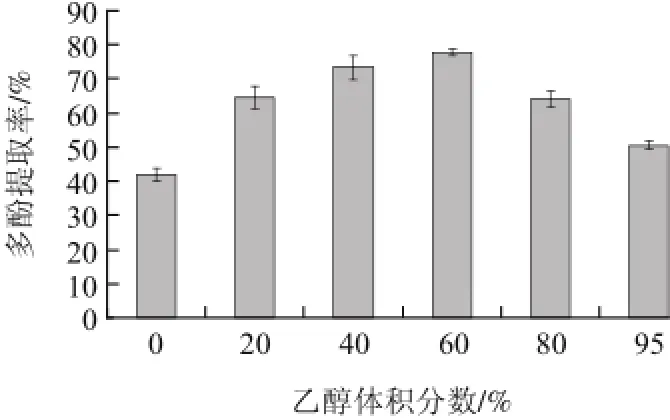
图1 乙醇体积分数对蓝莓叶多酚提取率的影响Fig.1 Effect of ethanol concentration on the extraction efficiency of polyphenols
从图1可以看出,多酚提取率随乙醇体积分数的增大先增加后减小,在60%时达到最大值,为77.56%。根据相似相溶原理,与蓝莓叶多酚极性相似的溶剂可以使其充分溶于溶剂中从而被提取出来[15]。多酚在植物体内常与蛋白质等以氢键的形式形成稳定的复合物,乙醇体积分数过低,溶剂对氢键的破坏能力不强,从而使提取率降低[16];乙醇体积分数过高,溶剂极性低,导致提取率下降,并且会增加叶绿素等脂溶性物质的溶出[2],给后续的分离纯化工作造成不便。因此,选择60%的乙醇作为提取溶剂。
2.1.2 提取温度对多酚提取率的影响

图2 提取温度对蓝莓叶多酚提取率的影响Fig.2 Effect of temperature on the extraction efficiency of polyphenols
从图2可以看出,在30~70℃范围内,多酚提取率随着温度的升高而升高,在70℃达到最高点,提取率为84.45%。温度进一步升高,高温促使多酚类物质的氧化变性,因此,多酚提取率有着明显的下降,80℃多酚提取率同70℃多酚提取率有着显著性差异(P<0.05),因此,选择70℃作为最佳提取温度。
2.1.3 料液比对多酚提取率的影响

图3 料液比对蓝莓叶多酚提取率的影响Fig.3 Effect of solid-to-liquid ratio on the extraction efficiency of polyphenols
从图3可以看出,料液比在1:10~1:30的范围内,多酚的提取率有着显著性的提高,继续提高料液比对蓝莓叶多酚提取率无显著性影响。另外,料液比过大也会造成资源的浪费并对后续的分离纯化不利。因此,最佳料液比为1:30。
2.1.4 提取时间对多酚提取率的影响
从图4可以看出,在2h内,多酚提取率随提取时间的延长而增大,提取时间为2h使提取率最大为81.79%。当提取时间为2.5h时,蓝莓叶多酚提取率较2h比较差异不显著(P<0.05),在3.5h时提取率有所回升,但与3h相比差异不显著(P<0.05)。因此,选取提取时间为2h。
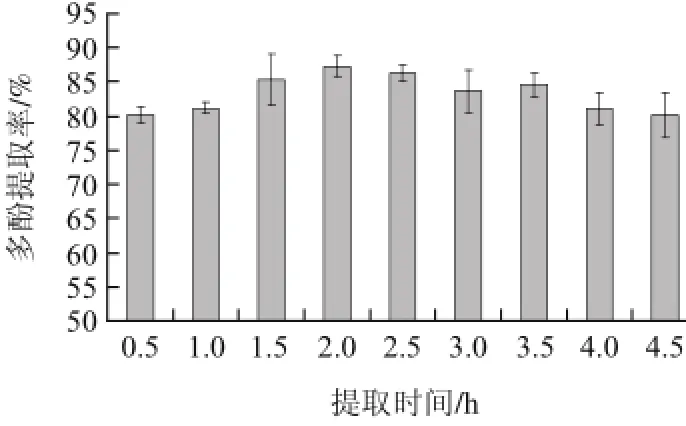
图4 提取时间对蓝莓叶多酚提取率的影响Fig.4 Effect of time on the extraction efficiency of polyphenols
2.1.5 提取pH值对多酚提取率的影响
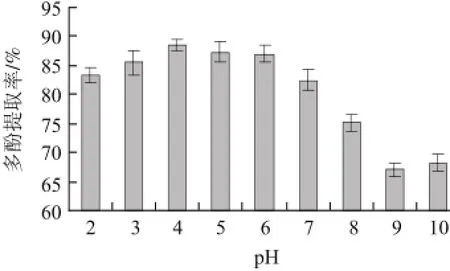
图5 pH值对蓝莓叶多酚提取率的影响Fig.5 Effect of solvent pH on the extraction efficiency of polyphenols
从图5可以看出,不同pH值下蓝莓叶多酚提取率存在显著性差异(P<0.05),酸性条件可以破坏多酚类物质与蛋白质、多糖等的结合,并且可以降低多酚对光和氧气的敏感度,从而提高多酚提取率[17]。pH4时,蓝莓叶多酚提取率达到最大值88.57%。
2.1.6 提取次数对多酚提取率的影响
多次提取可以增加蓝莓叶多酚的提取量,但会对后续的分离纯化造成一定难度。由图6可知,2次提取的多酚提取率为89.16%,2、3、4次提取的多酚提取率没有显著性差异(P<0.05),因此,选择提取2次作为最佳提取工艺。

图6 提取次数对蓝莓叶多酚提取率的影响Fig.6 Effect of number of extractions on the extraction efficiency of polyphenols
2.2 影响蓝莓叶多酚提取率的显著因子
使用N=8的PB试验从6种单因素中筛选出影响蓝莓叶多酚提取率显著的影响因子,PB试验设计及其结果如表3所示,运用Design Expert软件,得到蓝莓叶多酚提取率预测值(Y)的多元一次回归模型方程为:Y= 81.52-0.16X1+0.09X2-0.04X3+0.16X4-0.10X5-0.10X6。

表3 PB试验设计及结果Table3 Plackett Burman design matrix and results
通过回归模型的系数评估及其显著性检验(表4)发现,乙醇体积分数(P=0.0025)、提取温度(P=0.0091)、料液比(P=0.0236)、提取时间(P=0.0156)是影响蓝莓叶多酚提取率的显著性因素。
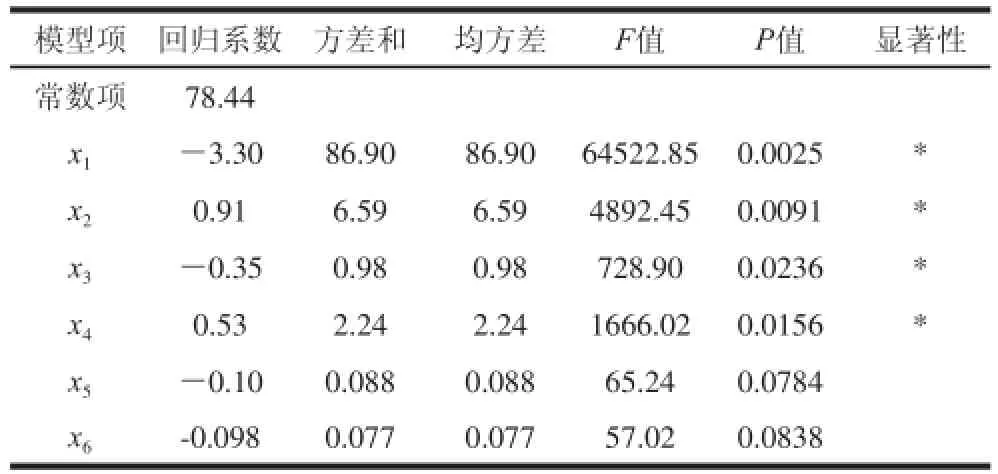
表4 PB试验设计多元回归模型系数评估及其显著性检验Table4 Regression coefficients and statistical significance in the fitted regression model based on Plackett Burman design
2.3 Box-Behnken设计试验结果与分析
运用Design-Expert软件,对蓝莓叶多酚提取率显著影响因素进行响应面分析,Box-Behnken试验设计及结果见表5,得到蓝莓叶多酚提取率(Y)的多元二次回归模型:
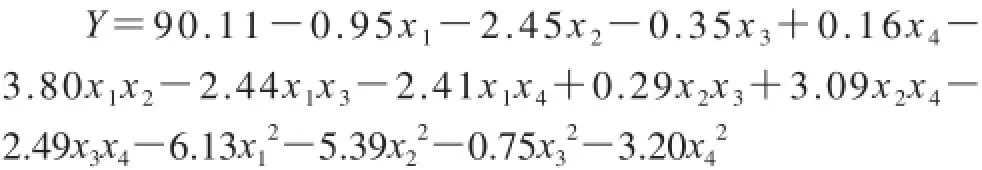
对上述回归模型方差分析结果如表6所示,F检验显示回归模型具有很高的F值(F=5.61)和很低的P值(P=0.0013),说明模型高度显著。
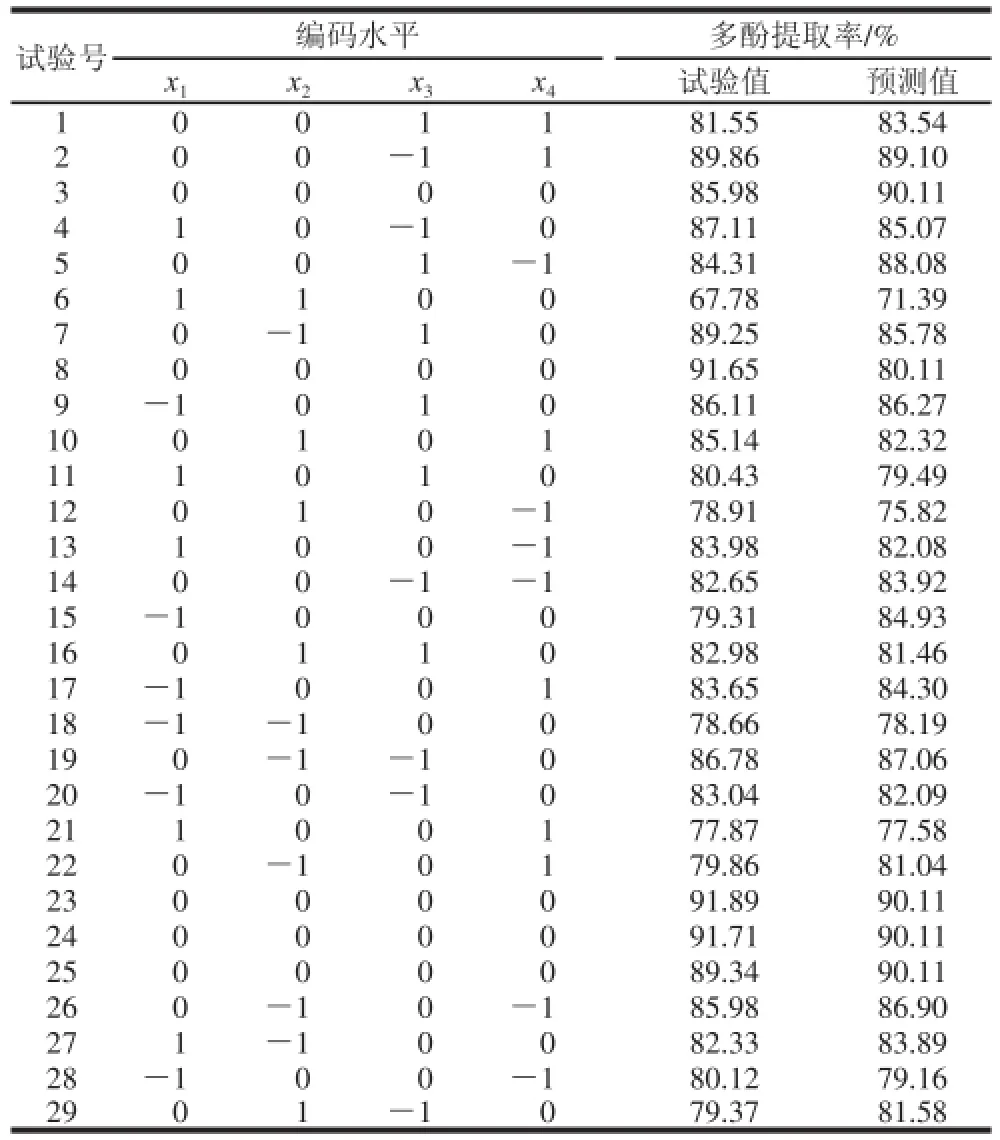
表5 Box-Behnken试验设计及结果Table5 Box-Behnken experimental design matrix and results
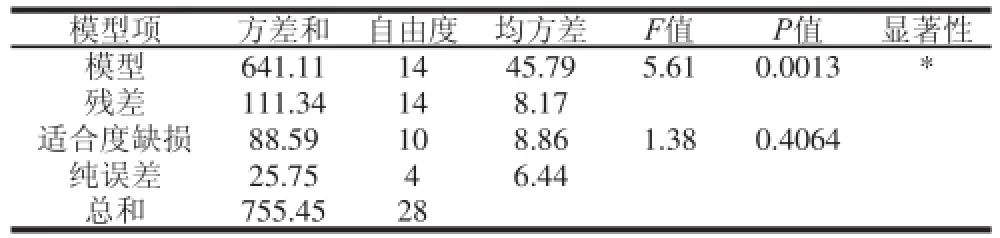
表6 Box-Behnken设计的多元回归模型方差分析Table6 ANOVA for the fitted regression model based on Box-Behnken experimental design

表7 Box-Behnken设计多元回归模型系数评估及其显著性检验Table7 Regression coefficients and statistical significance in the fitted regression model based on Box-Behnken experimental design
2.4 蓝莓叶多酚提取率响应面分析
通过Box-Behnken试验得到的多元二次回归模型所作的响应面图及其高线图可用于评价试验因素对蓝莓叶多酚提取率影响的两两交互作用以及确定各个因素的最佳水平范围。
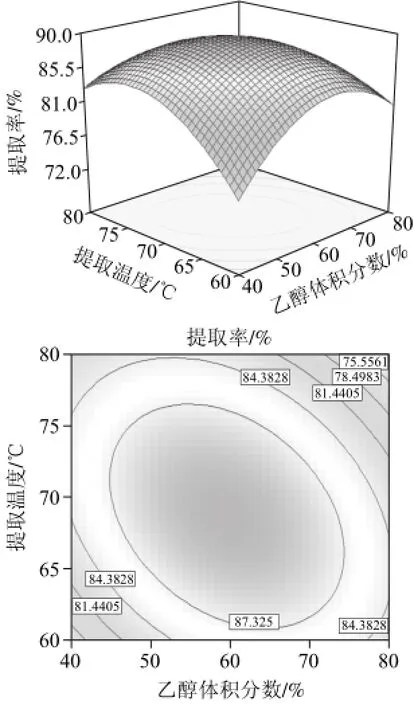
图7 乙醇体积分数和提取温度对蓝莓叶多酚提取率影响的响应面图和等高线图Fig.7 Response surface contour plots showing the effects of ethanol concentration and temperature on the extraction efficiency of polyphenols

图8 提取温度和提取时间对蓝莓叶多酚提取率影响的响应面图和等高线图Fig.8 Response surface contour plots showing the effects of temperature and time on the extraction efficiency of polyphenols
图7表明,固定乙醇体积分数、多酚提取率随着提取温度的升高而增加,但是温度过高容易使多酚发生氧化,从而降低提取率;固定提取温度,多酚提取率随乙醇体积分数的增加先增加后减小。图8表明,增加提取时间有利于提高多酚提取率,在2.1h时多酚提取率达到峰值,再增加提取时间反而会减少提取率。图7与图8的等高线图均呈椭圆形,说明乙醇体积分数与提取温度、提取温度与提取时间的交互作用较强,影响显著。
根据所建立的模型进行参数最优化分析,得到多酚提取率最高的参数条件为乙醇体积分数62.05%、提取温度67.54℃、料液比1:23.65、提取时间2.06h,在此条件下多酚提取率预测值为90.49%。为方便试验将参数修改为:乙醇体积分数62%、提取温度68℃、料液比1:24、提取时间2h。按照上述条件进行蓝莓叶多酚提取验证实验,实测蓝莓叶多酚提取率为(89.02±0.02)%,基本和预测值保持一致。
3 结 论
3.1 通过单因素试验发现,各因素最佳值为:乙醇体积分数60%、提取温度70℃、料液比1:30、提取时间2h,pH4,提取次数2次。
3.2 通过PB试验发现:乙醇体积分数(P=0.0025)、提取温度(P=0.0091)、料液比(P=0.0236)、提取时间(0.0156)是影响蓝莓叶多酚提取率的显著性因素。
3.3 利用Box-Behnken试验,得到最佳工艺参数为乙醇体积分数62.05%,提取温度67.54℃,料液比1:23.65,提取时间2.06h。在此条件下,最大提取率为90.49%。其中乙醇体积分数与提取温度、提取温度与提取时间的交互作用明显。
[1] MARVIN P, JAMES F. Highbush blueberry production guide[M]. Ithaca: Northeast Regional Agricultural Engineering Service, 1992: 4-7.
[2] 张玉香, 曲慧鸽, 张润亚, 等. 响应面法优化蓝莓叶黄酮的微波提取工艺[J]. 食品科学, 2010, 31(16): 33-37.
[3] EHLENFELDT M K, PRIOR R L. Oxygen radical absorbance capacity (ORAC) and polyphenolics and ahthocyanin concerntrations in fruit and leaf tissue of highbush blueberry[J]. Journal of Agricultural and Food Chemistry, 2001, 49(5): 2222-2227.
[4] MORTON L W, CROFT K D, PUDDEY I B, et al. Phenolic acid protect low-density lipoproteins from peroxynitrite-mediated modification in vitro[J]. Redox Report, 2000, 5(2/3): 124-125.
[5] MATSUO T, FUJITA Y, OHNISHI S, et al. Chemical constitution of the leaves of rabbiteye blueberry (Vacinium ashei) and characterisation of polymeric proanthocyanidins containing phenypropanoid units and A-type linkages[J]. Food Chemistry, 2010, 121(4): 1073-1079.
[6] TAKESHITA M, ISHIDA Y, HIROAKI K, et al. Proanthocyanidin from blueberry leaves suppress expression of hepatitis C virus RNA[J]. Journal of Biological Chemistry, 2009, 284(32): 21165-21176.
[7] SQUPIEŃ K, KOSTRZEWA-NOWAK D, OSZMIAŃSKI J, et al. In vitro antileukeamic activity of extracts from chokeberry (Aronia melanocarpa [Michx] Elliott) and mulberry (Morus alba L.) leaves against sensitive and multidrug resistant HL60 cells[J]. Phytotherapy Research, 2008, 22(5): 689-694.
[8] SQUPIEŃ K, OSMIAŃSKI J, KOSTRZEWA-NOWAK D, et al. In vitro antileukeamic activity of extracts from berry plants leaves against sensitive and multidrug resistant HL60 cells[J]. Cancer letters, 2006, 236(2): 289-291.
[9] NAGAO K, HIGA K, SHIROUCHI B, et al. Effects of Vaccinium ashei reade leaves on lipid metabolism in Otsuka Long-Evans Tokushima fatty rats [J]. Biosci Biotechnol Biochem, 2008, 72(6): 1619-1622.
[10] SAKAIDA H, NAGAO K, HIGA K, et al. Effect of Vaccinium ashei reada leaves on angiotensin converting enzyme activity in vitro and on systolic blood preasure of spontaneously hypertensive rats in vitro[J]. Biosci Biotechnol Biochem, 2007, 71(9): 2335-2337.
[11] PORTER L J, HRSTICH L N. The conversion of procyanidins and prodelphinidins to cyanidins and delphinidin[J]. Phytochenistry, 1986, 25(8): 223-230.
[12] TERRILL T H, ROWAN A M, DOUGLAS G B, et al. Determination of extractable and bound condensed tannins concentration in forage plants, protein concentrate meals and cereal grains[J]. Jounal of Science of Food and Agriculture, 1992, 58(3): 321-329.
[13] GINER C, VAN S, PELL A N, et al. A method for isolating condensed tannins from crude plant extracts with trivalent ytterbium[J]. Animal feed science and technology, 1997, 74(4): 359-368.
[14] SINGLETON V L, ORTHOFER R, LAMUELA-RAVENTOS R M, et al. Analysis of total phenols and other oxidation substrates and antioxidants by mean of Folin-Ciocalteu reagent[J]. Meth Enaymol, 1999, 299(8): 152-178.
[15] KALLITHRAKA S, GARCIA V C. Survey of solvents for the extraction of grape seed polyphenolics[J]. Phytochemical Analysis, 2005(6): 265-271.
[16] LUENGTHANAPHOL S, MONGKHOLKHAJORNSILP D, DOUGLAS S, et al. Extraction of antioxidants from sweet Thai tamarind seed coat: preliminary experiments[J]. Journal of Food Engineering, 2004, 63(2): 247-252.
[17] 严守雷. 莲藕多酚提取分离鉴定及生物活性研究[D]. 武汉: 华中农业大学, 2003.
Optimization of Extraction Process for Polyphenols from Blueberry Leaves by Response Surface Methodology
FENG Jin1,2,ZENG Xiao-xiong,LI Chun-yang1,*
(1. Institute of Farm Product Processing, Jiangsu Academy of Agriculture Science, Nanjing 210014, China;2. College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
This study was designed to optimize the extraction of polyphenols from blueberry leaves using ethanol as the extraction solvent. Four extraction parameters such as ethanol concentration (P = 0.0025), extraction temperature P = 0.0091), solid-to-liquid ratio (P = 0.0236) and extraction time (P = 0.0156) were identified as main variable that influence extraction efficiency through the combined use of one-factor-at-a-time method and Plackett Burman design. The optimum extraction conditions were determined by response surface methodology to be 62.05% ethanol concentration, 67.54 ℃, 1:23.65 solid-to-liquid ratio and 2.06 h. The maximum predicted yield of polyphenols under these conditions was 90.49%, which was close to the measured value. Thus, the fitted quadratic regression model is valid.
polyphenols from blueberry leaves;extraction process;Plakett Burman design;respond surface methodology
Q949.71
A
1002-6630(2013)04-0059-06
2011-11-06
2011年南京市科技发展计划国际联合研发项目(201101093)
冯进(1989—),男,硕士研究生,研究方向为活性物质提取。E-mail:jaas2010@163.com
*通信作者:李春阳(1966—),男,副研究员,博士,研究方向为活性物质与功能食品。E-mail:lichunyang968@126.com

