正交试验优化谷氨酰胺酶改性米谷蛋白工艺
李向红,周小玲,刘永乐*,俞 健,王发祥,王建辉
(长沙理工大学食品与生物工程系,湖南 长沙 410114)
正交试验优化谷氨酰胺酶改性米谷蛋白工艺
李向红,周小玲,刘永乐*,俞 健,王发祥,王建辉
(长沙理工大学食品与生物工程系,湖南 长沙 410114)
研究谷氨酰胺酶对米谷蛋白改性的工艺。以脱酰胺度、溶解度为考察指标进行了工艺条件的优化,探讨谷氨酰胺酶与米谷蛋白质量比、反应温度、反应pH值3个工艺参数对改性米谷蛋白溶解度及脱酰胺度的影响,确定了谷氨酰胺酶改性最佳工艺条件,用正交试验法对米谷蛋白酶法改性工艺条件进行了优化,得到最佳工艺条件为:谷氨酰胺酶与米谷蛋白的质量比1:7、酶解脱酰胺改性的反应温度37.0℃、时间24h、pH7.0。优化后的米谷蛋白脱酰胺度为52.76%,溶解度为93.78%。
米谷蛋白;蛋白质谷氨酰胺酶;脱酰胺
大米是大多数人类的能量和蛋白来源[1],大米蛋白具有无色、味道温和、必需氨基酸含量丰富、低过敏性及低胆固醇等特点[2],是谷物蛋白中营养价值较高的一种。但是,大米蛋白质富含谷氨酰胺及天冬酰胺,酰胺基之间通过氢键等结合使蛋白质聚集沉淀,导致其溶解度较低,限制其在液态食品及饮料中的应用;低溶解度也会影响蛋白质的其他功能性质例如起泡性、乳化性及凝胶性等[3]。
研究表明通过对蛋白质脱酰胺改性能改善其溶解性及其他功能性质[4-8],酸法、酶法已广泛应用于小麦、玉米和大米等蛋白的脱酰胺[9-12],但这些方法存在的问题是会带来肽链的水解或作用底物有限等[13-15]。目前有研究发现,蛋白质谷氨酰胺酶应用于小麦蛋白及玉米醇溶蛋白的脱酰胺中可显著提高其溶解度和乳化性[10-11]并不会引起肽链的水解;将其用于干酪素的脱酰胺的研究发现蛋白质谷氨酰胺酶主要酶解分子质量高的蛋白质,而不是分子质量小的肽或是降解后的短肽[16]。但目前未见有将蛋白质谷氨酰胺酶应用于大米蛋白脱酰胺改性的研究报道。米谷蛋白中富含谷氨酰胺残基,本课题组前期研究发现可以使用蛋白质谷氨酰胺酶对其进行脱酰胺改性,本实验研究了酶解米谷蛋白的工艺流程及其最优的酶解条件,为改性米谷蛋白寻找了新途径,对于扩大大米蛋白在食品工业中的应用范围提供了理论依据。
1 材料与方法
1.1 材料与试剂
籼米碎米 湖南省霞凝粮库;谷氨酰胺酶(glutaminase)美国Sigma公司;所有其他化学试剂均为分析纯级。
1.2 仪器与设备
UV2600 紫外-可见分光光度计 上海舜宇恒平科学仪器有限公司;DS-1高速组织捣碎机 上海标本模型厂;DF-101S 集热式恒温加热磁力搅拌器 巩义市予华仪器有限责任公司;DELTA 320 pH计 梅特勒-托利多仪器(上海)有限公司;SK-1 型快速混匀器 金坛市医疗仪器厂;TGL-16B高速台式离心机 上海安亭科学仪器厂;FD-1型真空冷冻干燥机 北京博医康实验仪器有限公司。
1.3 方法
1.3.1 大米粉的脱脂
大米粉采用正己烷在常温下(25℃)浸提搅拌1h,料液比为1:5,浆液真空过滤后滤饼在室温下自然干燥48h。干燥后的原料经碾磨后过200目筛,4℃保藏。
1.3.2 分步法提取米谷蛋白工艺流程
对Agboola等[17]和van der Borght等[18]提取米谷蛋白的方法进行改进后提取米谷蛋白。提取温度为室温,提取时间2h,离心速度3000r/min,离心时间15min。
大米粉→正己烷脱脂→室温下自然干燥24h→蒸馏水提取清蛋白(料液比1:10)→离心→5%氯化钠盐溶液提取球蛋白(料液比1:10)→离心→70%乙醇溶液提取出醇溶蛋白(料液比1:5)→离心→沉淀水洗→ 0.05mol/L氢氧化钠溶液(料液比1:10)→离心→上清液用12%的三氯乙酸溶液调节pH值至等电点4.8 → 离心→透析→冷冻干燥→产品。
1.3.3 米谷蛋白常规成分检测
蛋白质含量的测定:采用GB 5009.5—2010《食品中蛋白质的测定》中凯氏定氮法,氮换算为蛋白质的系数为5.95;脂肪含量的测定:采用GB/T 5512—2008《粮油检验:粮食中粗脂肪含量测定》中索氏抽提法;水分含量的测定:采用GB 5009.3—2010《食品中水分的测定》中直接干燥法;灰分含量的测定:采用GB 5009.4—2010《食品中灰分的测定》中干法灰化法。
1.3.4 谷氨酰胺酶改性米谷蛋白的工艺流程及评价方法
1.3.4.1 谷氨酰胺酶改性米谷蛋白的工艺流程
称取定量米谷蛋白,边搅拌边加入盛有磷酸盐缓冲溶液(200mmol/L,pH7.0)的恒温酶反应器内,形成底物质量分数为1%的分散悬浮液,搅拌30min后加入一定量的谷氨酰胺酶(E/S=1/7)进行改性反应。改性的反应温度37℃、pH7.0、反应时间0~48h。空白实验则以不加酶的相同浓度的蛋白质在上述相同反应条件下反应24h。反应结束后,蛋白质酶解溶液以及空白液均用0.1mol/L的醋酸溶液透析8h,然后将蛋白溶液真空冻干成固体粉末备用。
1.3.4.2 酰胺氮的检测
样品酰胺氮含量的检测方法采用Conway微量弥散皿法的改进方法[19]。准确称取0.2000g蛋白质,加入10mL 3mol/L盐酸,密封于硬质玻璃烧瓶中,在120℃恒温条件下水解3h,水解完毕后取出冷却。取水解溶液做蒸馏,用4%的硼酸溶液接收释放的氨气。反应结束后用标准盐酸滴定,记录消耗的盐酸体积。脱酰胺度(deamidation degree,DD)由脱酰胺处理后释放的酰胺基数目与原蛋白总酰胺基数目的比值来表示[19]。计算公式如下:
CN=N(HCl)×V(HCl)×0.014/WT
式中:CN为酰胺氮含量/(g/g蛋白质);N(HCl)为标准盐酸的浓度,取0.0097mol/L;V(HCl)为消耗标准盐酸的体积/ mL;WT为样品中蛋白质的含量/g;
1.3.4.3 溶解度的检测
采用福林酚试剂法测定米谷蛋白及其脱酰胺样品pH7.0的溶液中的溶解度[20]。准确称取冻干样品(10mg)分散于10mL缓冲溶液中,缓冲液是10mmol/L的磷酸盐缓冲溶液(pH7.0)。分散好的蛋白溶液在20℃恒温条件下搅拌过夜,然后离心30min(3000r/min),收集上层可溶性组分。从上述收集的溶液中取1mL用于测定蛋白质的溶解度,用牛血清白蛋白做标准曲线。
1.3.5 谷氨酰胺酶改性米谷蛋白工艺条件的研究
设定溶液总体积50mL,蛋白质质量分数1%,酶与底物比(E/S)为1:7、改性温度37℃、改性时间24h、pH7.0,固定其他条件,分别考察酶与底物比、酶解温度、pH值对改性米谷蛋白工艺的影响。
1.3.6 正交试验设计
根据单因素试验确定的范围,选择酶与底物比、改性温度、酸碱度(pH值)作为考察的3个因素,每个因素3个水平,以脱酰胺度值(DD)与溶解度为考察指标,用L9(34)正交试验表安排试验,得出最佳改性条件。
2 结果与分析
2.1 碱法提取米谷蛋白的含量检测
提取蛋白质时,通常选择蛋白质在等电点附近的pH值条件作为蛋白酸沉时的pH值。本研究在制备米谷蛋白时选择pH4.8为酸沉条件,表1列出了所制备的米谷蛋白的理化性质。

表1 自提米谷蛋白的成分分析Table1 Chemical composition of laboratory prepared rice glutelin
2.2 谷氨酰胺酶改性米谷蛋白的工艺条件选择
2.2.1 酶与米谷蛋白比(E/S)对改性米谷蛋白工艺的影响

图1 酶与米谷蛋白比(E/S)对改性米谷蛋白脱酰胺度及溶解度的影响Fig.1 Effect of enzyme/substrate ratio on DD and solubility of modified rice glutelin
由图1可知,随着谷氨酰胺酶用量的增加,米谷蛋白的脱酰胺度及溶解度逐渐增加,酶与米谷蛋白比在1/9~1/7之间时,脱酰胺度及溶解度增加很快,呈直线上升趋势,当酶与米谷蛋白比超过1/7时,脱酰胺度及溶解度呈水平线趋势,增长缓慢。初步确定酶与米谷蛋白比在1/7~1/5之间。
2.2.2 酶解温度对改性米谷蛋白工艺的影响

图2 酶解温度对改性米谷蛋白脱酰胺度及溶解度的影响Fig.2 Effect of reaction temperature on DD and solubility of modified rice glutelin
由图2可知,随着酶解温度的升高,米谷蛋白的脱酰胺度及溶解度先上升后下降,呈“几”字趋势。酶解温度在35~40℃之间,其脱酰胺度及溶解度均呈最大值,说明谷氨酰胺酶的最适反应温度在35~40℃之间。

图3 酸碱度对改性米谷蛋白脱酰胺度及溶解度的影响Fig.3 Effect of reaction pH on DD and solubility of modified rice glutelin
2.2.3 酸碱度(pH值)对改性米谷蛋白工艺的影响由图3可知,酸碱度对谷氨酰胺酶改性米谷蛋白的影响很显著。pH值为5.5~7.0时,米谷蛋白的脱酰胺度及溶解度呈较快的增长趋势,当pH值大于7.0,呈缓慢的降低趋势。可见谷氨酰胺酶的最适反应环境为中性环境。
2.3 谷氨酰胺酶改性米谷蛋白工艺条件的优化
2.3.1 正交试验

表2 正交试验因素与水平表Table2 Factors and levels for orthogonal array design
根据前面的单因素试验,确定正交试验的因素水平,从而得出最佳改性工艺条件。正交试验因素水平及结果分别见表2~4。

表 33 LL9((334)正交试验设计及结果Table3 Orthogonal array design matrix and results
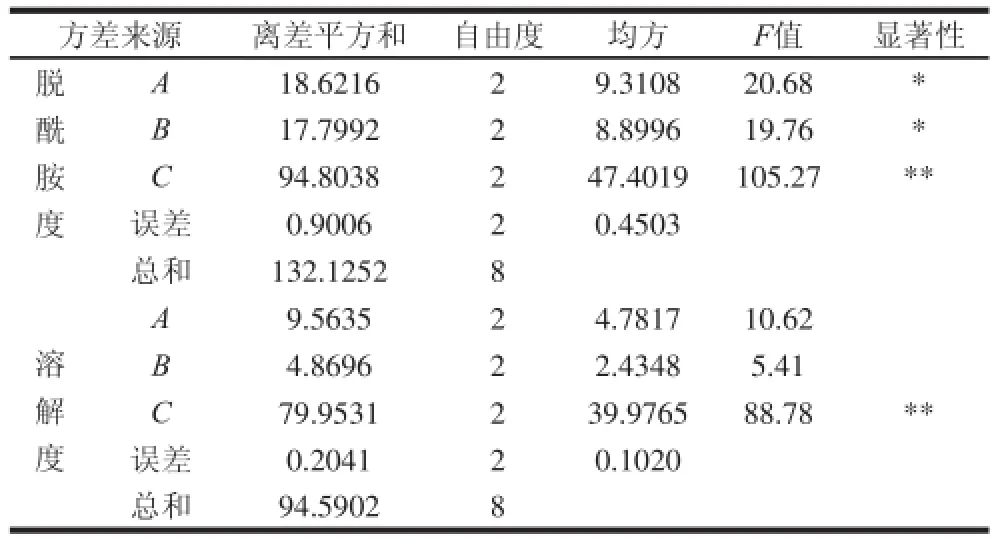
表4 正交试验方差分析Table4 Analysis of variance for the experimental results of orthogonal array design
从F分布表中查的F0.05(2,2)=19.00,F0.01(2,2)=99.00,FC>F0.01,故因素C对试验结果有非常显著的影响;从脱酰胺度的方差分析结果看来FA、FB在19.00~99.00之间,故因素A、B对试验结果有显著影响;而从溶解度的结果看来,FA、FB小于F0.05,因素A、B对试验结果无显著影响。考虑到正交试验中在E/S为1/7、37℃的条件下溶解度较高,因此选择A3B2C2,即酶与底物比为1/7、改性温度37℃、pH7.0为最优方案。
2.3.2 验证实验
采用优化后的工艺条件,改性时间24h进行3次验证实验,测得改性米谷蛋白脱酰胺度为52.76%,溶解度为93.78%,优于正交试验中的任何一个组合,故确定为最优的改性工艺条件。
3 结 论
本实验采用分步提取法制备米谷蛋白,其含量达到91.57%,以其为原料,使用谷氨酰胺酶对其进行改性。以脱酰胺度、溶解度为考察指标进行了工艺条件的优化,研究了谷氨酰胺酶-米谷蛋白质量比、反应温度、反应pH值3个工艺参数对改性米谷蛋白溶解度及脱酰胺度的影响,确定了谷氨酰胺酶改性最佳工艺条件为:谷氨酰胺酶与米谷蛋白的质量比为1:7,酶解脱酰胺改性的反应温度37.0℃、时间24h、pH7.0。优化后的米谷蛋白脱酰胺度为52.76%,溶解度为93.78%。因此谷氨酰胺酶适用于含有大量谷氨酰胺残基的大米蛋白的脱酰胺改性,从而可有效改善米谷蛋白的溶解度及其他的功能性质,可达到扩大其生产应用范围的目的。
[1] KATO T, KATAYAMA E, MATSUBARA S, et al. Release of allergenic proteins from rice grains induced byhighhydrostatic pressure[J]. Journal of Agricultural Food Chemistry, 2000, 48(8): 3124-3129.
[2] CHRASTIL J. Correlations between the physicochemical and functional properties of rice[J]. Journal of Agricultural and Food Chemistry, 1992, 40(9): 1683-1686.
[3] JULIANO B O. Rice: chemistry and technology[M]. 2nd ed. St. Paul: American Association of Cereal Chemists, 1985.
[4] HAMADA J S. Effects of heat and proteolysis on deamidation of food proteins using peptidoglutaminase[J]. Journal of Agricultural and Food Chemistry, 1992, 40(5): 719-723.
[5] BERTI C, RONCORONI L, FALINI M L, et al. Celiac-related properties of chemically and enzymatically modified gluten proteins[J]. Journal of Agricultural and Food Chemistry, 2007, 55(6): 2482-2488.
[6] LI Xiaohong, LIU Yongle, YI Cuiping, et al. Microstructure and rheological properties of mixtures of acid-deamidated rice protein and dextran[J]. Journal of Cereal Science, 2010, 51(1): 7-12.
[7] YONG Yiehui, YAMAGUCHI S, GU Y S, et al. Effects of enzymatic deamidation by protein-glutaminase on structure and functional properties of α-zein[J]. Journal of Agricultural and Food Chemistry, 2004, 52(23): 7094-7100.
[8] WEBB M F, NAEEMH A, SCHMIDT K A. Food protein functionality in a liquid system: A comparison of deamidated wheat protein with dairy and soy proteins[J]. Journal of Food Science, 2002, 67(8): 2896-2902.
[9] MATSUDOMI N, SASAKI T, KATO A, et al. Conformational changes and functional properties of acid-modified soy protein[J]. Agricultural & Biological Chemistry, 1985, 49(5): 1251-1256.
[10] WU C H, NAKAI S, POWRIE W D. Preparation and properties of acid-solubilized gluten[J]. Journal of Agricultural and Food Chemistry, 1976, 24(3): 504-510.
[11] HUDSON B J F. Biochemistry of food proteins[M]. London: Elsevier Applied Science, 1992.
[12] HAMADA J S. Deamidation of food proteins to improve functionality[J]. Critical Reviews in Food Science and Nutrition, 1994, 34(3): 283-292.
[13] TOMOTAKE H, SHIMAOKA I, KAYASHITA J, et al. Physicochemical and functional properties of buckwheat protein product[J]. Journal of Agricultural and Food Chemistry, 2002, 50(7): 2125-2129.
[14] MARCOA C, ROSELL C M. Effect of different protein isolates and transglutaminase on rice flour properties[J]. Journal of Food Engineering, 2008, 84(1): 132-139.
[15] MOORE M, SCHOBBER T, DOCKERY P, et al. Textural comparisons of gluten free and wheat based dough batters and breads[J]. Cereal Chemistry, 2004, 81: 567-575.
[16] YAMAGUCHI S, YOKOE M. A novel protein-deamidating enzyme from chryseobacterium proteolyticum sp. nov., a newly isolated bacterium from soil[J]. Applied and Environmental Microbiology, 2000, 66(8): 3337-3343.
[17] AGBOOLA S, NG D, MILLS D. Characterization and functional properties of Australian rice protein isolates[J]. Journal of Cereal Science, 2005, 41(3): 283-290.
[18] van der BORGHT A, VANDEPUTTE G E, DERYCKE V, et al. Extractability and chromatographic separation of rice endosperm proteins[J]. Journal of Cereal Science, 2006, 44(1): 68-74.
[19] CONWAY E J, FLOOD J C. An absorption apparatus for the microdetermination of certain volatile substances[J]. Biochemistry Journal, 1936, 30(4): 716-727.
[20] LOWRY O H, ROSEBROUGH N J, FARR A L, et al. Protein measurement with the Folin phenol reagent[J]. Journal of Biological Chemistry, 1951, 193(1): 265-275.
Orthogonal Array Design for the Optimization of Rice Glutelin Modification Using Glutaminase
LI Xiang-hong,ZHOU Xiao-ling,LIU Yong-le*,YU Jian,WANG Fa-xiang,WANG Jian-hui
(Department of Food and Biology Engineering, Changsha University of Science and Technology, Changsha 410004, China)
In this work, an orthogonal array design was used to optimize process conditions for the enzymatic modification of rice glutelin using glutaminase based on degree of deamidation (DD) and solubility. The optimum experimental conditions for modifying rice glutelin were 1:7, 37 ℃, 7.0 and 24 h for enzyme/substrate ratio, temperature, pH and time, respectively. The DD and solubility of modified rice glutelin under these conditions were 52.76% and 93.78%, respectively.
rice glutelin;glutaminase;deamidation
TS213.3
A
1002-6630(2013)04-0047-04
2011-12-08
“十二五”国家科技支撑计划项目(2012BAD31B08);国家自然科学基金青年科学基金项目(31101214;31201427)
李向红(1979—),女,副教授,博士,研究方向为农产品深加工与植物蛋白工程。E-mail:xianghongl@163.com
*通信作者:刘永乐(1962—),男,教授,博士,研究方向为食品生物技术与农产品深加工。E-mail:lyle19@163.com

