逆流色谱与硅胶柱色谱相结合分离纯化高良姜中高良姜素
徐 静,曹学丽,*,尹 鹭,成 超,王 尉,乐胜峰,周晓晶
(1.北京工商大学食品学院,食品添加剂与配料北京高校工程研究中心,北京 100048;2.北京理化分析测试中心,北京 100089)
逆流色谱与硅胶柱色谱相结合分离纯化高良姜中高良姜素
徐 静1,曹学丽1,*,尹 鹭1,成 超1,王 尉2,乐胜峰2,周晓晶2
(1.北京工商大学食品学院,食品添加剂与配料北京高校工程研究中心,北京 100048;2.北京理化分析测试中心,北京 100089)
目的:建立一种从高良姜粗提物中分离制备高纯度高良姜素的方法。方法:采用逆流色谱(CCC)直接法以及逆流色谱(CCC)与硅胶柱色谱相结合两种方法从高良姜粗提物中分离制备高良姜素。结果:先用硅胶柱色谱对粗提物进行预分离,然后采用逆流色谱,以石油醚-乙酸乙酯-乙醇-水(2:0.4:0.8:0.9,V/V)为两相溶剂体系,对目标组分进行纯化,可以从高良姜粗提物中制备得到高纯度高良姜素。通过该方法可以从3.5g高良姜粗提物中分离得到纯度为99.1%的高良姜素15.6mg,纯度为95.2%的未知化合物Ⅱ5.2mg。结论:硅胶柱色谱与逆流色谱相结合为一种分离制备高纯度高良姜素有效方法。该方法可用于相关标准样品的研制及功能因子的开发。
高良姜;高良姜素;逆流色谱;硅胶柱色谱
高良姜(Alpinia officinarum Hance)为姜科山姜属植物[1],别名小良姜,是一种药食同源的植物。气香,味辛辣,具有温胃、散寒、行气、止痛的作用,可用于脘腹冷痛,胃寒呕吐等病症。高良姜中主要含有二苯基庚烷类、挥发油、黄酮类化合物,以及糖苷、苯丙素、甾醇类化合物等[2-3]。研究表明其黄酮类成分具有抗氧化的作用,可以作为药食两用的植物使用[4]。而且高良姜的煎剂或浸泡提取物,还可用于对柑橘、苹果、草莓、食用菌等果蔬的保鲜[5],作为一种天然的食品保鲜剂越来越受到人们的关注。高良姜素(galangin,3,5,7-三羟基黄酮)是高良姜中一种主要的黄酮类的成分(图1),对高良姜的鉴别具有很强的专属性。在现代药理学的研究中发现高良姜素有抗肿瘤、抗病毒、抗细菌、抗炎、抗氧化等多种生物活性[6],已成为国内医药界研究与开发的热点。因此,建立高良姜素的高效分离纯化方法具有重要意义。
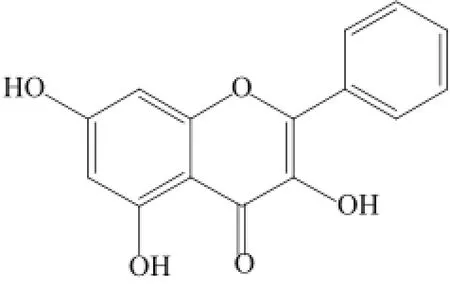
图1 高良姜素的化学结构Fig.1 Chemical structure of galangin
目前从高良姜中分离纯化高良姜素的主要方法是溶剂提取结合反复的常规柱层析[7-9],分离步骤繁杂,分离效率低,所得产品需反复重结晶。且由于固体介质的不可逆吸附作用,造成样品组分的损失较大,回收率较低。逆流色谱(counter-current chromatography,CCC) 是一种连续高效的液-液分配色谱分离技术,由于不需要任何的固体分离介质,物质之间依据在两相不相溶的溶剂体系中分配系数的不同而实现分离[10]。它具有分离效率高、制备量大、操作简单等特点,且由于不存在分离介质的不可逆吸附,因此具有回收率高的优点,近年来广泛应用于天然活性成分的分离与制备[11-12]。但是目前还未见有采用逆流色谱分离纯化高良姜素的报道。本实验建立了一种逆流色谱与硅胶柱色谱相结合从高良姜粗提物种分离制备高纯度的高良姜素的有效方法,可为高良姜药效物质的基础研究提供参考依据。
1 材料与方法
1.1 材料与试剂
高良姜中药 北京市白塔寺药店;高良姜素对照品南京泽朗植提技术有限公司。
乙醇、石油醚等用于样品提取及逆流色谱分离的试剂(均为分析纯) 北京化学试剂公司;甲醇(色谱纯)美国Fisher公司;冰乙酸(色谱纯) 天津市光复精细化工研究所。
1.2 仪器与设备
TBE-300A半制备型高速逆流色谱仪(配有220mL半制备柱、Tauto TBP 5002输液泵及TBD-23 UV双波长检测器) 上海同田生化技术有限公司;Spectrum高效逆流色谱仪(配有133.5mL半制备柱、Knauer Smartline 1000输液泵及UV 2500可变波长检测器) 英国Dynamic Extraction公司;RE-2000型旋转蒸发仪 上海亚荣生化仪器厂;ALPHA 2-4 LSC型冷冻干燥机 德国Christ公司;1100高效液相色谱仪(配有四元梯度泵、自动进样器、二极管阵列检测器等)、1100 MSD Trap质谱仪(电喷雾电离(electrospray ionization,ESI) 美国Agilent公司;Avance 600核磁共振波谱仪 瑞士Bruker公司。
1.3 高良姜粗提物的制备
高良姜药材经粉碎后,过60目筛。将样品以1:10的质量比用85%乙醇溶液超声提取3次,每次40min,合并提取液,减压浓缩至浸膏,真空干燥后得褐色粉末,置于冰箱(4℃)中备用。
1.4 高效液相HPLC分析
通过参考相关文献[13-14],经优化后采用如下条件对高良姜粗提物及其分离级分进行分析。液相色谱柱:Zorbax SB-C18(250mm×4.6mm,5μm);流动相:A(甲醇),B (0.1%甲酸溶液);0~35min,50% A梯度洗脱至75% A;流速:1.0mL/min;柱温:30℃;检测波长:280、266nm。
1.5 逆流色谱分离
将所选择的溶剂体系以一定体积比配制于分液漏斗中,充分混合后,静置过夜。使用前将两相分离,以上相为固定相,下相为流动相。首先将上相固定相以较快的流速注满逆流色谱仪螺旋管柱,再使其以一定的转速旋转,同时以一定的流速泵入下相流动相。待检测器出口有下流出,且上相不再增加时,系统达到动力学平衡。将待分离样品用下相以一定的浓度溶解,进样,保持流动相流速不变进行洗脱,并开启色谱工作站采集数据。根据仪器出峰情况分别收集各流出级分。本实验用到两种逆流色谱仪,其操作条件分别如表1所示。

表1 逆流色谱仪操作条件Table1 Operating conditions for CCC separation of galangin
1.6 硅胶柱色谱粗分离
实验中发现直接用逆流色谱分离高良姜粗提物,高良姜素一直受到一个杂质的干扰,因此实验采用硅胶柱对粗提取进行预分离,再用逆流色谱分离的方法。称取70g硅胶(100~200目),用氯仿-甲醇(99:1,V/V)混匀后装柱(60cm,2.2cm),以5%的上样比将3.5g粗提物用5mL的氯仿-甲醇(99:1)溶解后上样,以氯仿-甲醇(99:1、49:1、19:1、9:1、4:1,V/V)依次梯度洗脱,每个梯度洗脱2个柱体积,分别收集各洗脱馏分。馏分经HPLC检测后,将含有目标物质的馏分合并,浓缩,再用逆流色谱进行纯化。
1.7 目标物质结构鉴定
结构鉴定采用电喷雾电离(electrospray ionization mass spectrometry,ESI-MS)、核磁共振氢谱(1H-NMR)、碳谱(13C-NMR)进行。ESI-MS条件:雾化器压力:50psi;干燥气体流量:10L/min;干燥器温度:350℃;扫描范围:50~2200m/z。
2 结果与分析
2.1 高良姜粗提物的HPLC分析
高良姜粗提物的HPLC分析谱图如图2所示。经过与高良姜素对照品比对,初步确定目标物质的出峰位置,如图2中Ⅰ所示,图中Ⅱ和Ⅲ为粗提物中与目标物质极性相近的未知干扰物。

图2 高良姜粗提物的HPLC分析谱图Fig.2 HPLC chromatogram of crude galangin extract from A. offi cinarum
2.2 高速逆流色谱法直接从粗提物中分离纯化高良姜素

图3 高良姜粗提物的CCC分离谱图Fig.3 CCC chromatogram of crude galangin extract from A. offi cinarum
根据高良姜素的结构及其在HPLC图中的出峰位置,可知其为中等极性化合物,采用Ito等[15]、Oka等[16]的溶剂系统筛选方法,选择基于正已烷-乙酸乙酯-甲醇-水的中等极性溶剂体系。通过测定不同溶剂配比下高良姜素的分配系数,并用石油醚代替价格较贵的正己烷,最终确定溶剂体系为石油醚-乙酸乙酯-甲醇-水(2:0.4:0.8:0.9,V/V)。采用该溶剂体系,及表1中TBE-300A高速逆流色谱仪分离条件,对高良姜素粗提物直接进行CCC分离,如图3A所示。进一步调整溶剂体系,将其中的甲醇更换为乙醇,所得分离谱图如图3B所示。可见经优化后,分离时间缩短约150min,1#和2#组分的分离度保持不变。
分别收集1#和2#组分,经HPLC分析显示,1#组分为图2中所示的未知化合物Ⅱ,纯度为95.1%(图4A)。2#主要为目标物高良姜素,纯度为85.6% (图4B),其中含有少量的化合物Ⅲ。
可见采用逆流色谱法直接从高良姜粗提物中一步分离高良姜素,可以将其纯度从39.2%提高到85.6%,但少量的化合物Ⅲ经多次实验均不能很好分离。因此,后续采用硅胶柱色谱预分离配合逆流色谱纯化的方法。

图4 高良姜粗提物的逆流色谱分离组分的HPLC分析谱图Fig.4 HPLC chromatograms of CCC peak fractions of crude galangin extract from A. offi cinarum
2.3 硅胶柱预分离与逆流色谱结合分离纯化高良姜素

图5 硅胶柱预分离所得目标物质馏分的HPLC分析谱图Fig.5 HPLC chromatogram of galangin separated by silica gel chromatography
采用硅胶柱预分离,分别收集氯仿-甲醇梯度洗脱馏分,进行HPLC分析。结果表明,氯仿-甲醇(19:1、9:1,V/V)洗脱馏分中主要含有目标物质化合物Ⅰ高良姜素,同时含有干扰物Ⅱ,但是之前难以与高良姜素Ⅰ分离的干扰物Ⅲ得到了分离,如图5所示。而采用之前的逆流色谱法很容易将高良姜素Ⅰ与化合物Ⅱ分离。因此,将两个洗脱馏分合并浓缩,真空冷冻干燥,从3.5g粗提物中共得到预分离目标级分180mg。采用前面逆流色谱溶剂体系用Spectrum高效逆流色谱仪对其进行进一步分离,如图6所示,得到15.6mg高纯度目标物Ⅰ高良姜素(2#),同时得到了5.2mg化合物Ⅱ(1#)。HPLC分析显示,目标物Ⅰ高良姜素的纯度为99.1%,如图7所示。

图6 硅胶柱预分离所得目标物质馏分的CCC分离谱图Fig.6 CCC chromatogram of galangin separated by silica gel chromatography

图7 最终分离纯化所得高良姜素的HPLC分析谱图Fig.7 HPLC chromatogram of purified galangin
2.4 分离所得高良姜素的结构确认

图8 分离所得高良姜素的正-负离子模式的质谱图Fig.8 MS spectra of purified galangin under positive and negative modes
分离所得高纯度高良姜素经ESI-MS正负离子模式分析,所得质谱图如图8所示。
图8中ESI-MS正负离子模式下分别显示m/z 271.1[M+H]+和m/z 269.0[M-H]-,与高良姜素相对分子质量270吻合。核磁共振数据归属如下,1H-NMR(600MHz,DMSO-d6):δH:12.37(1H, s, 5-OH)、 10.87(1H, s, 7-OH)、 9.68(1H, s, 7-OH)、8.17(2H, d, J=7.2Hz, H-2’, 6’)、7.53(1H, dd, J=7.2Hz, 6.6Hz, H-3’, 4’, 5’)、6.48(1H, s, H-8)、6.42(1H, s, H-2);13C-NMR(150Hz, DMSO-d6):δC:176.7 (C-4)、164.7(C-7)、161.2(C-5)、156.8(C-9)、146.2(C-2)、137.5(C-3)、131.4(C-1’)、130.4(C-4’)、128.9(C-2’, 6’)、128.0(C-3’, 5’)、103.7(C-10)、98.8(C-6)、94.0(C-8)。其1H-NMR和13C-NMR数据与文献[17]一致,推断分子式为C15H10O5,最终确认分离所得物为高良姜素(galangin)。
3 讨论与结论
本实验研究了两种从高良姜粗提物中分离制备高良姜素的方法,一种是逆流色谱直接法,一种是逆流色谱与硅胶柱预分离相结合的方法。结果表明,高良姜粗提物中存在两种干扰目标物Ⅰ高良姜素的杂质化合物Ⅱ和Ⅲ。采用逆流色谱法直接分离,可以将高良姜素与干扰物Ⅱ实现分离,但是干扰物Ⅲ始终与高良姜素共存,很难去除;采用硅胶柱层析,可以先将粗提取中的干扰物Ⅲ分离,所得高良姜素与干扰物Ⅱ的级分再经逆流色谱纯化,即可得到高纯度的高良姜素单体。本研究,一方面表明逆流色谱在天然活性成分分离纯化方面的优势;另一方面也表明逆流色谱与传统柱层析相结合在一定条件下可以起到互补的独特分离效果。本实验所建立的高纯度高良姜素的分离制备方法可用于相关标准样品的研制及功能因子的开发。
[1] 中华人民共和国卫生部药典委员会. 中国药典: Ⅰ部[S]. 北京: 中国医药科技出版社, 2010: 270.
[2] ITOKAWA H, MORITA H, MIHASHI S. Two new diarylheptanoids from Alpinia officinarum Hance[J]. Chemical and Pharmaceutical Bulletin, 1981, 29(8): 2383-2385.
[3] ITOKAWA H, MORITA H, MIDORIKAWA I, et al. Diarylheptanoids from the rhizome of Alpinia officinarum Hance[J]. Chemical and Pharmaceutical Bulletin, 1985, 33(11): 4889-4893.
[4] 刘海英, 仇农学, 姚瑞祺, 等. 我国86种药食两用植物的抗氧化活性及其与总酚的相关性分析[J]. 西北农林科技大学学报, 2009, 37(2): 173-180.
[5] 高海生, 李春华, 蔡金星, 等. 天然果蔬保鲜剂研究进展[J]. 中国食品学报, 2003, 3(3): 86-90.
[6] 朱家校, 何伟, 马建春. 高良姜的研究进展[J]. 食品与药品, 2009, 11(9): 68-70.
[7] 邓赟, 陈谨, 唐灿, 等. 从高良姜中制备高良姜素对照品的研究[J]. 2005, 28(10): 948-949.
[8] 黄云, 陈玲, 侯红瑞, 等. 大孔吸附树脂对高良姜素吸附纯化特性的研究[J]. 现代食品科技, 2007, 23(1): 1-4.
[9] 康爱荣, 闫明, 彭英, 等. 高良姜中高良姜素的醇提和纯化工艺研究[J]. 中药研究与开发, 2011, 18(5): 44-46.
[10] ITO Y, CONWAY W D. High Speed Countercurrent Chromatography[M]. New York: John Wiley, 1996.
[11] 曹学丽. 高速逆流色谱分离技术及应用[M]. 北京: 化学工业出版社, 2005.
[12] 韩利文, 陈锡强, 袁延强, 等. 高速逆流色谱在中药现代化研究中的应用[J]. 现代药物与临床, 2010, 25(4): 241-246.
[13] 李彩君, 黄劲梅, 谢培山, 等. HPLC法测定高良姜中高良姜素的含量[J]. 中药新药与临床药理, 2012, 13(1): 41-42.
[14] 邓亦峰, 冯丽娜, 罗辉. 反相高效液相色潽法测定不同月份高良姜中高良姜素的含量[J]. 中国药学杂志, 2010, 45(20): 1593-1596.
[15] ITO Y. Countercurrent chromatography[J]. Journal of Chromatography Library, 1992, 51: A69-A107.
[16] OKA F, OKA H, ITO Y. Systematic search for suitable two phase solvent systems for high-speed counter-current chromatography[J]. Journal of Chromatography A, 1991, 538(1): 99-108.
[17] 卜宪章, 肖桂武, 古练权. 高良姜化学成分研究[J]. 中药材, 2000, 23(2): 84-87.
Separation and Purification of Galangin from Rhizomes of Alpinia offi cinarum Hance by Counter-Current Chromatography Combined with Silica Gel Column Chromatography
XU Jing1,CAO Xue-li1,*,YIN Lu1,CHENG Chao1,WANG Wei2,YUE Sheng-feng2,ZHOU Xiao-jing2
(1. Beijing Higher Institution Engineering Research Center of Food Additives and Ingredients, School of Food and Chemical Engineering, Beijing Technology and Business University, Beijing 100048, China;2. Beijing Center for Physical and Chemical Analysis, Beijing 100089, China)
The objective of this work was to establish a method to separate and purify galangin from rhizomes of Alpinia offi cinarum Hance using silica gel column chromatography combined with counter-current chromatography (CCC). Crude galangin was separated by silica gel column chromatography and further purified by CCC using a two-phase solvent system consisting of petroleum ether, ethyl acetate, ethanol and water (2:0.4:0.8:0.9, V/V). Using the developed method, 15.6 mg of galangin with a purity of 99.1% and 5.2 mg of an unknown compound with a purity of 95.2% were obtained from 3.5 g of crude galangin. This study demonstrates that the combination of silica gel column chromatography with counter-current chromatography can be an effective method for the separation and purification of galangin.
Alpinia offi cinarum;galangin;counter-current chromatography (CCC);silica gel chromatography
TR914.1
A
1002-6630(2013)04-0055-04
2012-09-29
北京市教委学科建设与研究生培养项目(PXM2012)
徐静(1987—),女,硕士,研究方向为生物分离。E-mail:jj_amigo@126.com
*通信作者:曹学丽(1967—),女,教授,博士,研究方向为生物分离。E-mail:caoxl@th.btbu.edu.cn

