“离子反应”教学中的相关问题与对策
刘石易 邝贤毅
“离子反应”教学中的相关问题与对策
刘石易1邝贤毅2
(1湖南省安仁县第一中学湖南安仁423600;2增城市新塘中学广东增城511340)
分析“离子反应”实际教学中经常出现的问题,并提出了相应解决对策。
离子反应;教学;对策
离子反应是高中化学极其重要的一个概念,笔者曾多次执教离子反应,在教学过程中对许多问题产生过困惑与思考,相信这也是广大一线教师的疑虑。现将其记录下来,希望能给大家带来些许启发。
一、关干电解质教学中的相关问题的思考
1.引入电解质本质定义的思考
在电解质教学中,学生经常会提出这样的问题:水是电解质吗?CO2不是电解质吗?细究问题背后的原因,是我们对电解质定义的教学出了问题。原来,教材为了考虑学生的初高中衔接,电解质的定义是从导电性角度给出的,很多教师据此认为电解质的定义是唯一的,教学过程也只根据课本定义进行设计。事实上课本关于电解质概念给出了两条线索:一种是从导电性角度给出的,课本有明确的定义;另一条线索是从电离角度讲解电解质,课本没有给出明确的定义,但这才是电解质的本质定义。在教学中要不要引入这隐性的本质的定义,是一个值得探讨的问题。笔者认为,电解质概念的本质定义应该引入。理由如下:①从学生的认知心理规律来看,由于课本所下定义不能反映电解质的本质,导致学生对电解质概念的认识肤浅、模糊,特别是当学生遇到CO2类物质(完全符合电解质课本定义,但不是电解质却是非电解质),内心自然产生疑惑甚至对课本定义有不满情绪,因此也必然充满对电解质本质定义的渴求;②从知识的衔接教学来看,电解质概念是进一步学习强弱电解质、离子反应的基础,引入电解质本质定义的学习,有利于与强弱电解质概念的自然衔接,有利于学生对离子反应的透彻理解和全面掌握;③从概念的发展来看,电解质概念有两个定义充分体现了概念发展的阶段性与规律性,以及概念组成的完整性。显然只有引入电解质本质定义,才能帮助学生实现认识的飞跃,全面深入地理解、掌握电解质概念。
那么,如何从电解质的本质定义设计教学呢?下面是我的两个设计(见下页表)。
2.关于电解质相关概念教学深广度的思考
在必修阶段教学中,许多教师对电解质相关概念教学的深广度把握不准,究其原因,是广大教师对电解质相关概念认识不清,对电解质相关概念在高中课本中的螺旋呈现把握不准,现分析之:
根据高中化学课程标准,电解质相关概念主要分布在必修的化学l、化学2以及选修的化学反应原理模块。根据教材中电解质相关概念的分布,我们发现,在化学1对电解质相关概念并没有完整的章节,而是穿插在各个专题中,要求也不是很高。电离、电解质概念初中不要求,出现在高中化学1,但是在化学1电离只要求强电解质电离方程式书写,要求明白电解质和非电解质的概念,但是淡化了二者的概念辨析。在化学1要求重点落实酸碱盐是电解质以及强酸强碱及其盐的电离。对于强电解质、弱电解质的概念在化学1中完全没有出现,电解质相关概念的深化和应用则出现在化学反应原理模块。
3.必修阶段弱电解质定义要不要引入的困惑
必修阶段,弱电解质定义要不要引入?这个问题一直困惑着许多一线教师,这里拿出来与大家一起探讨,一方面必修教材完全没有出现强电解质、弱电解质的概念,弱电解质概念在化学反应原理模块才要求;另一方面由于没有引入弱电解质的概念,给后面的教学带来了很大困难。例如:化学l主要安排了电解质和电离的概念,其主要任务是让学生建立起离子反应的概念,清楚物质在水溶液中的三种存在形式:“分子,离子,离子与分子共存”。因教材没有引入弱电解质的定义(部分电离的观念),教师在解释氨水、醋酸为什么是弱碱、弱酸,氨水、醋酸溶液中为什么是离子与分子共存时颇费周折,许多教师只能将弱酸、弱碱的概念及其水溶液的粒子存在形式强行塞给学生。再如:离子之间反应的条件是:生成沉淀、生成气体、生成弱电解质。由于没有学弱电解质的概念,有的教师将它改成生成像水一样的物质。但如何解释像水一样的物质呢?又如:在离子反应方程式书写中是依据该物质在水溶液中的主要存在形式来决定写成离子形式,还是写成化学式,但学生没有很好地理解清楚物质在水溶液中的三种存在形式,造成错误百出。因此,笔者以为,在教学中不要过于拘泥教材内容,要创造性地使用教材,从完全电离和不完全电离的角度适度地引入强弱电解质概念不失为明智之举。
设计一:电解质本质定义的教学设计
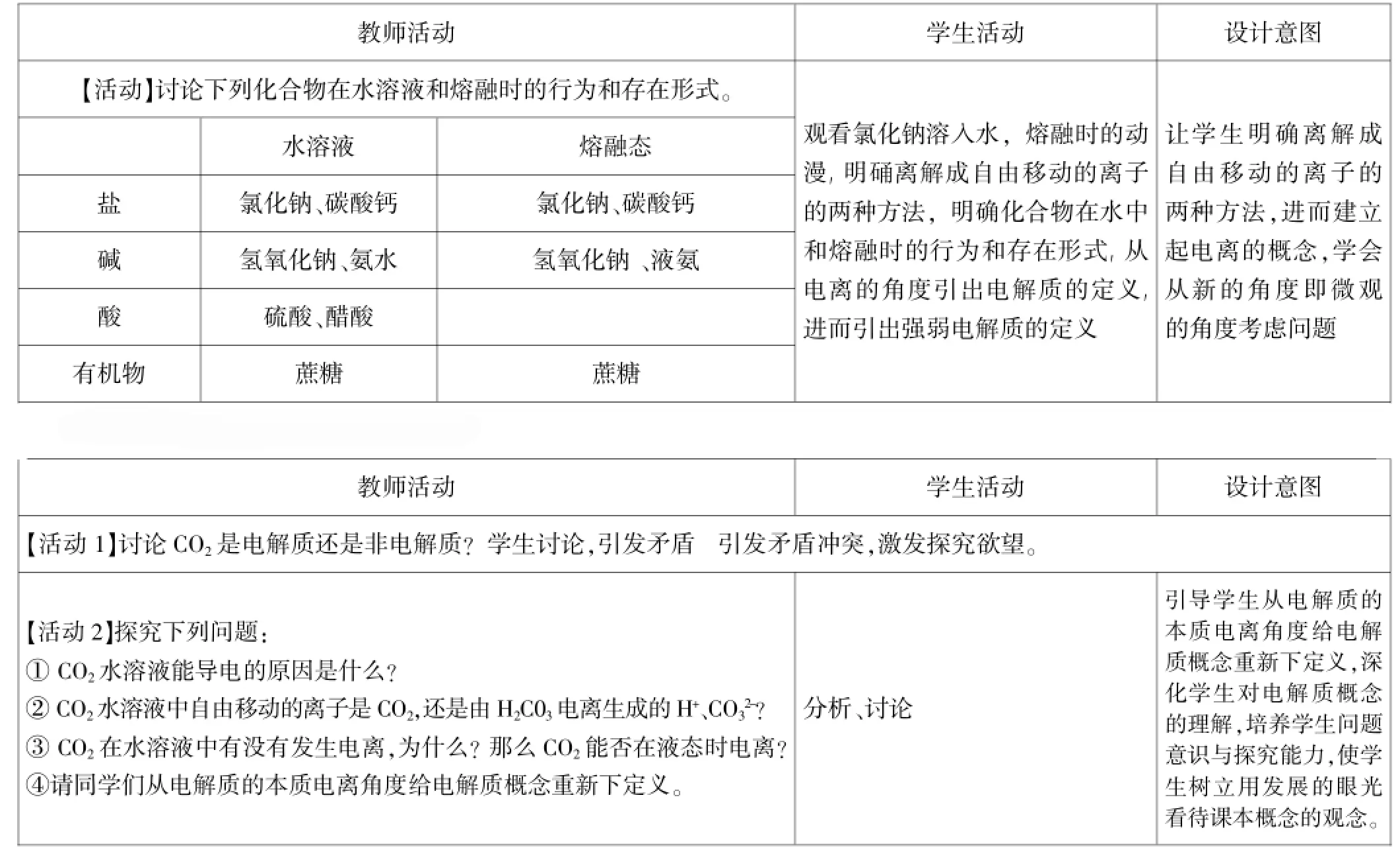
教师活动学生活动设计意图【活动】讨论下列化合物在水溶液和熔融时的行为和存在形式。水溶液熔融态盐观看氯化钠溶入水,熔融时的动漫,明硧离解成自由移动的离子的两种方法,明确化合物在水中和熔融时的行为和存在形式,从电离的角度引岀电解质的定义,进而引岀强弱电解质的定义让学生明确离解成自由移动的离子的两种方法,进而建立起电离的概念,学会从新的角度即微观的角度考虑问题氯化钠、碳酸钙氯化钠、碳酸钙碱氢氧化钠、氨水氢氧化钠、液氨酸硫酸、醋酸有机物蔗糖蔗糖设计二:电解质本质定义的教学设计教师活动学生活动设计意图【活动1】讨论C O2是电解质还是非电解质?学生讨论,引发矛盾引发矛盾冲突,激发探究欲望。【活动2】探究下列问题:①C O2水溶液能导电的原因是什么?②C O2水溶液中自由移动的离子是C O2,还是由H2C 03电离生成的H+、C O32-?③C O2在水溶液中有没有发生电离,为什么?那么C O2能否在液态时电离?④请同学们从电解质的本质电离角度给电解质概念重新下定义。分析、讨论引导学生从电解质的本质电离角度给电解质概念重新下定义,深化学生对电解质概念的理解,培养学生问题意识与探究能力,使学生树立用发展的眼光看待课本概念的观念。
附表:电解质相关概念的教学阶段

教师活动学生活动设计意图【活动】讨论下列化合物在水溶液和熔融时的行为和存在形式。水溶液熔融态盐观看氯化钠溶入水,熔融时的动漫,明硧离解成自由移动的离子的两种方法,明确化合物在水中和熔融时的行为和存在形式,从电离的角度引岀电解质的定义,进而引岀强弱电解质的定义让学生明确离解成自由移动的离子的两种方法,进而建立起电离的概念,学会从新的角度即微观的角度考虑问题氯化钠、碳酸钙氯化钠、碳酸钙碱氢氧化钠、氨水氢氧化钠、液氨酸硫酸、醋酸有机物蔗糖蔗糖设计二:电解质本质定义的教学设计教师活动学生活动设计意图【活动1】讨论C O2是电解质还是非电解质?学生讨论,引发矛盾引发矛盾冲突,激发探究欲望。【活动2】探究下列问题:①C O2水溶液能导电的原因是什么?②C O2水溶液中自由移动的离子是C O2,还是由H2C 03电离生成的H+、C O32-?③C O2在水溶液中有没有发生电离,为什么?那么C O2能否在液态时电离?④请同学们从电解质的本质电离角度给电解质概念重新下定义。分析、讨论引导学生从电解质的本质电离角度给电解质概念重新下定义,深化学生对电解质概念的理解,培养学生问题意识与探究能力,使学生树立用发展的眼光看待课本概念的观念。
二、关于离子反应教学的困惑与思考
1.离子反应微粒观构建的思考
离子反应不仅仅是要求学生掌握离子反应的概念,更重要的是教会学生从微粒的角度认识酸、碱、盐在水溶液中的存在形式及行为。认识物质在水溶液中的反应实质是离子之间的反应。使学生初步建立起研究水溶液的思维方法,这无疑是离子反应教学的重点和难点。近几年,笔者多次观摩了离子反应的公开课,发现许多教师针对这个问题,要么一笔带过、避而不谈,要么避重就轻、蜻蜓点水。那么,如何在离子反应教学中构建微粒观?下面是我整理出来的几种设计,供老师们探讨。
设计一:从溶液分类的角度构建

教师活动学生活动设计意图【活动】请根据水溶液中物质的存在形式给下列溶液分类。NaCl溶液、HCl溶液、醋酸溶液、NaOH溶液、氨水、蔗糖溶液观看上述物质溶入水的动漫,明确物质在水中的行为,从电离的角度引岀电解质的定义,进而引岀强弱电解质的定义分类是概念学习最基本的学习方式,新的分类方式可以给学生新的刺激,进而建立起离子的概念,学会从新的角度即微观的角度考虑问题
设计二:从导电性的角度构建

教师活动学生活动设计意图【活动】向含酚酞的氢氧化钡溶液逐滴加入硫酸溶液, (大烧杯,酸碱式滴定管带电流计的线路图,图略)观察溶液导电性、颜色、沉淀的变化。观察,记录,分析原因,分组讨论通过实验让离子“看得见”,明确物质在水中的行为,建立起离子反应的概念,归纳出离子反应是朝着某些离子浓度减小的方向进行。
设计三:从化学反应分类的角度构建
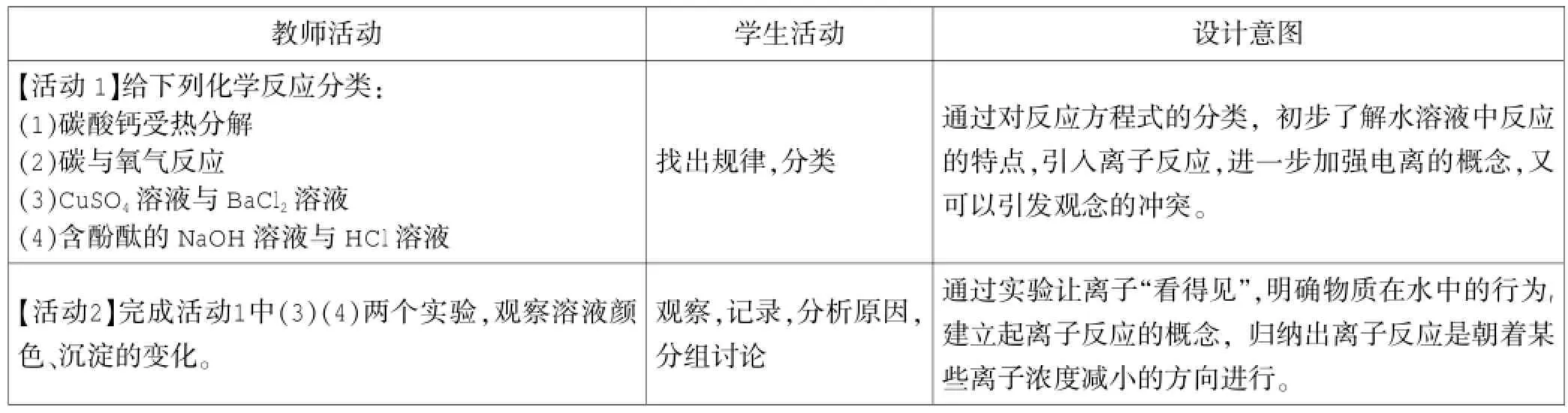
教师活动学生活动设计意图【活动1】给下列化学反应分类:(1)碳酸钙受热分解(2)碳与氧气反应(3)CuSO4溶液与BaCl2溶液(4)含酚酞的NaOH溶液与HCl溶液通过对反应方程式的分类,初步了解水溶液中反应的特点,引入离子反应,进一步加强电离的概念,又可以引发观念的冲突。找出规律,分类【活动2】完成活动1中(3)(4)两个实验,观察溶液颜色、沉淀的变化。观察,记录,分析原因,分组讨论通过实验让离子“看得见”,明确物质在水中的行为,建立起离子反应的概念,归纳出离子反应是朝着某些离子浓度减小的方向进行。
2.复分解反应的发生条件迁移到离子反应条件教学的困惑与思考
在高二的水平测试中,经常有同学认为离子之间反应的条件是初中所学的复分解反应发生的条件,即生成沉淀气体和水,为什么高二的学生还会出现这样看似简单的错误?为什么初中所学的旧概念的消极影响如此之深呢?这个问题困惑我很长时间。细究其原因,主要是老师错误地认为离子反应的条件学生容易掌握,没有重视旧概念同化为新概念所要运用的教学策略。旧概念如何无障碍迁移到新概念上来呢?
设计一:离子反应条件的探究
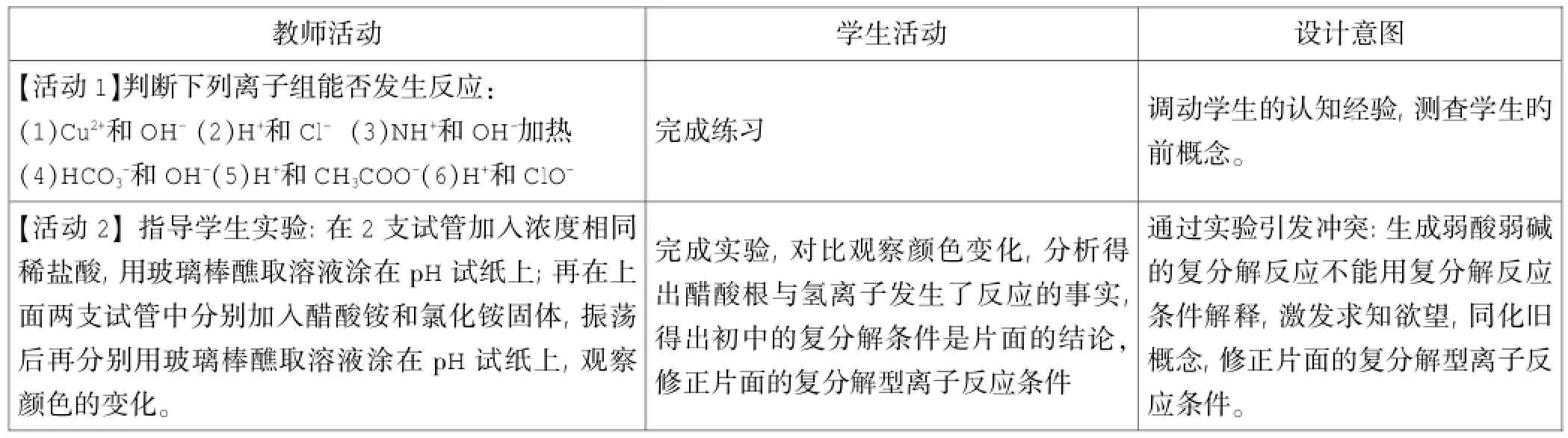
教师活动学生活动设计意图【活动1】判断下列离子组能否发生反应:(1)Cu2+和OH-(2)H+和Cl-(3)NH+和OH-加热(4)HCO3-和OH-(5)H+和CH3COO-(6)H+和ClO-完成练习调动学生的认知经验,测查学生旳前概念。【活动2】指导学生实验:在2支试管加入浓度相同稀盐酸,用玻璃棒醮取溶液涂在pH试纸上;再在上面两支试管中分别加入醋酸铵和氯化铵固体,振荡后再分别用玻璃棒醮取溶液涂在pH试纸上,观察颜色的变化。完成实验,对比观察颜色变化,分析得出醋酸根与氢离子发生了反应的事实,得出初中的复分解条件是片面的结论,修正片面的复分解型离子反应条件通过实验引发冲突:生成弱酸弱碱的复分解反应不能用复分解反应条件解释,激发求知欲望,同化旧概念,修正片面的复分解型离子反应条件。
三、关于离子反应方程式书写相关问题的思考
1.离子反应方程式书写第二步“拆”的思考
广大化学教师都明白,离子反应方程式书写教学中最难的是第二步“拆”。老师教得非常辛苦,而学生还是拆得千疮百孔。为什么会这样呢?多次施教离子反应方程式书写和多次反思之后,我发现原因在于老师过分地强调学生死记硬背,而没有给学生一个明确的理解和记忆思路,死记硬背的结果造成学生就是记不住。书写离子方程式实际上是依据该物质在水溶液中的主要存在形式来决定写成离子形式,还是写成化学式。因此,我们的教学要围绕帮助学生理解和记忆物质在水溶液中的主要存在形式来展开。下面是我的设计:
设计一:离子反应方程式书写第二步“拆”的设计

教师活动学生活动设计意图【活动1】请画出物质分类的“树状分类图”(图中要求给酸碱盐氧化物进一步分类)。巩固树状分类法,给学生一个明确的记忆物质思路。学生画“树状分类图”,讨论并完善“树状分类图”。【活动2】如果把“树状分类图”中的各类物质放于水中,小组讨论各物质在水溶液中的主要存在形式。小组讨论,归纳各类物质在水溶液中的主要存在形式。得出三大强酸,三大强碱,可溶性盐要拆,其它物质都不拆的结论。帮助学生理解和记忆物质在水溶液中的主要存在形式。
2.离子反应方程式书写“三步法”与“四步法”的思考
传统的离子反应方程式书写已成了一种经典的模式,大家习惯称之为“四步法”。山东版教材中出现了一种写法只要三步,称之为“三步法”。那么,哪一种书写方法更适合学生,学习效果更好呢?这是一线教师关心和思考的问题。
笔者曾选择两个基础较好的平行班进行测查,测查结果表明:“三步法”耗时显著少于“四步法”,应当说这在教学预测之内,“三步法”是从电离和溶解性出发,考虑离子之间可能的反应,步骤少,思维长度短,因而耗时少。而“三步法”成功率更高于“四步法”,这是我预设之外的发现,这可能是“三步法”所需要的准备知识主要是电离方程式等知识,程序简单,符合学生的最近发展区。“四步法”因程序复杂,在“写、拆、删”三步中都出现了较多的错误点。
笔者也曾选择两个基础较差的平行班进行测查,结果除“三步法”耗时显暑少于“四步法”,与前次测试一致。而“三步法”成功率却低于“四步法”。这可能是因为“四步法”是基于化学技能的教学,是一种记忆性的教学,灵活性小,学生易于掌握。而“三步法”是基于微粒观的教学,一种理解性的教学,灵活性大,需要学生建立起从微观的视角来看某个离子反应的实质,整体把握离子反应的真实面貌,才能顺利地写出表示其反应实质的离子方程式。对于基础较差的学生短时间内建立微粒观,整体把握离子反应的实质可能有些难度。
因此,对于基础较好的学生选择“三步法”,不仅省时,正答率高,更能培养学生以粒子观的视角思考问题,符合基础较好的学生喜欢使用灵活方法的特点。“四步法”的书写规则简单,思维强度不大,学生容易入手,对于基础较差的学生选择“四步法”有利初学时培养信心。
[1]李顺友.“离子反应”两个概念教学的问题及对策[J].教学与管理,2009,(10)
[2]徐守兵.离子方程式2种书写规则比较研究[J].化学教育,2009,(04)
1008-0546(2013)05-030-03
:G633.8
:B
10.3969/j.issn.1008-0546.2013.05.012

