肿瘤干细胞标记物 CD133、CD44、SOX2、OCT4、ALDH1 在NSCLC中的表达及临床意义
梁洪享 钟 竑 罗 勇 黄 燕 丁昭珩 丁 罡
肿瘤干细胞是目前肿瘤研究热点之一,目前非小细胞肺癌肿瘤干细胞标记物研究最多的有CD133、CD44、SOX2、OCT4、ALDH1 等,但关于它们在非小细胞肺癌中表达的相互关系的报道比较少见,本研究采用免疫组织化学方法检测非小细胞肺癌的石蜡标本,探索它们在非小细胞肺癌组织中的相互表达关系及其生物学意义,现总结如下。
1 材料与方法
1.1 一般资料
选取2005年1月至2011年12月上海交通大学医学院附属新华医院崇明分院手术切除的70例非小细胞肺癌病例的组织标本,所有病例病史资料完整,术前未行放化疗。另外选取14例非癌组织(包括癌旁及炎性肺组织)石蜡标本作为对照组。所有标本均经10%甲醛固定、常规石蜡包埋、切片备用。
1.2 主要试剂
SOX2小鼠抗人抗体、OCT4小鼠抗人抗体,来源于cell signaling technology公司;CD133兔抗人抗体、CD44兔抗人抗体和ALDH1兔抗人抗体来源于武汉博士德公司。
1.3 实验方法
免疫组化二步法染色严格按照试剂说明书操作步骤进行,抗原修复采用高压热修复。阴性对照组:PBS磷酸缓冲液代替一抗作为阴性对照。阳性对照组:CD133以肝癌为阳性对照;CD44以扁桃腺为阳性对照;SOX2以乳腺癌为阳性对照;OCT4以精原细胞瘤为阳性对照;ALDH1以肝癌为阳性对照。
1.4 阳性结果判断
考虑到肿瘤干细胞只占了肿瘤细胞中极少的一部分,大约占1% ~4%左右[1],因此免疫组织化学反应结果的评判标准参照 Terpe 等[2]、许良中等[3]、王翌庆[4]、Horst等[5]方法并作调整,即计算阳性细胞百分比并结合染色强度进行评分,判断标准:阳性细胞数为0则为阴性(0分),>0则为阳性,阳性再分为强阳性(2分:强染色强度细胞在阳性细胞中占70%以上)、弱阳性(1分:达不到强阳性条件的归为弱阳性)。
1.5 统计学方法
应用SAS 8.02软件包对数据进行处理。CD133、CD44、SOX2、OCT4、ALDH1 表达间相互关系及上述指标双阳性组合与NSCLC病理分化的关系比较采用χ2检验。P<0.05表示差异有统计学意义。
2 结果
2.1 CD133、CD44、SOX2、OCT4、ALDH1 在非小细胞肺癌组织中的表达情况
CD133、CD44、SOX2、OCT4、ALDH1 蛋白阳性表达为境界清晰、突出于背景的棕黄色,CD133阳性颗粒主要定位在细胞质和细胞膜,CD44蛋白主要定位于细胞膜,ALHD1定位于细胞质,SOX2定位于细胞核,OCT4定位于细胞核和细胞质。CD133、CD44、SOX2、OCT4、ALDH1在70例NSCLC组织中阳性表达率分别为88.57%、98.57%、100.00%、100.00%、100.00%,强阳性表达率分别为 48.57%、67.14%、67.14%、31.43%、50.00%。
2.2 CD133、CD44、SOX2、OCT4、ALDH1 间共表达的关系
在 NSCLC 组织中 CD133、CD44、SOX2、OCT4、ALDH1间共表达的关系见表1,经统计学分析,只有CD44与SOX2共表达存在统计学意义(P=0.028),提示NSCLC组织中CD44与SOX2的表达可能存在共同表达的关系。

表1 CD133、CD44、SOX2、OCT4、ALDH1 间共表达的关系(例)
2.3 双强阳性指标的组合CD44++SOX2++、CD44++ALDH1++、SOX2++ALDH1++、CD133++SOX2++与NSCLC病理分化程度的关系(表2)
NSCLC 组织中 CD133、CD44、SOX2、OCT4、ALDH1某两个指标均为强阳性的比例较高,70例NSCLC中 CD44++SOX2++ 组合占38.57%(27/70),CD44++ALDH1++ 组合占 34.29%(24/70),SOX2++ALDH1++组合占34.29%(24/70),CD133++SOX2++组合占31.43%(22/70)。上述表现双强阳性组织与其他非双强阳性NSCLC组织比较,病理分化程度方面均有差别,双强阳性NSCLC组织多为中、低分化,而非双强阳性NSCLC组织倾向高分化。双强阳性组织与其他非双强阳性NSCLC组织在病理分化程度方面比较存在统计学上差异(P值分别为 0.0022、0.0463、0.0463、0.003)。
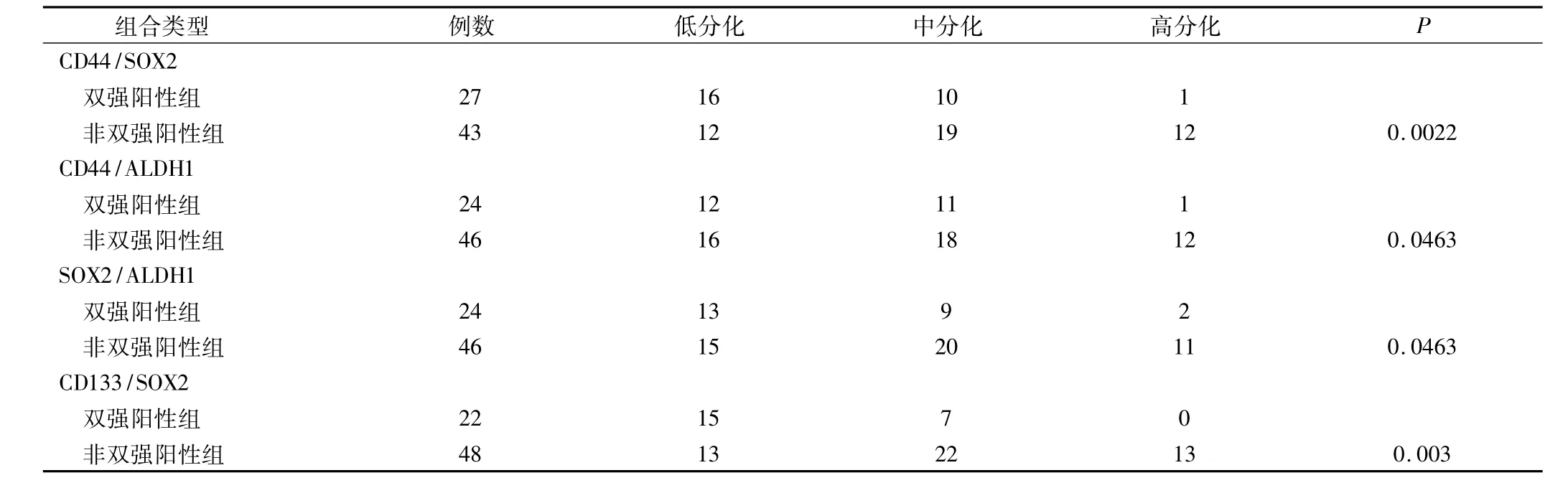
表2 各组合与NSCLC病理分化程度的关系(例)
3 讨论
肺癌是目前世界范围内发病率最高的恶性肿瘤,其中,非小细胞肺癌占肺癌的80%以上,1/3的患者诊断时已经为中晚期,严重威胁人们的身心健康[6]。目前尚无有效的方法早期发现及治愈这种疾病,中晚期肺癌经过系统的放化疗甚至是靶向治疗联合化疗的无病进展期6.2 个月、总生存期 12.3 个月左右[7],总体的治疗效果仍然较差。目前肿瘤方面的研究热点之—肿瘤干细胞学说有望在肿瘤的预防、诊断及治疗上取得突破。肿瘤干细胞(tumor stem cell,TSC)是肿瘤内存在一小部份具有胚胎干细胞类似性质的细胞,它具有无限增值、自我更新的能力,并保持着多潜能分化及高致癌性的特点[8],它处于静止期,从而使常规治疗失败及转移、耐药的出现[2]。目前,有关肺癌干细胞的研究已经成为肺癌研究的热点之一。
最早确定的急性白血病的肿瘤干细胞的表型是CD34+CD38-Thy-[9],另外一个比较明确的肿瘤干细胞标志为乳腺癌肿瘤干细胞表型;CD44+CD24-/low[10-11]。目前,肺癌干细胞及其特异性标记物尚不明确[12],研究最多的是参照其他肿瘤干细胞和人体多能干细胞的标记物,如:CD133、CD44、OCT4、SOX2、ALDH1 等[13]。本研究以 CD133、CD44、OCT4、SOX2、ALDH1为研究对象,研究它们在NSCLC组织中的表达的相互关系。结果显示 CD133、CD44、OCT4、SOX2、ALDH1在NSCLC组织中阳性表达率及强阳性表达率均很高。人CD133基因位于4号染色体,CD133蛋白为细胞膜蛋白超家族成员,它主要在细胞及器官成熟过程中起转录调控作用,它是脑胶质瘤肿瘤干细胞标记物,并与脑胶质瘤化疗耐药有关[14]。本研究发现CD133在NSCLC组织中的表达阳性率达88.57%,其中强阳性表达率为48.57%;CD44是1种黏附分子,与恶性肿瘤的发生、发展关系密切,本研究CD44表达的阳性率为98.57%,其中强阳性表达率为67.14%,与有些研究发现CD44在肺鳞癌中的表达率为89.5%相仿[15]。SOX2、OCT4、ALDH1 均是多能干细胞的标记物,也是胚胎干细胞的标记,本研究发现 SOX2、OCT4、ALDH1在NSCLC中表达的阳性率均为100%,其中强阳性表达率分别为 67.14%、31.43%、50.00%。SOX2是一个维持干细胞多潜能性的基因,Sholl等[16]研究提示94%的肺鳞癌干细胞表达SOX2;OCT4也称OCT3,是属于POU转录因子家族的一员,有研究发现 OCT4分为 OCT4-A和 OCT4-B,其中,OCT4-A+参与肺腺癌的形成[17];ALDH1(乙醛脱氢酶1)是在干细胞分化早期催化视黄醇氧化为视黄酸的1种酶,是造血组织或其他一些组织中正常干细胞生长、分化的必需物质。
在 NSCLC 组织中 CD133、CD44、SOX2、OCT4、ALDH1之间共表达的关系分析发现,CD44与SOX2存在共表达统计学意义(P=0.028),这提示在NSCLC组织中CD44与SOX2的表达可能存在共同表达的关系。但令人费解的是,既然CD44与SOX2在NSCLC组织中存在共同表达的关系,那么它们在NSCLC组织中某些生物学行为应该是一致的,但在与NSCLC临床因素分析中发现,CD44在高龄患者中表达明显,而SOX2在低年龄患者中表达明显。故考虑CD44与SOX2在NSCLC组织中共表达关系可能是由于两者强阳性表达率高影响所致,其现实意义有待进一步研究。
在肿瘤干细胞的研究中发现肿瘤干细胞的表型往往由几个特征性的标记物组合而成,如急性白血病肿瘤干细胞的表型是CD34+CD38-Thy-[9],乳腺癌肿瘤干细胞表型是 CD44+CD24-/low[10-11]等。NSCLC肿瘤干细胞的表型是否也是由两个或多个标记物分子特征性组合而成的呢?参照上述肿瘤干细胞由两个或多个分子标记组成的方法,本研究发现NSCLC组织中CD133、CD44、SOX2、OCT4、ALDH1 的表达某两个指标均为强阳性的比例较高,如:70例NSCLC中CD44++SOX2++组合占38.57%,CD44++ALDH1++组合占34.29%,SOX2++ALDH1++ 组合占 34.29%,上述分子表型为双强阳性的组织与其他非双强阳性NSCLC组织比较,在病理分化程度上均有差别,双强阳性的组织更多为中、低分化的NSCLC组织,而非双强阳性NSCLC组织倾向高分化,而且它们与其他非双强阳性NSCLC组织在分化程度上比较存在统计学上差异(P 值分别为 0.0022、0.0463、0.0463、0.003)。总之,CD44++SOX2++、CD44++ALDH1++、SOX2++ALDH1++、CD133++SOX2++这4个组合有可能为研究NSCLC肿瘤干细胞标志物提供参考,需要通过检测及分离表达此类标记的阳性的细胞,进一步行致瘤实验验证。
[1]John Mendelsohn等著;许兴智等译.癌症的分子基础(原书第3版).北京:科技出版社,2011:113.
[2]Terpe HJ,Storkel S,Zimmer U,et al.Expression of CD44 isoforms in renal cell tumors.Positive correlation to tumor differentiation〔J〕.Am J Pathol,1996,148(2):453.
[3]许良中,杨文涛.免疫组织化学反应结果的判断标准〔J〕.中国癌症杂志,1996,6(4):229.
[4]王翌庆.干细胞标记CD133、CD166和CD44在大肠癌中表达的免疫组化研究〔D〕.浙江大学医学院,2010:4.
[5]D Horst,L Kriegl,J Engel,et al.CD133 expression is an independent prognostic marker for low survival in colorectal cancer〔J〕.Br J Cancer,2008,99(8):1285.
[6]Rivera S,Quéro L,Wong Hee Kam S,et al.Targeted therapies and radiation therapy in non-small cell lung cancer〔J〕.Cancer Radiother,2011,15(6-7):527.
[7]Sadowska AM,Nowé V,et al.Customizing systemic therapy in patients with advanced non-small cell lung cancer〔J〕.T-her Adv Med Oncol,2011,3(4):207.
[8]Yue W,Jiao F,Liu B,et al.Enrichment and function research of large cell lung cancer stem cell-like cells〔J〕.Zhong Guo Fei Ai Za Zhi,2011,14(6):484.
[9]Miyamoto T,Weissman IL,Akashi K.AML1/ETO-expressing nonleukemic stem cells in acute myelogenous leukemia with 8;21 chromosomal translocation〔J〕.Proc Natl Acad Sci U S A,2000,97(13):7521.
[10]Al-Hajj M,Wicha MS,Benito-Hernandez A,et al.Prospective identification of tumorigenic breast cancer cells〔J〕.Proc Natl Acad Sci USA,2003,100(7):3983.
[11]王俊艳.乳腺癌干细胞研究进展〔J〕.实用癌症杂志,2011,26(2):210.
[12]姜 尧,刘雁勇,左萍萍.肿瘤干细胞学说在非小细胞肺癌研究中的应用〔J〕.医学综述,2011,17(1):56.
[13]袁 源,钟 竑.诱导多能干细胞的研究进展〔J〕.实用医学杂志,2010,26(6):897.
[14]向定朝,许惠中,王存祖.胶质瘤化疗耐药细胞与胶质瘤干细胞的关系〔J〕.实用癌症杂志,2012,27(4):423.
[15]Shimada Y,Ishii G,Nagai K,et al.Expression of podoplanin,CD44,and p63 in squamous cell carcinoma of the lung〔J〕.Cancer Sci,2009,100(11):2054.
[16]Sholl LM,Long KB,Hornick JL.SOX2 expression in pulmonary non-small cell and neuroendocrine carcinomas〔J〕.Appl Immunohistochem Mol Morphol,2010,18(1):55.
[17]Karoubi G,Cortes-Dericks L,Gugger M,et al.Atypical expression and distribution of embryonic stem cell marker,OCT4,in human lung adenocarcinoma〔J〕.J Surg Oncol,2010,102(6):689.

